免疫检查点抑制剂治疗带来的问题
——免疫相关不良反应ir AEs①
2022-11-25杨善茹邰日升屈述韬
杨善茹 邰日升 王 庚 屈述韬 雷 蕾 李 娜
(哈尔滨医科大学组织学与胚胎学教研室,哈尔滨 150081)
免疫治疗与传统放化疗相比治疗效果显著,尤其是对晚期癌症患者,其副反应也相对较小。但免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗肿瘤的同时却会破坏免疫耐受引起炎症反应,被称为免疫相关不良反应(immune-related adverse events,irAEs),某些严重的irAEs会导致较高的病死率。irAEs详细的发生机制至今尚未完全阐明,可能与免疫检查点通路在维持人体免疫稳态中的作用被破坏有关,是针对正常组织亢进的T细胞应答反应。具体可能是由肿瘤和器官共同的抗原触发的,即肿瘤与某器官的表面上存在着相同或十分相似的抗原,在ICIs治疗后T细胞被大量激活,T细胞根据共同的抗原同时靶向肿瘤和器官,在正常的组织器官上产生毒性反应(图1)。

图1 ir AEs发生机制Fig.1 ir AEs mechanism
irAEs具有鲜明的特点,它常表现为全身多脏器发生,且不同肿瘤irAEs的类型也不同,例如在肺癌患者中免疫性肺炎较常见,肝癌患者中肝功能改变与转氨酶升高较常见,而黑色素瘤患者皮肤的色素脱失则更为多见,因此用ICIs治疗时应注重器官特异性。其次PD-1/PD-L1单抗与CTLA-4单抗引起的irAEs也有所不同,并且不同公司生产的PD-1/PD-L1单抗导致的irAEs也略有差异。根据《不良反应通用术语标准》4.0版将irAEs分为四级:Ⅰ级毒性症状轻微,可以在密切监测下继续使用ICIs;Ⅱ级毒性需考虑暂停用药,直至症状恢复实验室指标至Ⅰ级或更低,可以酌情考虑使用皮质类固醇;Ⅲ级毒性需暂停使用ICIs,并同时开始高剂量皮质类固醇治疗;Ⅳ级毒性具有生命危险,需要立刻并永久停止使用ICIs,进行积极的类固醇药物治疗,建议进行多学科合作,尽早快速处理好免疫相关性的炎症,对保护患者具有重要意义。
1 常见ICIs引发的ir AEs
1.1 抗CTLA-4抗体产生的irAEs Ipilimumab是首个被美国食品药品监督管理局(food and drug administration,FDA)批准生产的抗CTLA-4抗体,被用于治疗黑色素瘤。CTLA-4是在T细胞表面表达的一种受体,其竞争性抑制CD28与其配体CD80和CD86的结合,从而抑制T细胞活化,削弱免疫功能。CTLA-4激活可以抑制NF-κB信号传导途径,导致IL-2产生受损[3]。CTLA-4还可以在调节性T细胞上组成性表达,从而促进肿瘤微环境(tumor microenvironment,TME)中的免疫抑制[4]。CTLA-4单抗抑制了CTLA-4相关通道,使得T细胞活化,增强免疫功能。Ipilimumab常引起轻度(Ⅰ级或Ⅱ级)irAEs,主要影响皮肤和肠道,而严重的(Ⅲ级和Ⅳ级)irAEs并不常见,它们通常通过全身皮质类固醇治疗来解决[5]。研究发现,将Ipilimumab剂量从3 mg/kg升至10 mg/kg时,其Ⅲ级和Ⅳ级不良反应发生率从5%升至18%,而0.3 mg/kg时发生率为0,所以得出Ipilimumab的不良反应是剂量依赖性[1]。大多数≥Ⅲ级irAEs发生在开始治疗的8~12周内,其中腹泻和结肠炎是最常见的,皮疹通常最早出现。
1.2 抗PD-1抗体与抗PD-L1抗体产生的irAEs
1.2.1 PD-1与PD-L1的免疫逃避机制 PD-1(也称CD279)是一种重要的免疫抑制受体,为免疫球蛋白超家族,其识别并结合内源性配体PD-L1和PD-L2,主要表达于活化T细胞和TME,还可以在自然杀伤细胞、B细胞、巨噬细胞和滤泡辅助性T细胞的表面表达。PD-L1(也称B7-H1或CD274)属于B7家族,主要在黑色素瘤、卵巢癌、肺癌等肿瘤细胞中高表达。PD-1/PD-L1通路的免疫逃避机制:当T细胞表面的PD-1与PD-L1结合后,T细胞胞质区的免疫受体酪氨酸转换基序的酪氨酸磷酸化,磷酸化的酪氨酸招募下游的蛋白酪氨酸磷酸酶2后,不仅能抑制细胞外调节激酶的活化,还可以激活磷脂酰肌醇3-激酶和丝氨酸-苏氨酸蛋白激酶,从而抑制T淋巴细胞的增殖和IL-2、IL-10和IFN-γ的分泌,使之产生免疫逃避,导致肿瘤的发展与恶化[6]。
1.2.2 抗PD-1抗体与抗PD-L1抗体的异同点FDA批准生产的抗PD-1抗体最常见的为Nivolumab和Pembrolizumab,抗PD-L1抗体最常见的为Atezolizumab、Avelumab和Durvalumab,它们基于临床试验证明了对各种恶性肿瘤治疗有效[6]。PD-1单抗抗肿瘤作用效果与PD-L1单抗非常相似:两者均可以增强肿瘤特异性T细胞的活性。
但由于两者作用靶点不同,因此对于这一通路的关闭机制也不同。PD-1单抗直接作用于T细胞上的PD-1,使得T细胞重新获得活力的同时也失去了调节其自身“刹车”的开关,从而更容易引起相关的自身免疫反应。PD-L1单抗作用于肿瘤细胞上表达的PD-L1,因此更具针对性,在机理上也更不容易引起T细胞对正常组织的损伤。由PD-1/PD-L1单抗引起的严重irAEs主要有肺炎(尤其是间质性肺炎),肝炎和神经毒性作用。一项收录了多项免疫治疗研究数据的分析发现[7],PD-1单抗引起的irAEs概率要远远超过PD-L1单抗,分别为26.8%和6.1%。此外,还有单纯对照两者引起间质性肺炎差别的研究发现,PD-1单抗比PD-L1单抗在引起间质性肺炎的总体概率分别是3.6%和1.3%,在引起非常严重的间质性肺炎上分别是1.1%和0.4%。总之,二者免疫抑制剂在作用机制和治疗效果上存在些许不同之处,其实际差异需要更多严谨的临床试验数据来支持和验证。
1.3 Ipilimumab+Nivolumab联合治疗产生的irAEs 众多文献说明免疫联合治疗的效果更优于单项药物的治疗,而药物毒性也随之增长,最常见的联合应用CTLA-4单抗和PD-1单抗的联合使用会增加irAEs的发生率和严重性[1]。研究发现,接受Ipilimumab(3 mg/kg)+Nivolumab(1 mg/kg)治 疗 有55%患者发生≥Ⅲ级irAEs,而在单独接受相同药物和药物剂量的患者中,这一比例分别占Ipilimumab和Nivolumab单药治疗组的27.3%和16.3%[8]。与单药治疗相比,使用Ipilimumab+Nivolumab联合治疗的irAEs在治疗过程中发生更早,也更加严重,导致患者病死的原因多为结肠炎或心肌炎,罹患心肌炎irAEs患者病死率最高。
2 ir AEs的器官毒性分类
2.1 皮肤黏膜毒性 皮肤黏膜毒性反应是irAEs最常见也是最早出现的症状,最常表现为皮疹、瘙痒和白癜风。其他皮肤黏膜毒性反应还有干燥症、口腔炎、荨麻疹、光敏反应、斑秃和多汗症,严重的有Sweet综合征、Stevens Johnson综合征和中毒性表皮坏死松解症,但极少发生。皮疹呈网状分布,躯干和四肢均有累及,具有红斑、水肿和斑丘疹等表现,并伴有瘙痒。CURRY等[9]的回顾性研究显示皮疹发生概率在抗PD-1治疗中为11%,抗PD-L1治疗为8%。Meta分析显示Nivolumab和Pembrolizumab引起皮疹的发生率分别为14.3%和16.7%,通常是轻中度不良反应。瘙痒是最常见的皮肤不良反应,多与皮疹同时出现,也先于皮疹或不伴皮疹出现。Meta分析显示Nivolumab和Pembrolizumab引起的所有级别的瘙痒发生率为13%~20%。Ipilimumab与PD-1/PD-L1单抗联合使用时发生率更高,PD-L1单抗的治疗时发生率略低[10]。白癜风常见于暴露部位,也可发生于皮肤转移及淋巴结清扫瘢痕周围。在接受PD-1单抗治疗的黑素瘤患者中较常出现,抗PD-L1治疗其次,在其他肿瘤中少有报道。7.5%接受Nivoluma治疗的患者和8.3%接受Pembrolizumab治疗的患者观察到白癜风发生与ICIs治疗晚期黑色素瘤疗效相关[11]。在一项对67例黑色素瘤患者接受Pembrolizumab治疗的研究发现,出现白癜风的患者在无进展生存期(progression free survival,PFS)和总体生存期(overall survival,OS)均有改善。在黑色素瘤和其他肿瘤中,类皮炎和海绵状组织病理改变的出现也与良好的预后相关[11]。
2.2 胃肠道毒性(gastrointestinal irAEs,GI irAEs)GIirAEs常见的反应有便血、腹泻和结肠炎。据报道,30%~40%的患者发生由ICIs引起的腹泻和结肠炎[12](表1),联合治疗比单药治疗更频繁的出现GIirAEs[13]。但这些临床症状并不能完全用来评定irAEs分级,需要借助CT、内窥镜或组织学检查。由ICIs诱发的结肠炎其上皮的结构通常能够得到很好的保留,因此即使没有肉眼可见的病变,也应获取活检样本以评估潜在的微观结肠炎发生的可能性[1]。研究显示,35%患者使用抗CTLA-4治疗发生腹泻,接受抗PD-1/PD-L1治疗仅17%患者出现腹泻。因为CTLA-4在维持肠道免疫稳态方面起着关键作用,阻断CTLA-4可导致肠道菌群失调,引起腹泻和结肠炎的高发病率,且使用Ipilimumab的患者约10%会发展成严重的结肠炎。结肠炎发生的频率和严重程度与剂量有关,需要严格监控药物的剂量和尽早发现irAEs,否则将造成严重脱水和结肠穿孔的风险[17]。
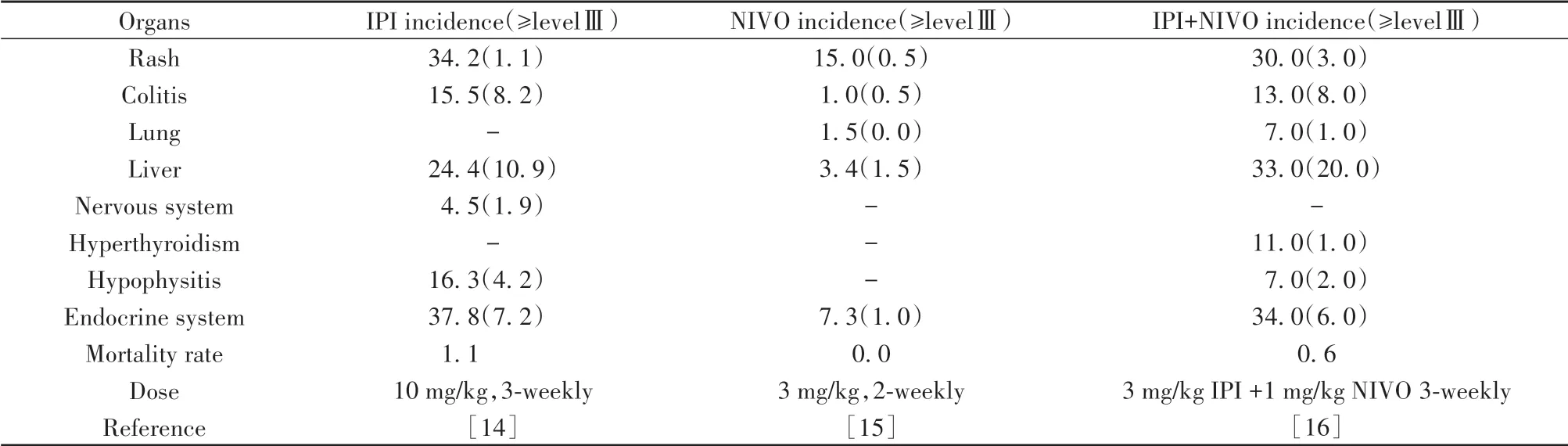
表1 ir AEs在黑色素瘤患者各器官中的发生率[例(%)]Tab.1 Incidence of ir AEs in various organsin melanoma patients[n(%)]
2.3 肺毒性 在肺毒性方面,irAEs总发生率为5%,约4%的患者会发生由抗PD-1/PD-L1引起的肺炎,抗CTLA-4引起的发病较低。ICIs引起的肺毒性可表现为多种临床病理类型,包括非特异性间质性肺炎、组织型肺炎、结节样反应、过敏性肺炎、急性间质性肺炎、急性纤维素性肺炎或弥漫性肺泡损伤[18-20]。肺癌患者尤其是非小细胞肺癌(non-smallcell lung cancer,NSCLC)和接受联合免疫治疗的患者发生严重毒性的风险更高[21]。与黑色素瘤患者相比,在NSCLC患者中将抗PD-1/PD-L1作为一线治疗方法更易诱发肺炎。研究表明,原先存在的肺纤维化和吸烟者或既往吸烟者会大大增加诱发肺炎的风险与肺炎恶化的情况。当发生中度(Ⅱ级)以上肺炎时,根据现行指导方针,治疗包括停用ICIs和给予全身性静脉给药(一般是每天1 mg/kg的Prednisone),通常需要缓慢的逐渐减量[22]。对于难治性病例,建议使用额外的免疫抑制剂,包括Infliximab、Cyclophosphamide和Mycophenolate。虽然抗PD-1抗体治疗发生肺毒性概率较高,但疗效不可忽视。目前Pembrolizumab和Nivolumab在NSCLC治疗中已取得突破性进展,研究显示,Pembrolizumab治疗进展期表达PD-L1的NSCLC患者的中位PFS明显长于铂类制剂化疗方案(10.3个月vs6.0个月)[23]。Pembrolizumab获指南推荐用于驱动基因阴性NSCLC的一线治疗。另外,CTLA-4和PD-1基因的多态性与不同的自身免疫性疾病密切相关。例如CTLA-4多态性可能与增加哮喘的易感性有关[24],PD-L1在慢性阻塞性肺疾病患者的巨噬细胞和树突状细胞上表达减少,因此,推测继续抑制慢性阻塞性肺疾病中受损的PD-1/PD-L1可能增加气道炎症,促进疾病进展[20]。
2.4 内分泌毒性 ICIs最常影响脑垂体、甲状腺和胰腺,很少影响肾上腺和甲状旁腺的内分泌疾病。脑垂体炎是常见的内分泌疾病,也是一种严重的irAEs,它被定义为一种垂体炎症疾病,其特征是免疫细胞浸润垂体,主要是淋巴细胞和浆细胞,导致垂体扩张和萎缩[25]。抗CTLA-4单药治疗和联合治疗的垂体炎发病率最高,发病率呈剂量依赖性(3 mg/kg Ipilimumab的irAEs发生率为1%~4%,10 mg/kg Ipilimumab的irAEs发生率为16%)[26]。垂体炎的症状可能因受影响的垂体区域而异,促肾上腺皮质激素和促甲状腺激素缺乏症最常见于抗CTLA-4相关的垂体炎。出现垂体炎临床特征的患者应接受甲状腺、肾上腺和性腺轴的检查。
与抗CTLA-4相比,抗PD-1/PD-L1频繁的报道甲状腺irAEs。甲状腺irAEs的特征是新发甲状腺功能减退症,比甲状腺功能亢进症更常见。甲状腺功能减退症的总发病率为6.6%,Ipilimumab治疗的发病率最低(3.8%),联合治疗的发病率最高(13.2%)。在一项对91例使用Nivolumab治疗的甲状腺功能障碍患者进行评估的研究中,23例(25%)在平均随访10.1个月期间出现甲状腺异常,19例(21%)出现新发甲状腺功能障碍,14例出现甲状腺功能减退,5例出现甲状腺毒症,所有患者的甲状腺功能减退症状均恶化[27]。这是由于开始使用抗PDL1治疗后,甲状腺激素替代剂量增加了50%。一般甲状腺机能减退是永久性的。另一项研究,45例患者中多个患者预后出现甲状腺功能不全,22%的患者最初表现为甲状腺功能减退,其余78%患者表现为甲状腺毒症,其中80%又发展为甲状腺功能减退。这取决于患者的发病阶段和程度,但通常不需要使用类固醇或停止免疫治疗。
3 ir AEs有可能成为ICIs治疗的临床生物标志物
ICIs治疗给癌症患者带来了福音。然而仍有一部分患者对治疗没有达到预期的反应,这就需要识别生物标志物。一般免疫系统的生物标志物分为两大类:来自肿瘤或来自免疫系统。研究表明相比于CTLA-4单抗,irAEs与PD-1/PD-L1单抗有更强的相关性。在不同的疾病位点,使用PD-1/PD-L1单抗进行治疗时出现irAEs的患者通过总体应答率(ORR)、PFS和OS来衡量其预后情况。结果表明,与无毒性的患者相比,经历了irAEs患者在PFS、OS和ORR方面有显著改善。在一项观察性研究中,270例NSCLC患者接受了至少一剂PD-1/PD-L1单抗的治疗,44%患者有不同程度的不良反应,结果表明irAEs患者PFS、OS和ORR均高于未出现irAEs的患者,ORR(22.9%vs5.7%,P<0.000 1)、PFS(8.05个月vs2.59个月,P=0.005)和OS(NR个月vs18.2个月,P=0.01)[2]。另外一项在对114例使用抗PD-1治疗的转移性头颈部鳞状细胞癌患者的分析研究中,与无irAEs患者相比,irAEs患者的ORR(30.6%vs12.3%,P=0.02)、PFS(6.9个月vs2.1个月,P=0.000 4)和OS(12.5个月vs6.8个月,P=0.000 7)均有改善[28]。综上表明,irAEs很可能是ICIs治疗一个潜在的临床生物标志物。
4 影响预后的其他因素
4.1 与治疗时间呈正相关 在讨论irAEs与ICIs之间关系时,还需要注意治疗的时间,这是irAEs和ICIs反应之间的潜在混杂因素。经历了irAEs的患者相当于在ICIs上停留了更长的时间,因此,比没有经历irAEs的患者有更好的预后[2]。在一项对1 019例接受Pembrolizumab和常规化疗的ⅢA、ⅢB和ⅢC期黑色素瘤患者的辅助研究中,出现irAEs的患者与未出现irAEs的患者相比其无复发生存期延长[29]。与化疗患者相比,Pembrolizumab治疗的患者在发病后复发或死亡的风险(风险比0.37,95%可信区间0.24~0.57)较发病前降低(风险比0.61,95%可信区间0.49~0.77,P=0.028)。值得注意的是,与抗CTLA-4相比,irAEs的发生与PD-1/PD-L1单抗反应的相关性更强。可能更多的是由于不同药物之间的作用机制不同,或者治疗时间不同(CTLA-4单抗服用4剂后停药,PD-1/PD-L1单抗长期服药)[2]。
4.2 与皮质类固醇剂量呈负相关 出现irAEs的患者需要皮质类固醇治疗。一项关于使用Ipilimumab治疗时发生垂体炎的黑色素瘤患者的小型研究显示,与使用高剂量皮质类固醇治疗的患者相比,使用低剂量皮质类固醇的患者有更好的生存率[30]。另一项对使用抗PD-1和抗PD-L1抗体的NSCLC患者的研究表明,基线(开始治疗时)接受皮质类固醇治疗的患者比未接受皮质类固醇治疗的患者情况更差[31]。可以推测,虽然irAEs与更好的预后相关,但这种相关性在高剂量皮质类固醇的作用下部分减弱,因此需要对使用具体不同剂量皮质类固醇治疗的患者进行比较,以帮助解决这一问题。数据表明大量皮质类固醇的应用会使患者机会感染的风险大大提高,建议对任何irAEs延长免疫抑制治疗时间(>4~6周)的患者作预防性处理。此外,有学者提出皮质类固醇的免疫抑制作用可能影响免疫检查点治疗的抗肿瘤效应,对此目前无明确数据支持[32]。
5 结论
ICIs已成为一个新兴的研究领域,引起的irAEs与肿瘤治疗及预后之间存在着密切联系。总而言之,ICIs治疗的不良反应较与化疗放疗更低、效果更好,在未来癌症治疗中具有良好前景。大多数irAEs可以通过暂停给药或给予皮质类固醇激素得以控制,其处理的核心原则为早期预防、早期诊断,并给予恰当管理。深入研究irAEs的发生机制和解决方法,利用其作为生物标志物的特征预知和掌握肿瘤的走向,是ICIs进一步发展所需攻克的一大难题。