MicroRNA-137通过Wnt信号通路对宫颈癌细胞增殖、凋亡及裸鼠移植瘤的作用研究*
2022-11-25高淼刘莉关阿娜王俊霞
高淼,刘莉,关阿娜,王俊霞
(内蒙古科技大学包头医学院第二附属医院 妇产科,内蒙古 包头 014030)
宫颈癌是妇科最常见的恶性肿瘤之一,近年来发病率与病死率日趋增加[1]。临床研究显示,宫颈癌患者一般预后不良、生存期短,这与其复杂的发病机制有关[2]。因此探究与宫颈癌的发生、发展有关的分子生物学标志物对延长患者生存期、降低病死率具有重要意义。MicroRNA是机体内十分重要的非编码RNA分子,在肿瘤的发展过程中具有重要作用[3]。本课题组之前的研究[4]发现,microRNA-137(miR-137)可以靶向调控Wnt5a,抑制宫颈癌细胞的生长,并发现该作用与抑制Wnt信号通路的活化有关。分泌型蛋白Dickkopf-1(DKK1)是Wnt通路的抑制剂,基质金属蛋白酶-7(matrix metalloproteinase 7,MMP-7)是Wnt通路下游的重要靶基因,两者与多种肿瘤的发展密切相关[5-6]。但目前关于miR-137与MMP-7/DKK1之间关系的研究较少。因此,本研究通过人宫颈癌细胞HeLa中过表达miR-137,以探究其对宫颈癌细胞增殖与凋亡的作用,以及其对Wnt上下游通路的影响。
1 材料与方法
1.1 细胞、动物、试剂及仪器
人宫颈癌细胞HeLa购于上海研一生物科技有限公司。雌性健康BALB/c裸鼠30只,6~8周龄,体重(20±2)g,购于内蒙古医科大学实验动物中心[实验动物生产许可证号:SCXK(蒙)2020-0001,实验动物使用许可证号:SYXK(蒙)2020-0003]。Cell Counting试 剂 盒8(WST-8/CCK-8)购 自 英 国Abcam公司,Annexin V/FITC凋亡试剂盒购自北京利维宁生物科技有限公司,兔抗小鼠Wnt、MMP-7、DKK1、一抗、辣根过氧化物酶标记的山羊抗兔二抗均购自英国Abcam公司,MiRNeasy Mini(r)Kit试剂盒购自德国Qiagen公司,FastKing RT与Super Real PreMix Plus试剂盒购自北京天根生化试剂有限公司。CyFlow Cube6流式细胞仪购自广州吉源生物科技有限公司,二氧化碳培养箱购自广州市康恒仪器有限公司,DR-200BC酶标仪购自济南来宝医疗器械有限公司,BSF-58荧光显微镜购自上海巴拓仪器有限公司,Light Cycler 480 qRT-PCR仪购自瑞士罗氏公司,Invitrogen iBright成像系统购自美国赛默飞世尔科技有限公司。
1.2 细胞培养与分组转染
将人宫颈癌细胞HeLa 按照常规方法复苏,以1×105个接种在6孔板中,在37℃,5%二氧化碳培养箱中培养24 h,随机分为3组,每组设置5个复孔。以miR-137-mimic质粒转染细胞为miR-137组,空载质粒转染细胞为NC组,只加入等量转染试剂不做其他处理为空白组,严格按照转染试剂盒说明书操作。3组转染后继续培养48 h,并在荧光显微镜下观察转染情况。
1.3 CCK-8法检测细胞活性
用胰酶消化稳定转染并处于对数生长期的3组细胞,以2×103个的密度接种于96孔板继续孵育,分别于12 h、24 h、48 h加入10 μL CCK-8试剂,继续在37℃下孵育2 h。采用DR-200BC酶标仪在450 nm波长处检测光密度(OD)值。
1.4 流式细胞仪检测细胞凋亡
用胰酶消化稳定转染且处于对数生长期的3组细胞,短暂离心后用PBS吹打沉淀呈细胞悬液,每组取300 μL,加入5 μL Annexin V/FITC和PI,混合均匀后,室温下放置15 min,用流式细胞仪检测各组细胞的凋亡。
1.5 实时荧光定量聚合酶链反应(qRT-PCR)检测细胞Wnt、MMP-7、DKK1、miR-137 mRNA相对表达量
使用MiRNeasy Mini(r)Kit试剂盒提取稳定转染细胞的mRNA,用FastKing RT试剂盒逆转录成cDNA。使用Super Real PreMix Plus试剂盒扩增进行qRT-PCR。反应条件:95℃预变性15 min(1个循环);PCR扩增反应条件:95℃10 s,60℃20 s,72℃20 s,共40个循环。引物序列见表1。β-actin为Wnt、MMP-7、DKK1的内参基因,U6为miR-137的内参基因,采用2-ΔΔCt法计算目的基因相对表达量。

表1 引物序列
1.6 Western blotting检测Wnt、MMP-7、DKK1蛋白相对表达量
取稳定转染并处于对数生长期的细胞,加入RIPA裂解液提取总蛋白,BCA法分析并测定蛋白质浓度。各提取好的样品进行SDS-PAGE凝胶电泳,将蛋白质转移到聚偏氟乙烯(PVDF)膜上,然后在5%脱脂牛奶中封闭1 h。使用1∶500稀释的一抗与PVDF膜在4℃下孵育过夜,然后在室温下用1∶2 000稀释的辣根过氧化物酶(HRP)标记的二抗孵育2 h。使用Pierce ECL试剂进行免疫印迹发光显示,然后使用Image J分析软件进行定量。以β-actin作为内参蛋白计算Wnt、MMP-7、DKK1蛋白的相对表达量。
1.7 裸鼠移植瘤
30只BALB/c裸鼠随机分为3组,每组10只。取3组稳定转染且处于对数生长期的细胞0.3 mL(1×108个/mL)皮下接种于裸鼠背部。接种空白组细胞的裸鼠为空白组,接种NC组细胞的裸鼠为NC组,接种miR-137组细胞的裸鼠为miR-137组。接种的第3天开始测量肿瘤体积(每3天测量1次),接种的第30天测量肿瘤体积后处死各组裸鼠(观察期间共有4只裸鼠死亡,剔除后其余数据纳入分析统计)。根据第30天的肿瘤体积计算抑瘤率:肿瘤体积(V)=长×宽2/2;抑瘤率=(1-V实验/V空白)×100%。
1.8 统计学方法
数据分析采用SPSS 23.00统计软件。计量资料以均数±标准差()表示,比较做单因素方差分析或重复测量设计的方差分析或t检验,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞慢病毒转染结果
miR-137组转染48 h后转染率达80%以上,转染成功。见图1。

图1 miR-137组细胞转染荧光图 (×200)
2.2 3组细胞活性比较
空白组、NC组、miR-137组12 h、24 h、48 h的OD值比较,采用重复测量设计的方差分析,结果:①不同时间点的OD值有差异(F=10.741,P=0.000);②3组的OD值 有 差异 (F=13.218,P=0.000),miR-137组OD值较空白组和NC组低,相对细胞活性较低;③3组OD值的变化趋势有差异(F=11.651,P=0.000)。见表2与图2。

图2 3组不同时间点OD值的变化趋势
表2 3组细胞各时间点的OD值比较 ()
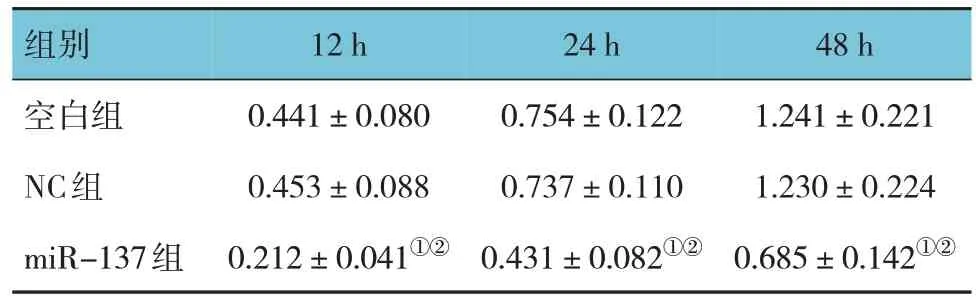
表2 3组细胞各时间点的OD值比较 ()
注:①与空白组比较,P<0.05;②与NC组比较,P<0.05。
组别空白组NC组miR-137组12 h 0.441±0.080 0.453±0.088 0.212±0.041①②24 h 0.754±0.122 0.737±0.110 0.431±0.082①②48 h 1.241±0.221 1.230±0.224 0.685±0.142①②
2.3 3组细胞凋亡率比较
空白组、NC组、miR-137组细胞凋亡率分别为(5.88±1.07)%、(6.01±1.21)%、(21.18±4.27)%,3组比较,经方差分析,差异有统计学意义(F=55.685,P=0.000);进一步两两比较,miR-137组细胞凋亡率高于空白组和NC组(P<0.05)。
2.4 3组细胞Wnt、MMP-7、DKK1、miR-137 mRNA相对表达量比较
空白组、NC组、miR-137组细胞Wnt、MMP-7、DKK1、miR-137 mRNA相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,miR-137组细胞Wnt和MMP-7 mRNA相对表达量较空白组和NC组降低(P<0.05);miR-137组细胞DKK1和miR-137 mRNA相对表达量较空白组和NC组升高(P<0.05)。见图3和表3。

图3 3组细胞Wnt、MMP-7、DKK1 mRNA表达
表3 3组细胞Wnt、MMP-7、DKK1 mRNA相对表达量比较 ()

表3 3组细胞Wnt、MMP-7、DKK1 mRNA相对表达量比较 ()
注:①与空白组比较,P<0.05;②与NC组比较,P<0.05。
组别空白组NC组miR-137组F值P值Wnt mRNA 1.01±0.21 1.03±0.20 0.28±0.07①②30.781 0.000 MMP-7 mRNA 1.17±0.24 1.15±0.20 0.32±0.08①②33.938 0.00 DKK1 mRNA 0.87±0.17 0.85±0.16 1.23±0.19①②7.572 0.007 miR-137 mRNA 0.51±0.12 0.50±0.12 1.42±0.31①②33.519 0.000
2.5 3 组细胞 Wnt、MMP-7、DKK1 蛋白相对表达量比较
空白组、NC 组、miR-137 组细胞 Wnt、MMP-7、DKK1 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较,miR-137组细胞Wnt、MMP-7 蛋白相对表达量较空白组和NC 组降低 (P<0.05);miR-137 组细胞 DKK1 蛋白相对表达量较空白组和NC 组增加(P<0.05)。见图 4 和表 4。
表4 3组细胞Wnt、MMP-7、DKK1蛋白相对表达量比较()

表4 3组细胞Wnt、MMP-7、DKK1蛋白相对表达量比较()
注 :①与空白组比较,P <0.05;②与NC组比较,P <0.05。
组别空白组NC组miR-137组F 值P 值DKK1蛋白0.23±0.05 0.24±0.05 0.49±0.12①②16.778 0.000 Wnt蛋白0.38±0.10 0.36±0.10 0.09±0.01①②19.577 0.000 MMP-7蛋白0.40±0.11 0.39±0.10 0.10±0.01①②19.617 0.00

图4 3组细胞Wnt、MMP-7、DKK1蛋白表达
2.6 3组裸鼠移植瘤的抑瘤率及肿瘤体积比较
空白组、NC 组、miR-137 组裸鼠移植瘤的抑瘤率分别为(0.00±0.00)%、(1.00±0.11)%、(49.15±5.24)%。空白组与NC 组比较,差异有统计学意义(t=20.328,P=0.000);空白组与miR-137 组比较,差异有统计学意义(t=20.974,P=0.000);NC 组与miR-137 组比较,差异有统计学意义(t=20.543,P=0.000),miR-137 组的抑瘤率上升。
空白组、NC 组、miR-137 组裸鼠不同时间点的肿瘤体积比较,采用重复测量设计的方差分析,结果:①不同时间点的肿瘤体积有差异(F=15.271,P=0.000);②3 组的肿瘤体积有差异(F=28.421,P=0.000),miR-137 组与空白组和 NC 组比较,肿瘤生长缓慢,相对抑瘤效果较好;③3 组的肿瘤体积变化趋势有差异(F=13.418,P=0.000)。见表 5 和图 5。
表5 3组裸鼠移植瘤不同时间点的肿瘤体积比较 (mm3,)

表5 3组裸鼠移植瘤不同时间点的肿瘤体积比较 (mm3,)
组别空白组NC组miR-137组n 8 9 9 3 d 65.01±2.17 60.81±6.23 31.21±2.81 6 d 87.14±5.11 90.17±6.30 45.19±5.07 9 d 112.57±7.14 107.22±11.57 72.39±5.09 12 d 147.81±5.21 135.17±12.08 88.47±10.28 15 d 251.34±12.11 27.017±11.71 122.85±11.08组别空白组NC组miR-137组18 d 387.41±22.08 398.54±20.17 178.71±15.61 21 d 517.32±31.28 506.31±28.77 225.37±12.35 24 d 677.81±40.14 651.38±41.18 356.51±20.49 27 d 836.21±41.91 851.92±46.27 407.82±25.11 30 d 1 017.58±88.37 1 010.99±80.17 510.29±31.46

图5 3组裸鼠移植瘤肿瘤体积不同时间点变化趋势
3 讨论
宫颈癌高发于30~55 岁女性,其病因复杂多样,一般由病毒感染、性生活不洁等因素导致。患者早期出现阴道接触性出血,晚期则出现不规则出血,并伴有恶臭味白带分泌。与其他癌症一样,宫颈癌主要以化疗、放疗和手术治疗为主,但由于早期症状易被患者忽视,治疗效果有限[7-8]。随着分子生物学的发展,针对宫颈癌细胞中特定靶点展开靶向治疗受到越来越多的关注[9]。表皮生长因子受体的靶向治疗已经取得了良好的进展,因此继续寻找宫颈癌发展不同环节的靶点对其治疗非常重要。MIAO 等[10]研究发现miR-137 能抑制宫颈癌细胞的迁移与侵袭,但miR-137 对宫颈癌细胞增殖与凋亡的调控机制尚不明确。
本研究结果显示,与空白组和NC 组相比,miR-137 组细胞在 12 h、24 h、48 h 的 OD 值降低,细胞凋亡率上升,说明过表达miR-137 可以抑制宫颈癌细胞的活性,降低细胞增殖率,促进细胞凋亡。miR-137 位于 microRNA 1 号染色体短臂的 2 区 2 带位置,在多种癌症[11-12]中抑制癌细胞的增殖与侵袭,促使细胞发生程序性死亡。彭荫伟等[13]研究结果显示,miR-137 在宫颈癌细胞中表达低,过表达可靶向调控表皮生长因子受体(EGFR)抑制细胞增殖并促进细胞凋亡。马琛等[14]发现,miR-137 能靶向调控人Twist 相关蛋白1(TWIST1),抑制乳腺癌细胞的侵袭与迁移,并且可以诱导乳腺癌细胞凋亡。此外,还有研究[15]显示miR-137 过表达可以抑制乳腺癌细胞的增殖。结合本研究裸鼠移植瘤的肿瘤体积不同时间点的变化趋势与抑瘤率的结果,说明miR-137 具有抑制宫颈癌细胞增殖、促进细胞凋亡的作用。
本 研 究 中 ,miR-137 组 细 胞 的 Wnt、MMP-7 mRNA 和蛋白相对表达量较空白组和NC 组降低,DKK1 mRNA 和蛋白相对表达量升高,说明miR-137可以调控MMP-7/DKK1 信号通路。DKK 是哺乳动物中高度保守的一类基因家族,其中DKK1 可以与LRP5/6 受体结合,抑制LRP5/6 与Wnt 形成复合物,阻断Wnt 信号通路的活化[16]。Wnt 的经典信号通路在多种肿瘤中均过度活化,抑制Wnt 信号通路可以抑制宫颈癌细胞的生长[17]。既往研究显示[18],上调宫颈癌细胞中DKK1 的表达可以抑制Wnt/βcantenin 通路活化。MMP-7 是Wnt 经典通路下游重要的靶基因,参与细胞外基质的降解,与多种癌症的发展相关。冯倩等[19]研究显示,上调Wnt 通路可以促进MMP-7 蛋白的表达,促进宫颈癌细胞的增殖。此外,WANG 等[20]的研究发现,在肝癌细胞中过表达miR-137 可以降低MMP-7 蛋白的表达,延缓细胞增殖。结合以上研究与本研究结果推测,miR-137 可能通过调控Wnt 上下游的MMP-7/DKK1信号通路,抑制宫颈癌细胞增殖。
综上所述,在人宫颈癌细胞中过表达miR-137可以促进癌细胞凋亡,抑制癌细胞增殖,该作用可能通过调控Wnt 及其上下游MMP-7/DKK1 信号通路有关。本研究为宫颈癌的治疗提供了可能的靶点,但miR-137 调控MMP-7/DKK1 信号通路的机制尚不明确,还需进一步研究证实。
