红棕榈油中4种胡萝卜素同分异构体的色谱分离条件优化及含量测定
2022-11-23牛跃庭YoongJunHao孙亚明谷克仁何丽君
杨 欢,高 莉*,牛跃庭,Yoong Jun Hao,孙亚明,谷克仁,何丽君*
1.河南工业大学 化学化工学院,河南 郑州 450001 2.马来西亚棕榈油总署大马棕榈油技术研发(上海)有限公司,上海 201108
红棕榈油是以红棕榈果肉为原料,经压榨和低温分子蒸馏技术炼制而成的天然植物油,因其含有的胡萝卜素较其他棕榈油更高,故呈现红棕色[1]。红棕榈油因富含胡萝卜素而具有较高的营养价值,可以在预防维生素A缺乏症[2-3]、眼部疾病[4]、心血管病[5]、癌症[6-9]的同时,增强人体的抗氧化能力[10],延缓衰老。胡萝卜素和类胡萝卜素是维生素A的前体[11],因此对红棕榈油中胡萝卜素的分离和检测具有实用价值。除了对胡萝卜素总量的定量检测外,还需要从分子水平对其异构体进行分离和分析。
传统的胡萝卜素的测定方法主要有柱色谱法(CC)、薄层色谱法(TLC)[12]、紫外-可见分光光度法(UV-Vis)[13]、在线超临界流体萃取-超临界流体色谱-串联质谱(SFE-SFC-MS/MS)联用法[14-16]、高效液相色谱法(HPLC)[17-20]等。其中CC法与TLC法样品前处理操作复杂、耗时费力,逐渐被其他先进的分析方法取代。UV-Vis法局限于测定或估算复杂食品基质中的胡萝卜素总量,无法实现对胡萝卜素同分异构体的准确定量分析。SFE-SFC-MS/MS法灵敏度高,但是仪器价格昂贵,且分析物对温度和压力敏感,无法得到推广。HPLC法具有分析快速、重复性好、结果准确可靠、可分离多种同分异构体、实现自动化等诸多优点,成为胡萝卜素定量分析方法中的主要手段。
目前未见针对红棕榈油中胡萝卜素多种同分异构体的同时分离检测分析。作者采用HPLC分离技术,探讨不同色谱条件(色谱柱种类、流动相种类、洗脱模式、流动相比例、流速、柱温等)对α-胡萝卜素、全反式-β-胡萝卜素、13-顺式-β-胡萝卜素和9-顺式-β-胡萝卜素等4种胡萝卜素同分异构体分离的影响,并在优化色谱条件下,对红棕榈油中4种胡萝卜素进行定量检测。
1 材料和方法
1.1 材料与试剂
红棕榈油:马来西亚棕榈油总署大马棕榈油技术研发(上海)有限公司。
氢氧化钾(AR级)、抗坏血酸(AR级)、二氯甲烷(HPLC级):天津市科密欧化学试剂有限公司;三氯甲烷(AR级):烟台市双双化工有限公司;石油醚(沸程:30~60 ℃)、无水乙醇(AR级):天津市天力化学试剂有限公司;无水硫酸钠(AR级):天津市凯通化学试剂有限公司;2, 6-二叔丁基-4-甲基苯酚(BHT)(AR级):阿拉丁试剂(上海)有限公司;甲醇(HPLC级)、乙腈(HPLC级):默克化工技术(上海)有限公司;α-胡萝卜素、全反式-β-胡萝卜素、13-顺式-β-胡萝卜素和9-顺式-β-胡萝卜素:上海惠诚生物科技有限公司。
1.2 仪器与设备
UV-2600紫外-可见分光光度计、LC-2040C 3D超高效液相色谱仪(配置PDA检测器):日本Shimadzu公司;InertSustain C18色谱柱(5 μm,4.6 mm×250 mm):GL Sciences;Ultimate XB-C30色谱柱(5 μm,4.6 mm×250 mm):Welch;C30色谱柱(5 μm,4.6 mm×250 mm):YMC;BSA224S分析天平(0.000 1):德国Sartorius公司;SHA-CA恒温水浴振荡器:上海华燕医疗器械有限公司;B-220旋转蒸发仪:上海亚荣生化仪器厂;SHZ-D循环式多用真空泵:郑州市巩义华玉仪器厂;MTN-2800D氮吹仪:天津奥特赛恩斯仪器有限公司。
1.3 标准溶液的配制
分别称取4种待测胡萝卜素标准品5 mg和BHT 0.025 g,用二氯甲烷溶解并定容至10 mL,储备液置于冰箱4 ℃保存。取适量储备液,用二氯甲烷配制0.2、0.4、0.6、0.8、1.0、2.0、3.0 μg/mL系列混合标准溶液。
1.4 样品处理
红棕榈油实际样品处理参照GB 5009.83—2016方法并稍加修改,主要包括油样预处理、皂化和萃取3个步骤。称取红棕榈油1.5 g,置于250 mL锥形瓶中,加入75 mL无水乙醇和1 g抗坏血酸,60 ℃恒温水浴30 min。加入1 g/L氢氧化钾溶液25 mL,盖上瓶塞,53 ℃恒温水浴30 min皂化。冷却至室温,将皂化液转入500 mL分液漏斗中,加入100 mL石油醚,轻轻摇动,排气,盖上瓶塞,室温振荡10 min后静置分层。将水相部分重复以上操作,合并有机相,水洗至中性,无水硫酸钠干燥脱水。将滤液转移至500 mL 蒸发瓶中,40 ℃ 旋转蒸发近干。随后氮吹至干,移液器准确加入5.0 mL二氯甲烷充分溶解提取物,过0.45 μm滤膜,备用。
2 结果与分析
2.1 色谱分离条件优化
2.1.1 检测波长的选择
分别扫描4种胡萝卜素标准溶液在200~800 nm的紫外-可见吸收光谱并比较差异,发现4种胡萝卜素在450 nm处均有较强吸收,故选择检测波长为450 nm。
2.1.2 色谱条件的优化
考虑到4种胡萝卜素异构体结构差别微小,难以分离,尤其是13-顺式-β-胡萝卜素和α-胡萝卜素的分离以及全反式-β-胡萝卜素与9-顺式-β-胡萝卜素的分离。因此先不考虑实际样品基质干扰,用4种胡萝卜素标准溶液优化色谱条件。
2.1.2.1 InertSustain C18色谱柱
采用常规C18色谱柱,参照GB 5009.83—2016色谱分离条件,采用3%三氯甲烷/12%乙腈/85%甲醇,结果如图1所示。在流速2.0 mL/min、柱温35 ℃、等度洗脱条件下,随着极性较弱的三氯甲烷含量的降低、极性较强的甲醇和乙腈含量的提高,色谱保留时间逐渐延长,分离度改善明显,但是仍然只有3个色谱峰,无法实现4种胡萝卜素的分离。考虑到胡萝卜素结构中含有多个双键,属于典型疏水性化合物,因此改用疏水性更强的C30色谱柱。
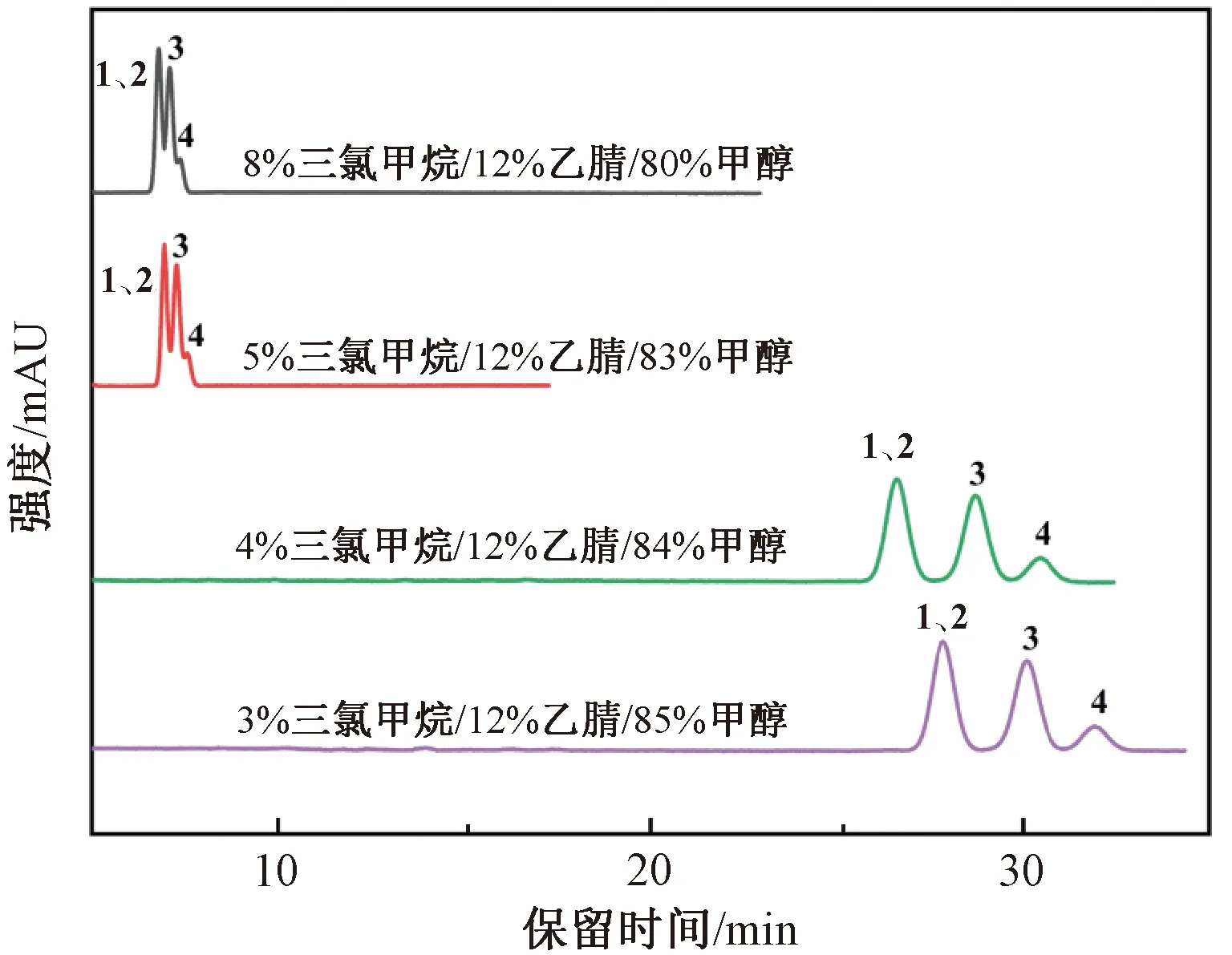
注:峰1为13-顺式-β-胡萝卜素;峰2为α-胡萝卜素;峰3为全反式β-胡萝卜素;峰4为9-顺式-β-胡萝卜素。图2—图4同。图1 InertSustain C18色谱柱对4种胡萝卜素异构体色谱分离条件的优化Fig.1 Optimization of chromatographic separation conditions of four carotene isomers by InertSustain C18 column
2.1.2.2 Welch Ultimate XB-C30色谱柱
在2.1.2.1中较优色谱条件下,改用Welch Ultimate XB-C30色谱柱,4种胡萝卜素同分异构体分离效果显著改善,实现初步分离,但是全反式-β-胡萝卜素与9-顺式-β-胡萝卜素之间的分离度有待进一步提高。首先尝试降低流速,结果如图2a所示,流速从2.0 mL/min降为1.5mL/min或1.0 mL/min,胡萝卜素的分离度明显改善,但是保留时间延长至45 ~ 67 min,柱效明显降低,故而流速仍保持2.0 mL/min。接着优化洗脱模式,尝试了一系列梯度洗脱程序(表1),结果如图2b所示,全反式-β-胡萝卜素与9-顺式-β-胡萝卜素色谱峰始终有部分重叠,无法实现完全分离。
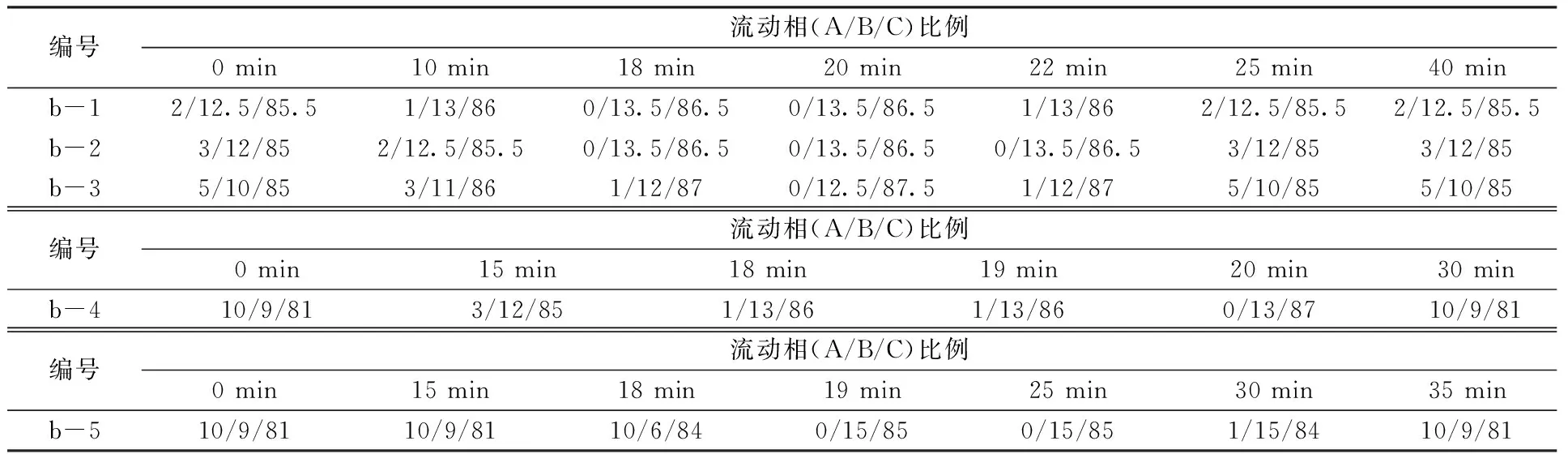
表1 梯度洗脱程序Table 1 Gradient elution procedures
考虑到乙腈的极性介于三氯甲烷和甲醇之间,可以起到微调的作用,尝试改变流动相中乙腈用量。如图2c—2d所示,在相同梯度洗脱模式下,分别固定甲醇或三氯甲烷含量不变,同时改变乙腈/三氯甲烷(表2)或乙腈/甲醇(表3)的比例,胡萝卜素保留时间发生相应改变,但是分离效果改善不明显,需要继续微调流动相的极性。
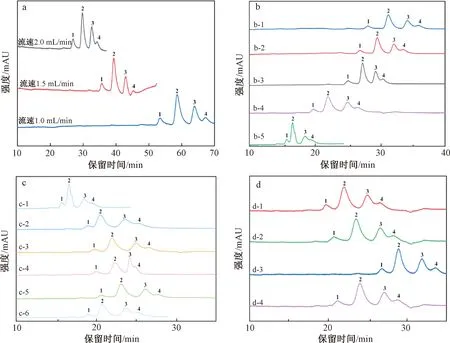
注:a为流动相3%三氯甲烷/12%乙腈/85%甲醇,柱温35 ℃;b、c、d为流速2.0 mL/min,柱温35 ℃,其他条件见表1—表3。图2 Welch Ultimate XB-C30色谱柱对4种胡萝卜素异构体色谱分离条件的优化Fig.2 Optimization of chromatographic separation conditions of four carotene isomers by Welch Ultimate XB-C30 column
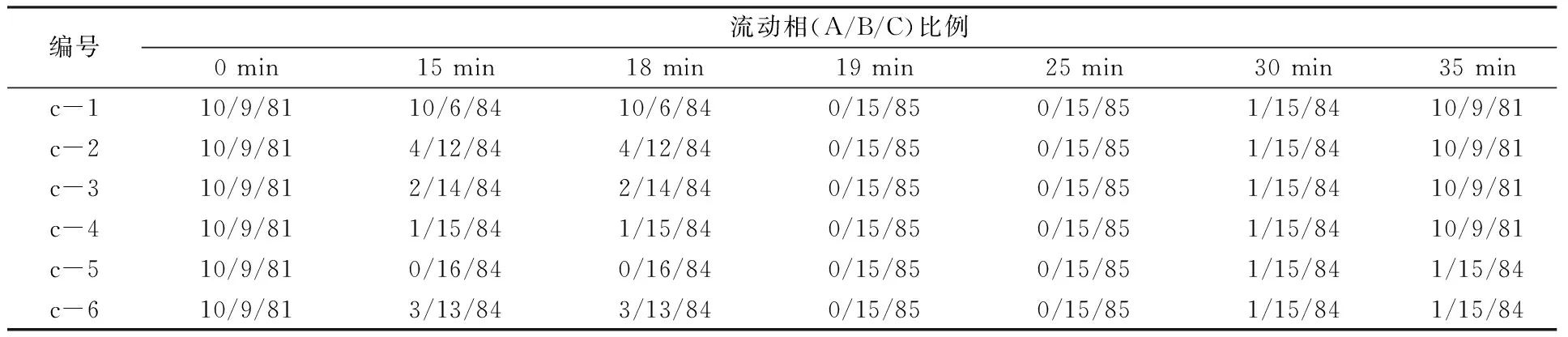
表2 改变乙腈/三氯甲烷比例时的梯度洗脱程序Table 2 Gradient elution procedure by changing acetonitrile/chloroform ratio

表3 改变乙腈/甲醇比例时的梯度洗脱程序Table 3 Gradient elution procedure by changing acetonitrile/methanol ratio
一方面,考虑到水的极性比甲醇和乙腈更大,尝试流动相中加入少量水以期改变微小极性实现目标物分离,结果表明保留时间相应延长,但分离效果未见明显改善,且当水的含量增大至5% (0.5% 三氯甲烷/20%乙腈/74.5%甲醇/5%水,等度洗脱,流速2.0 mL/min,柱温35 ℃) 时,流动相的极性明显增强,导致具有疏水性的胡萝卜素无法被洗脱。 加水无法改善色谱分离效果,故后续试验流动相中不再添加水。另一方面,考虑到二氯甲烷的极性比三氯甲烷更弱,尝试用二氯甲烷替换流动相中的三氯甲烷,结果表明其对柱效及分离效果与三氯甲烷基本相同,而三氯甲烷毒性更大,故后续试验采用二氯甲烷作为流动相。综合考虑分析时间和4种胡萝卜素异构体的分离度,较优的色谱条件及色谱图分别见表3 d-4和图2 d-4,但是,期望能在更短时间内对4种胡萝卜素异构体达到更好分离效果。
2.1.2.3 YMC C30色谱柱
在2.1.2.2中较优色谱条件下,将Welch Ultimate XB-C30色谱柱换作YMC C30色谱柱,4种胡萝卜素同分异构体能实现完全分离(图3a),且分析时间更短,说明YMC C30色谱柱对胡萝卜素异构体有更高的分离选择性。但是分析时间还需近25 min,柱效也较低,需进一步优化色谱条件,以缩短保留时间,提高柱效。对二氯甲烷起始用量进行调整,结果如图3b所示,在固定乙腈含量不变的条件下,二氯甲烷含量由20%增至30%,保留时间显著减小,4种胡萝卜素色谱峰保留时间均小于15 min,且流动相无须使用梯度程序,等度洗脱即可,但分离度随二氯甲烷含量增加而下降,尤其是13-顺式-β-胡萝卜素和α-胡萝卜素。由图3b可知,4种胡萝卜素同分异构体标准品的最佳色谱分离条件:YMC C30色谱柱,流动相20%二氯甲烷/3%乙腈/77%甲醇(等度洗脱模式,流速2.0 mL/min),柱温35 ℃。
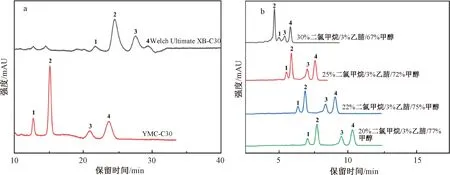
注:a的梯度洗脱程序见表3d-4,流速2.0 mL/min,柱温35 ℃;b为等度洗脱,流速2.0 mL/min,柱温35 ℃。图3 YMC C30色谱柱对4种胡萝卜素异构体色谱分离条件的优化Fig.3 Optimization of chromatographic separation conditions of four carotene isomers by YMC C30 column
2.1.3 实际样品的色谱条件优化
在2.1.2.3中最佳色谱分离条件下,对红棕榈油实际样品中的4种胡萝卜素进行色谱分离。结果如图4a所示,虽然实现了4种胡萝卜素标准品的完全分离,但由于红棕榈油实际样品基质的干扰,无法实现4种胡萝卜素的完全分离,需要进一步探索色谱分离条件。调控流动相的种类以及比例,保留时间发生了改变,但胡萝卜素与基质间的分离效果未能得到明显改善。
尝试调控柱温和流速以增大4种胡萝卜素的分离度,结果如图4b所示。在相同流动相条件下,随着柱温的升高,色谱峰的峰形及保留时间发生较大改变,说明柱温对红棕榈油实际样品的色谱分离影响显著,且柱温低有利于分离。柱温25 ℃条件(YMC C30色谱柱,流动相15%二氯甲烷/15%乙腈/70%甲醇,等度洗脱模式)下,流速从1.5 mL/min降至1.2 mL/min,实现了红棕榈油实际样品中4种胡萝卜素同分异构体的完全分离。但是此条件下,色谱峰展宽,柱效较低。通过增大疏水性较强的二氯甲烷含量,同时减小极性甲醇含量,达到了缩短保留时间、改善柱效的目的。最终优化的红棕榈油中4种胡萝卜素的色谱分离条件:YMC C30色谱柱,流动相20.5%二氯甲烷/15%乙腈/64.5%甲醇(等度洗脱,流速1.2 mL/min),柱温25 ℃。
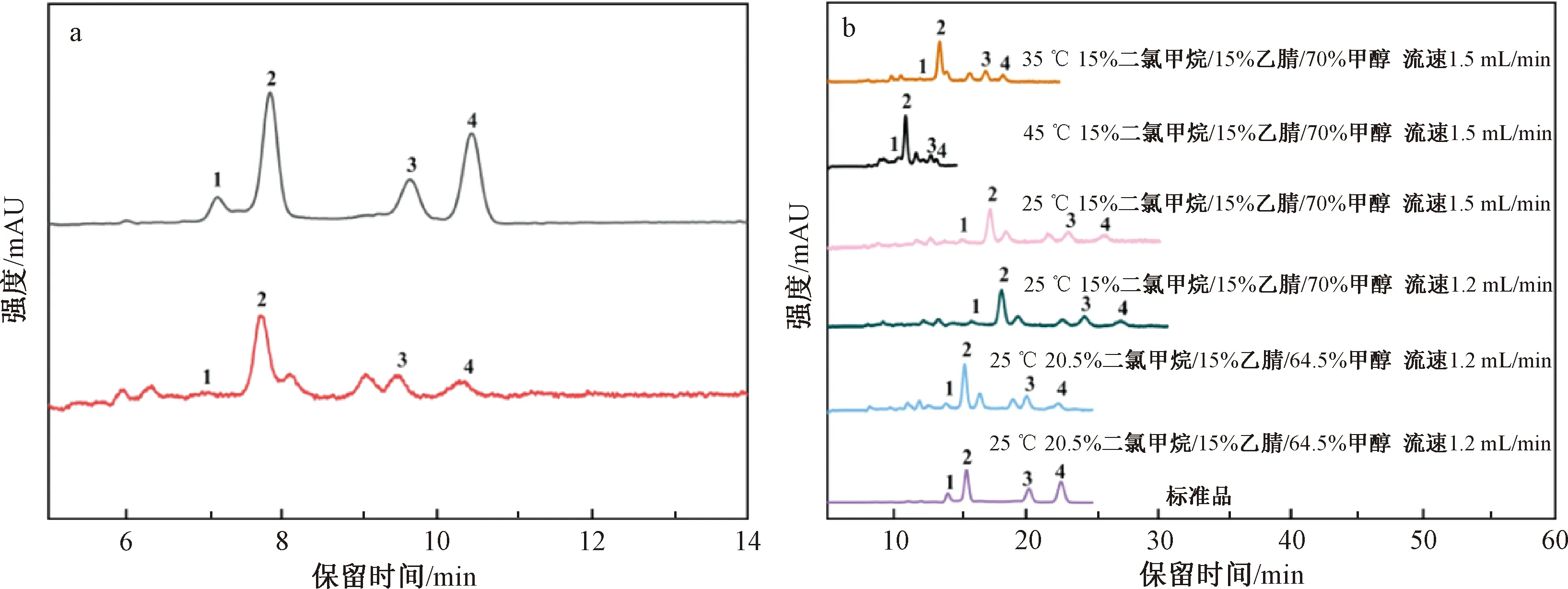
注:a为相同色谱条件(YMC C30色谱柱,流动相20%二氯甲烷/3%乙腈/77%甲醇(等度洗脱,流速2 mL/min),柱温35 ℃)下,红棕榈油实际样品溶液与标准溶液色谱分离效果对比;b为红棕榈油实际样品优化色谱条件过程。图4 红棕榈油实际样品中4种胡萝卜素异构体色谱分离条件的优化Fig.4 Optimization of chromatographic separation conditions for four carotene isomers in actual samples of red palm oil
2.2 方法性能评价
在最终优化色谱条件下,对方法的性能进行了考察,包括线性范围(LR)、决定系数(R2)和检出限(LOD,S/N=3),结果如表4所示。4种胡萝卜素异构体在0.2~3.0 μg/mL范围内具有良好线性关系,R2为0.999 6~0.999 9,LODs为0.01 μg/mL。
对红棕榈油样品中的待测胡萝卜素进行提取,采用最优色谱条件分离,得到4种胡萝卜素同分异构体的色谱图,以保留时间定性,测定实际样品浓度,重复测定3次,结果如表4所示。红棕榈油实际样品中13-顺式-β-胡萝卜素、α-胡萝卜素、全反式-β-胡萝卜素和9-顺式-β-胡萝卜素的含量分别为16.9、40.2、42.9和5.1 mg/kg,红棕榈油实际样品中胡萝卜素总含量为105.1 mg/kg,测定的相对标准偏差(RSDs)为0.9%~5.3% (n= 3),表明该分析方法能成功用于4种胡萝卜素的分离检测。
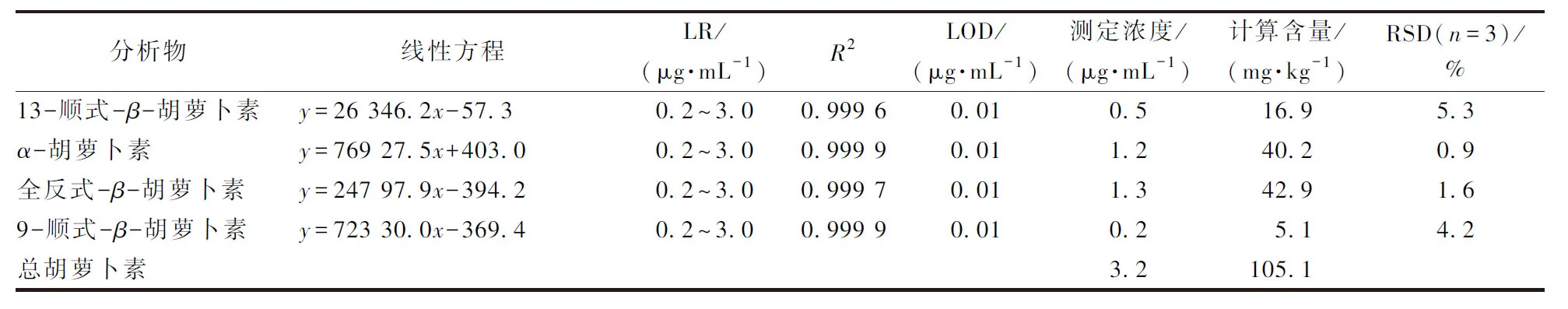
表4 方法性能评价及红棕榈油中4种胡萝卜素异构体的定量检测结果Table 4 Evaluation of the performance of the method and quantitative determination results of four carotene isomers in red palm oil
2.3 回收率和精密度试验
对红棕榈油样品中的待测胡萝卜素进行提取,最优色谱条件下进行加标回收试验。选择2个浓度水平进行加标,结果如表5所示,4种胡萝卜素的加标回收率为91.0%~116.0%,RSDs为2.3%~8.5%(n= 5),重复性良好。
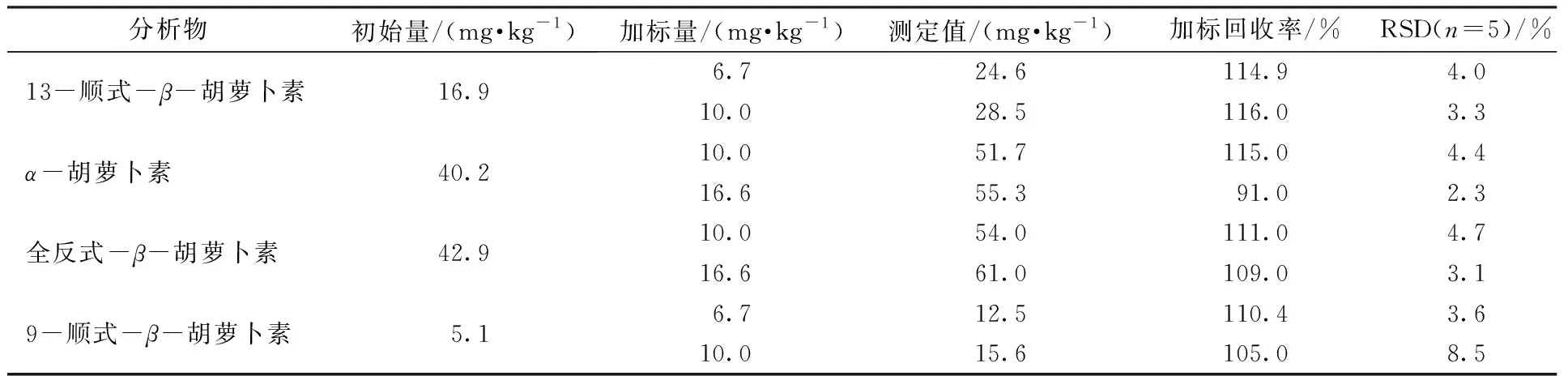
表5 红棕榈油样品中4种胡萝卜素异构体的加标回收率Table 5 Spiked recoveries of four carotene isomers in red palm oil samples
3 结论
按照GB 5009.83—2016中油样处理方法,将红棕榈油进行预处理、皂化和胡萝卜素萃取,进行了HPLC色谱条件优化,考察了色谱柱、流动相种类、流动相比例、流速、柱温等影响因素,实现红棕榈油中4种胡萝卜素异构体(α-胡萝卜素、全反式-β-胡萝卜素、13-顺式-β-胡萝卜素、9-顺式-β-胡萝卜素)的完全分离。在最优色谱条件(YMC C30色谱柱,流动相20.5%二氯甲烷/15%乙腈/64.5%甲醇(等度洗脱模式,流速1.2 mL/min),柱温25 ℃)下,考察了HPLC方法的性能,并对红棕榈油实际样品中4种胡萝卜素异构体含量进行了测定。4种胡萝卜素在0.2~3.0 μg/mL范围内有良好的线性关系(R2= 0.999 6~0.999 9),LODs为0.01 μg/mL,加标回收率为91.0%~116.0%,RSDs为2.3%~8.5%(n= 5)。结果表明,优化的HPLC方法能成功用于红棕榈油中4种胡萝卜素同分异构体的分离检测,在红棕榈油品质分析中具有较大的应用潜力。但试验过程中存在胡萝卜素结构不稳定,受热、见光、遇氧气易降解以及实际油样基质复杂等干扰,在萃取、保存等过程中需高度关注。
