老年营养风险指数对冠状动脉慢性完全闭塞病变患者经皮冠状动脉介入治疗术后远期预后的预测价值
2022-11-23尹文峰李倩任洋吴岳
尹文峰 李倩 任洋 吴岳
冠状动脉慢性完全闭塞(c h r o n i c t o t a l occlusion,CTO)病变是指冠状动脉100%闭塞、心肌梗死溶栓治疗试验(thrombolysis in myocardial inf arction,TIMI)血流分级0级且至少持续3个月以上的病变,具有再发病率高和再闭塞率高的发病特征,治疗难度大[1]。CTO病变治疗包括改善生活方式、药物治疗及冠状动脉血流重建[包括经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)及冠状动脉旁路移植术(coronary artery bypass graft,CABG)]。关于CTO病变患者行PCI目前尚存争议,多项研究表明,与药物治疗相比,PCI开通CTO病变并未降低患者的死亡率[2-4],但是大型观察性研究表明PCI优于药物治疗[5-6]。因此,需要进一步深入研究PCI开通CTO病变对特定人群的临床获益及老年CTO-PCI患者的预后因素。
研究表明,营养不良与炎症密切相关,可能通过促进炎症细胞因子的产生而影响动脉粥样硬化、冠心病、心力衰竭[7]。目前,研究对老年CTO-PCI患者营养不良与心血管死亡之间的关系知之甚少[8-9]。老年营养风险指数(geriatric nutritional risk index,GNRI)是一个简单、准确的营养不良评分,可以预测老年患者的发病率和死亡率[10]。因此,本研究旨在分析GNRI是否是老年CTO-PCI患者远期不良心血管事件的可靠预测指标。
1 对象与方法
1. 1 研究对象
纳入2013年6月至2017年10月于西安交通大学第一附属医院心内科住院治疗的冠心病患者。CTO病变定义为:冠状动脉完全闭塞、TIMI血流分级0级且至少持续3个月以上[1]。纳入标准:符合CTO病变诊断标准,且于西安交通大学第一附属医院行PCI的老年患者,随访数据完整。排除标准:严重心脏瓣膜病、肥厚型心肌病、扩张型心肌病的结构性心脏病,合并甲状腺功能异常,肝肾功能衰竭,既往存在心脏外科手术史。所有研究参与者均签署知情同意书。本研究经医院伦理委员会批准。
1. 2 临床数据
收集临床相关数据,包括年龄、性别、身高、体重、吸烟及饮酒史,根据体重和身高计算身体质量指数(kg/m2)。糖尿病(diabetes mellitus,DM)诊断标准:入院时患者明确自身患有DM,或空腹血糖≥7.0 mmol/L,或进行降糖治疗,或糖化血红蛋白≥6.5%。高血压病被定义为非同日测量血压三次,静息血压≥140/90 mmHg(1 mmHg=0.133 kPa),或有高血压病史或接受高血压药物治疗。在入院24 h内对患者进行外周血采样及超声心动图检查,检测血常规、N末端B型脑钠肽前体、三酰甘油、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、血肌酐、超敏C反应蛋白、左心室射血分数(left ventricular ejection fractions,LVEF)。GNRI评分的计算公式:GNRI=[1.489×血清白蛋白(g/L)+41.7×体重(kg)/理想体重(kg)]。理想体重=22×身高2。当患者体重超过理想体重时,体重与理想体重之比设为1[11]。分组:营养不良中/重度风险组(GNRI<92,46例);营养不良低风险组(92≤GNRI<98,114例);无营养不良风险组(GNRI≥98,186例)。
1. 3 研究终点
PCI术后血管再通定义为闭塞血管和侧支再通,TIMI血流分级Ⅲ级;次优再通定义为满足以下任何标准:显著侧支闭塞,最终TIMI血流分级Ⅰ级或Ⅱ级,或残余直径狭窄率>30%[6]。主要终点为全因死亡率,次要终点为心血管死亡。
1. 4 统计学分析
所有数据采用SPSS 19.0进行处理。计量资料如果服从正态分布则用均数±标准差表示,采用t检验或方差分析(ANOVA);如果非正态性分布则用中位数及四分位数间距表示,采用Kruskal-Wallis检验。计数资料以[例(%)]表示,采用卡方检验。Kaplan-Meier曲线通过计算从本研究开始之日起到心血管事件的发生获得,并进行Log-rank检验。在不同的GNRI水平下,发病率按100例患者年计算。采用Cox单因素分析及多因素分析方法分析全因死亡及心血管死亡的相关危险因素以识别心血管事件的预测因子。以P<0.05为差异有统计学意义。
2 结果
2. 1 3组患者的临床资料比较
纳入老年CTO-PCI患者406例,失访、数据缺失60例,最终共纳入346例患者,平均年龄为72岁,男性占总人群的78.0%。依据GNRI评分将患者分为3组:营养不良中/重度风险组(46例)、营养不良低风险组(114例)和无营养不良风险组(186例)。3组间GNRI、年龄、身体质量指数、N末端B型脑钠肽前体、超敏C反应蛋白、血红蛋白浓度、尿酸、白蛋白、三酰甘油、总胆固醇、低密度脂蛋白胆固醇及随访期间全因死亡率和心血管死亡率比较,差异均有统计学意义(均P<0.05),其余变量的差异均无统计学意义(均P>0.05,表1)。
2. 2 单因素、多因素Cox回归分析及生存曲线
326例患者中位随访33个月,全因死亡44例,其中心血管死亡共19例。无营养不良风险组15例(5例系心血管死亡),营养不良低风险组16例(7例系心血管死亡),营养不良中/重度风险组13例(7例系心血管死亡)。
单因素C o x 回归分析显示全因死亡与GNRI<92、年龄、血红蛋白浓度、淋巴细胞计数、血肌酐、估算的肾小球滤过率、LVEF相关,心血管死亡与GNRI<92、年龄、淋巴细胞计数、血肌酐、估算的肾小球滤过率、LVEF相关。多因素Cox回归分析提示全因死亡与GNRI<92、淋巴细胞计数及LVEF相关,心血管死亡只与GNRI<92相关。与无营养不良风险的患者相比,营养不良中/重度风险的患者全因死亡及心血管死亡风险显著增加(HR2.580,95%CI1.139~5.842,P=0.023;HR4.709,95%CI1.321~16.787,P=0.017,表2)。

表2 CTO-PCI 患者全因死亡及心血管死亡的单因素、多因素Cox 回归分析
Kaplan-Meier生存分析显示,营养不良中/重度风险患者在全因死亡及心血管死亡方面的预后均比其他两组差(Log-rank检验,全因死亡:P=0.004,心血管死亡:P=0.003,图1~2)。
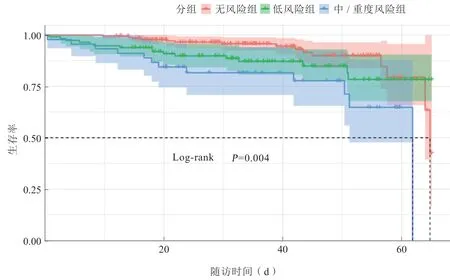
图1 3 组患者全因死亡临床结局的Kaplan Meier 曲线
3 讨论
既往研究表明,营养不良与慢性疾病患者的死亡率密切相关,包括心力衰竭、老年ST段抬高型心肌梗死、冠状动脉疾病等[12-17]。然而,营养不良对CTO病变患者远期预后的影响尚未明确。本研究证明了GNRI在预测CTO病变患者PCI术后不良心血管事件中的应用价值。
评估营养状态的客观证据包括GNRI评分、预后营养指数(prognostic nutritional index,PNI)评分、控制营养状态(controlling nutritional status,CONUT)评分等。研究表明,血浆白蛋白及淋巴细胞计数可用于评估机体的免疫炎症状态、参与冠心病等多种慢性病的病理生理过程,因此,以血浆白蛋白水平及淋巴细胞计数来计算的PNI评分对于行胃肠外科手术的患者、肿瘤患者、心肌梗死行PCI患者的预后具有一定的临床价值[18]。CONUT评分在PNI评分的基础上纳入了与代谢相关的血清总胆固醇指标,因此,CONUT评分更为全面地评估营养状态,在一定程度上优于PNI评分,多项回顾性研究亦证实这一点[19]。GNRI通过身高、体重和血清白蛋白三个常规测量的客观参数来全面评估营养状况[10]。血清白蛋白水平和身体质量指数常被用作营养状况的指标。一些研究表明,这些指标与冠心病及心力衰竭患者的不良临床结局密切相关[20-22]。与白蛋白或身体质量指数相比,GNRI是一个更可靠的指标,但相比CONUT评分,GNRI在评估慢性心力衰竭患者预后方面更弱,可能是因为心力衰竭患者体液潴留、体重增加,导致计算纳入体重的GNRI评分不能准确识别营养不良人群。CONUT评分与冠心病患者、急慢性心力衰竭患者预后相关的研究已有报道,证实了CONUT评分对心血管疾病远期不良预后的预测价值,亦有相关研究表明GNRI对于接受PCI的ST段抬高型心肌梗死患者风险分层是有效的[19],但是GNRI对于接受PCI的CTO病变患者预后的预测价值缺乏研究。本研究依据GNRI评分将研究人群分为3组,探讨GNRI评分对CTO-PCI患者远期全因死亡、心血管死亡的预测价值。结果显示,营养不良程度与心功能不全、身体质量指数、血脂及蛋白代谢相关。此外,GNRI评分偏低的患者往往年龄较大,可能是因为老年患者大多数身患各种慢性消耗性疾病且存在不同程度的营养不良,尽管冠心病患者的二级预防包括饮食营养推荐,但是在治疗过程中医师们可能更多地关注原发疾病而忽视患者的营养支持。在目前的研究中,营养不良在接受PCI的老年CTO病变患者中很常见,其患病率高达40%,各种合并症均可影响患者的营养状况[23]。本研究结果提示,在临床工作中医师应提高对老年CTO-PCI患者营养不良发生率高且预后差的认识,改善营养状况可改善老年CTO病变患者PCI术后的不
良预后,动脉粥样硬化患者的营养状况应引起医师的重视。
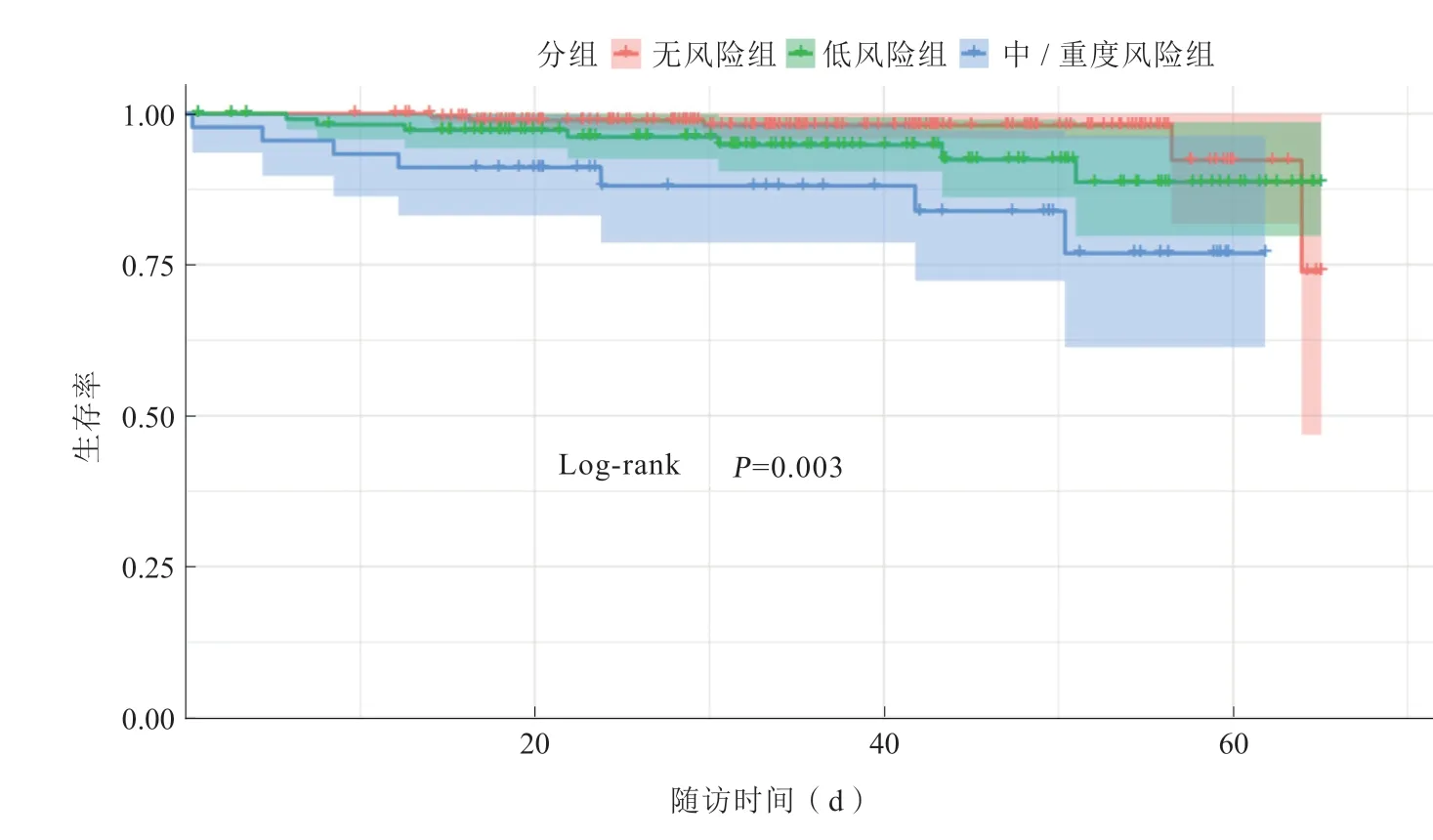
图2 3 组患者心血管死亡临床结局的Kaplan Meier 曲线
本研究结果显示,营养不良中/重度风险的老年CTO-PCI患者远期全因死亡及心血管死亡风险均比无营养不良风险CTO-PCI患者高,LVEF低、心功能不全的CTO-PCI患者,远期预后较差。本研究发现营养不良与老年CTO-PCI患者远期预后相关,但未能解释营养不良影响老年CTO-PCI患者预后的具体机制。多项研究表明,炎症往往会打破代谢平衡状态,促进分解代谢,从而导致营养不良[4,24-25]。超敏C反应蛋白常常作为炎症指标用于预测不良心脏事件的风险[7],本研究结果提示不同营养不良程度的超敏C反应蛋白水平存在统计学差异。此外,肿瘤坏死因子-α是最早证实与营养不良有关的细胞因子,通过抑制脂肪细胞对脂肪酸的摄入,抑制脂肪合成途径的关键酶如乙酰辅酶A羧化酶、脂肪酸合成酶的表达,促进脂肪分解,抑制脂肪细胞分化,并诱导脂肪细胞及前脂肪细胞凋亡,参与了多种慢性消耗性疾病营养不良、恶病质的发生[26-28]。因此,炎症可能是营养不良导致心血管不良预后的重要因素之一。
单因素Cox回归分析显示淋巴细胞计数与CTOPCI患者的全因死亡及心血管死亡相关,多因素Cox回归分析提示淋巴细胞计数与CTO-PCI患者的全因死亡相关。该结果可能是因为营养不良引起蛋白质储备减少和能量消耗增加等,进而削弱机体的免疫功能,而淋巴细胞是免疫功能的核心,且免疫力下降是许多慢性病发生发展的关键因素。炎症、营养不良、免疫状态与不良事件之间可能存在一定的正反馈,最终形成恶性循环。本研究表明,中/重度营养不良与老年CTOPCI患者心血管事件的发生率较高相关。GNRI为患者营养状态的评估提供了一个实用的工具,这可能有益于临床工作中对老年CTO-PCI患者的预后进行风险分层,予以及时合理的营养支持。
本研究为单中心、小样本的观察性研究,未知的混杂因素对结果可能存在一定干扰,其次在本研究中,GNRI只被评估一次,随访期间未能对患者的营养状态进行二次评估。上述局限性限制了研究结果的解释,因此,需要多中心、大规模的临床研究来证明本研究结果的准确性。入院时评估营养不良的GNRI评分是老年CTO-PCI患者预后的独立预测指标。利益冲突所有作者均声明不存在利益冲突
