基于网络药理学研究桑白皮治疗类风湿性关节炎的作用机制
2022-11-23杨佩璇陈一村
杨佩璇,陈一村
(汕头大学医学院第一附属医院,广东 汕头 515041)
类风湿关节炎(Rheumatoid arthritis,RA)是一种发病机制不明的多关节慢性炎症性疾病.中医药治疗RA在于改善症状体征及关节功能障碍,进而提高生活质量[1].目前中药在治疗RA上也有一定的疗效.桑白皮为桑科桑属植物的干燥根皮桑(拉丁学名:Morus alba L.),其药理作用有镇痛、消炎、镇咳、平喘、降血糖、降脂、抗糖尿病周围神经病变作用等[2].桑白皮总黄酮对小鼠醋酸所致的外周疼痛和急性炎症期有明显的抑制作用[3].韦宁等[4]收集古医籍及现代医家临床经验发现桑白皮配伍桑叶、桑枝、黄芩、麻黄、连翘、赤小豆等可治疗类风湿关节炎[4].网络药理学在中药活性成分、作用靶点及其机制研究中的应用方面有着独特的优势.本研究将采用网络药理学方法来预测桑白皮治疗RA的靶点及可能的作用机制,为临床治疗提供理论依据.
1 资料与方法
1.1 数据库与软件

表1 实验所用的数据库与软件
1.2 桑白皮活性成分及靶点筛选
在中药系统药理学数据库(TCMSP)中,以“sangbaipi”为关键词,查找桑白皮的所有化学成分.桑白皮的主要活性成分以口服生物利用度(0B)≥30%、类药性(DL)≥0.18作为筛选条件收集出来,并在此数据库中检索出其主要活性成分对应的靶点蛋白,将靶点蛋白对应的基因简称用STRING或Unitprot数据库查找获得.
1.3 RA靶点的获取
以“Rheumatoid Arthritis”为关键词分别在人类基因数据库GeneCards和DisGeNET数据库中检索,根据一定的条件筛选出类风湿性关节炎疾病的基因,整合并删除重复值.
1.4 桑白皮治疗RA的活性成分网络分析
桑白皮与RA的共同靶点通过在线韦恩图绘制平台进行计算,并将药物与疾病的共同靶点绘制成图.用Cytoscape软件构建出交集靶点与疾病、药物的网络关系,并通过分析相关的网络参数来推测桑白皮发挥治疗RA作用的可能成分.
1.5 蛋白相互作用网络(PPI)的构建
将上述“1.4”项下两者交集的靶点上传到STRING数据库,选择“多种蛋白质”和物种“人”,其余不变.导出得到的蛋白相互作用图的相关数据,并利用Cytoscape3.8.2进行蛋白相互作用网络的可视化.
1.6 生物功能与通路富集分析
将得到的交集靶点导入DAVID6.8数据库,对本研究获取的桑白皮治疗RA的关键靶蛋白进行GO(Gene Ontology,基因本体论)功能和KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因与基因组百科全书)通路富集分析.以P<0.01作为筛选条件,得到的分析结果用微生信在线绘图平台进行可视化.
1.7 潜在作用靶点与关键通路网络构建
从“1.6”项获得参与RA的20条KEGG通路后,与中药、成分、共同靶点一一对应,并将其共同输入到Cytoscape3.8.2软件中,构建“药物-活性成分-潜在靶点-关键通路”网络关系.
2 结果
2.1 桑白皮活性成分的筛选
在中药系统药理学数据库(TCMSP)搜集桑白皮所有化学成分194个,根据“1.2”项下的筛选条件得到桑白皮的潜在活性成分有31个,见表2.

表2 桑白皮主要化学成分信息
2.2 桑白皮成分抗类风湿性关节炎的潜在作用靶点预测
在TCMSP中将桑白皮31个活性成分对应的靶点查找出来,并在Uniprot、STRING数据库将其基因标准化,剔除重复和无效靶点后,得到有效靶点基因190个.在GeneCards、DisGeNET中检索RA的作用靶点,整合后并剔除重复值,得到RA疾病的作用靶点647个.利用在线韦恩绘制平台绘制韦恩图并得到桑白皮治疗RA的交集靶点有 38个,如图 1,分别为 NOS2,PTGS1,AR,PPARG,PTGS2,PIK3C,ESR1,SCN5A,NFKBIA,HSPA5,MYC,GJA1,IL1B,CXCL8,IL2,COL1A1,PTEN,MPO, COL3A1, MAPK14, NR3C1, IKBKB, TNF, MMP1, ICAM1, VCAM1,MMP3, FOS, MMP9, MAPK1, IL6, TP53, CXCL2, CRP, CXCL10, SPP1,RUNX2,CD40LG.这些靶点可能是桑白皮发挥治疗RA的主要基因靶点.
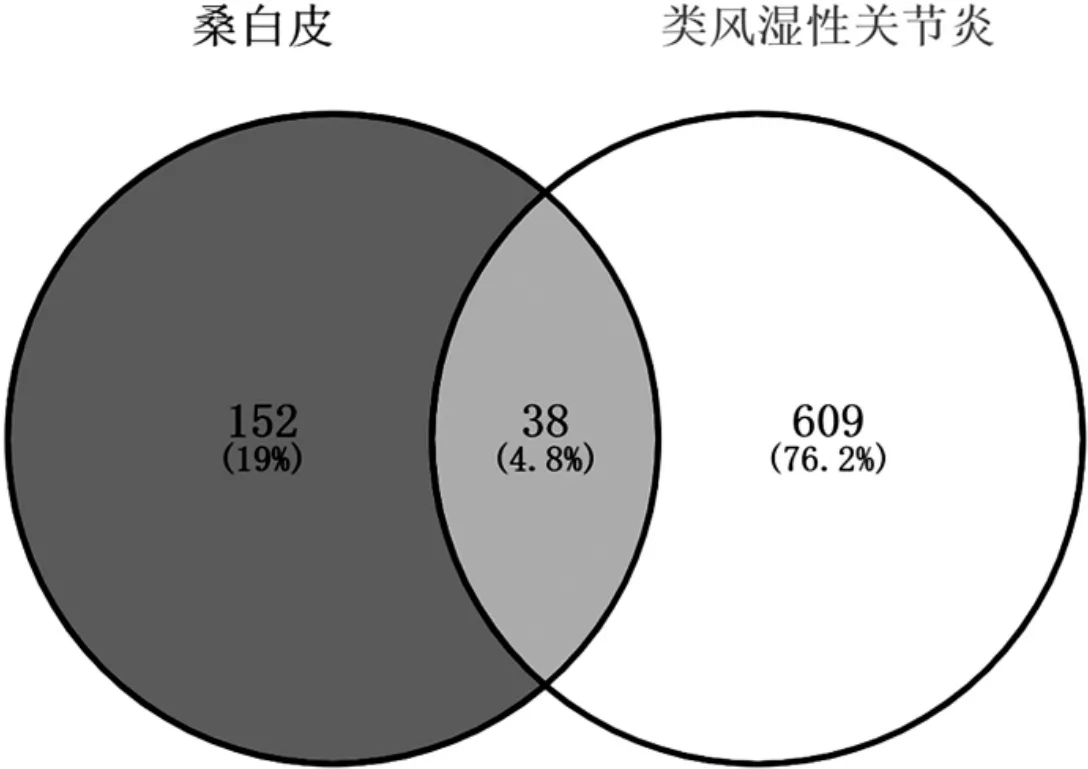
图1 桑白皮有效成分靶点-疾病靶点韦恩图
2.3 活性成分关键靶点的网络构建与分析
桑白皮与RA作用靶点相关的药物活性成分有21个,将活性成分、中药与疾病共同的关键靶点用Cytoscape 3.8.2软件进行网络构建,如图2.图中,菱形代表桑白皮的有效成分,圆形代表作用靶点.网络显示,药物活性成分连接值在前5的为quercetin(槲皮素)、kaempferol(山奈酚)、Glabrone(光甘草酮)、Moracin D(桑辛素D)、Iristectorigenin(9CI)(鸢尾黄酮甲素(9CI)).上述成分可能是桑白皮治疗RA的重要活性成分,在治疗RA中具有重要意义.
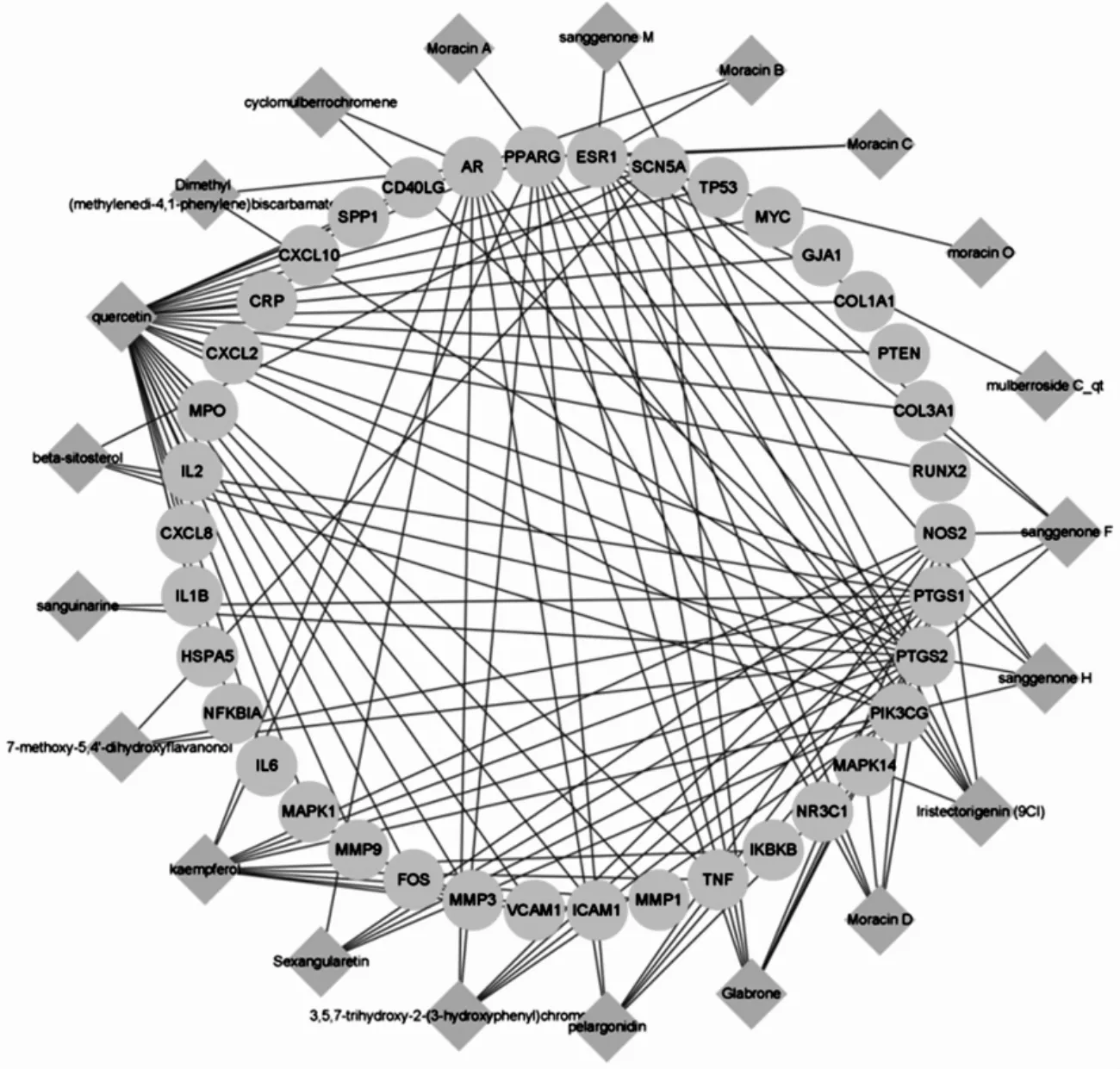
图2 桑白皮“活性成分-靶点”网络关系图
2.4 共有蛋白的PPI网络构建
将桑白皮与RA交叉的38个靶基因上传至STRING平台,物种设定为“Human”根据高级筛选条件“high confidence(0.4)”进行PPI网络构建,即最低要求交互分数为0.4,检索得到PPI网络的相关数据,并将数据导入Cytoscape 3.8.2软件绘制出桑白皮-RA关联的蛋白交互的网络图,如图3.由图3可得,此网络共包括节点38个,边411个.图中节点的大小和颜色与靶点间连线有关,连线越多,节点越大,度值越大;节点的颜色从黄色到深蓝色,相应的度值也逐渐变大.结果提示,桑白皮对抗RA的靶标中Degree值最高的靶点TNF、IL6、IL1B、PTGS2、TP53、MMP9、CXCL8、NFKBIA、PPARG、VCAM1,度值分别为36、35、34、33、33、32、30、28、27、26.这可能是桑白皮治疗RA的关键靶点.
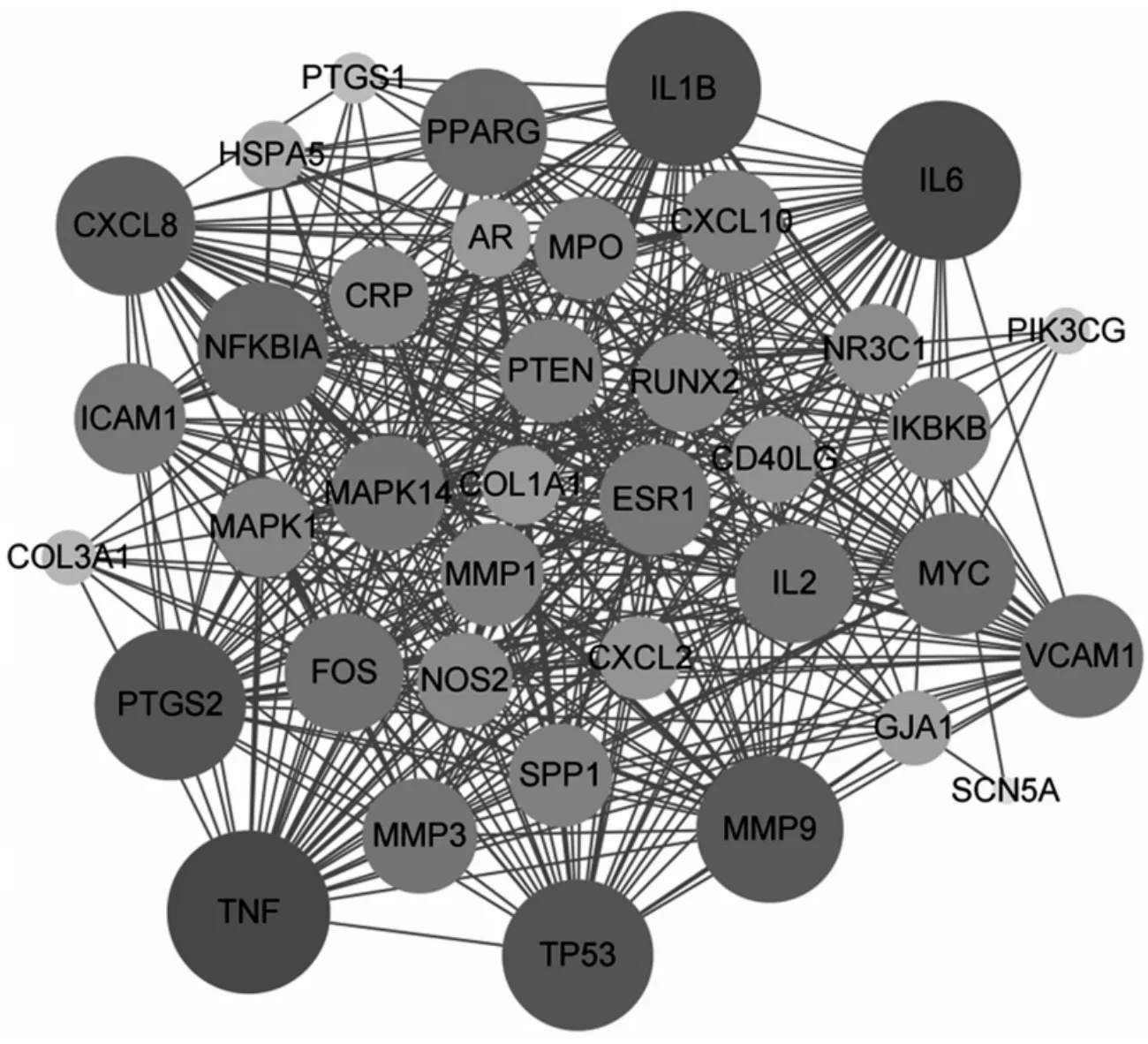
图3 “药物-疾病”交集基因的PPI网络图
2.5 GO功能分析与KEGG通路富集分析结果
在GO功能分析结果中,在P<0.01基础上选取生物过程(Biological Processes,BP)、分子功能(Molecular Functions,MF)、细胞组分(Cellular Components,CC)富集基因数目前10的生物学过程,利用微生信平台进行数据可视化处理得到柱状图,如图4,显示桑白皮对RA的治疗作用主要与细胞因子介导的信号通路、炎症反应、细胞外区、细胞质、细胞外液、蛋白质结合、相同的蛋白质结合、酶结合等相关.
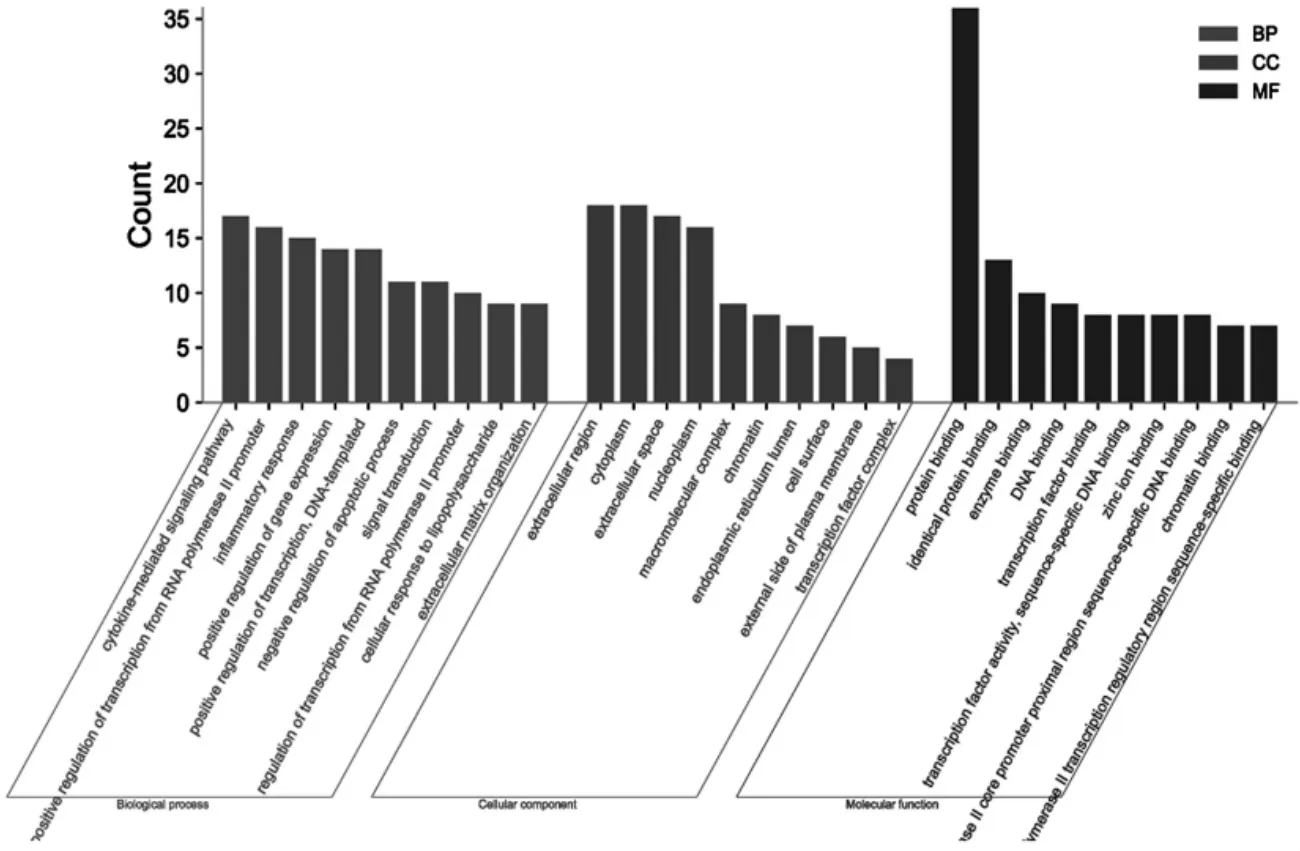
图4 桑白皮治疗RA的GO生物过程
对38个靶点进行KEGG通路富集分析,筛选P<0.01,选择富集前20的通路为候选通路,主要涉及到脂质和动脉粥样硬化、肿瘤坏死因子信号通路、癌症通路、IL-17信号通路等信号通路.将上述信号通路利用微生信平台进行数据处理后得到气泡图,如图5.
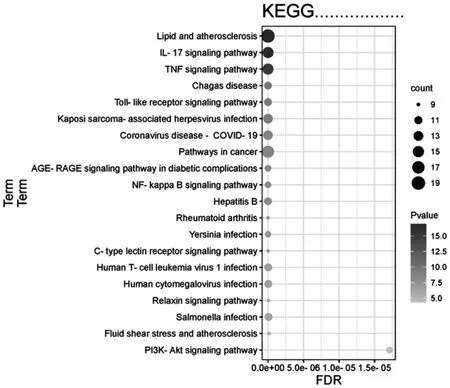
图5 桑白皮治疗RA的KEGG通路
2.6 药物-活性成分-潜在靶点-关键通路网络构建结果
将关键信号通路与桑白皮治疗RA的潜在作用靶点及药物的活性成分进行一一映射,利用Cytoscape 3.8.2软件构建药物-活性成分-潜在靶点-关键通路关系网络,如图6,蓝色圆形代表靶点基因,橙色菱形代表通路,黄色正方形代表药物活性成分,紫色V字形代表药物桑白皮.从网络连接值的分析结果可知,桑白皮治疗RA的机制可能是药物中的 quercetin、kaempferol、Glabrone、Moracin D、Iristectorigenin(9CI)等有效成分通过MAPK14、TNF、IKBKB、IL6、MAPK1、NFKBIA、PTGS2、FOS、CXCL8、IL1B等关键靶点,作用于脂质和动脉粥样硬化、肿瘤坏死因子信号通路、癌症通路、IL-17信号通路等通路,从而发挥治疗作用.

图6 药物-活性成分-潜在靶点-关键通路关系网络图
3 讨论
现代药理学研究表明桑白皮的抗炎作用显著,而RA的发病机制可能与免疫细胞、炎症介质、基质金属蛋白酶(MMP)、氧化应激异常、遗传和生存环境因素等有关[5].网络药理学的问世为中药作用于疾病的机制研究提供了一种新的方法和思路,它能够从整体联系到微观,从多个层面系统地分析分子作用机制[6].
通过分析桑白皮有效成分显示,桑白皮主要通过21个活性成分对RA进行干预治疗,从网络构建结果中可以得出度值排名靠前的有槲皮素、山奈酚、鸢尾黄酮甲素(9CI)、桑辛素D、光甘草酮等.这些成分也是桑白皮治疗RA的关键成分.叶香兰等研究认为槲皮素具有多种生物学活性,如抑制炎症介质的表达和分泌、抗氧化、免疫调节、抑制滑膜细胞的增殖等,可以抑制RA的病理过程[7].另有研究发现槲皮素可通过抑制核因子(nuclear factor kappa-B,NF-κB)活化,减少炎症条件下软骨细胞中MMP-13的产生、基质降解和凋亡来保护软骨[8].对于山奈酚,有研究者[9]通过体外和CIA小鼠的体内实验研究,发现山奈酚降低了RA成纤维细胞样滑膜细胞(fibroblast-like synoviocytes,FLSs)的迁移、侵袭和MMP表达,还明显的抑制了肿瘤坏死因子(TNF-α)诱导的丝裂原活化蛋白激酶(MAPK)激活,并且减轻了CIA小鼠关节炎的严重程度.Lin等[10]研究揭示了山奈酚可预防和治疗RA、红斑性狼疮和强直性嵴柱炎等炎症性疾病.邹桂欣等研究发现鸢尾黄酮甲素对LPS诱导小鼠巨噬细胞RAW264.7建立的细胞炎症反应中NO的生成量均有显著抑制作用,进而表明其抗炎作用的相关关系[11].康艳宾等研究证实桑辛素对细胞的增殖、凋亡基因表达量有抑制作用[12].这说明桑白皮可能通过这些关键成分来发挥治疗RA的作用.
从药物-活性成分-潜在靶点-关键通路网络结果得到,桑白皮的活性成分可能作用于MAPK14、TNF、IKBKB、IL6、MAPK1、NFKBIA、PTGS2、IL1B等网络连接较多的靶点,而这些靶点可能是治疗RA的关键靶点.如在免疫介导的RA的三个病理过程:炎症、增殖和骨破坏中,MAPK起着重要的调节作用[13].有研究者通过实验发现MAPK14抑制剂可帮助治疗RA和其他慢性炎症性疾病,同时具有靶向抑制MAPK14的化合物也应用到治疗RA当中[14].尚华等[15]通过生物信息学分析RA作用机制可能包括调节多种细胞因子(如IL-6、TNF-α、IL-17等)分泌和免疫细胞(如Th17细胞、Th1细胞、Th2细胞、破骨细胞等)分化,调控自噬通路.而肿瘤坏死因子(TNF-α)是一种在RA发病机制中起重要调控作用的细胞因子.可见在桑白皮治疗RA机制中,这些靶点可能起到关键作用.
在KEGG分析中显示,桑白皮治疗RA的作用机制主要通过脂质和动脉粥样硬化、肿瘤坏死因子信号通路、IL-17信号通路、癌症通路、卡波西肉瘤相关疱疹病毒感染等信号通路.如王志会等通过研究分析脂质代谢紊乱及内皮功能异常在RA患者早发动脉粥样硬化中认为炎症与脂代谢紊乱互为因果,氧化修饰型低密度脂蛋白可刺激血管内皮细胞表达单核细胞趋化蛋白-1(MCP-1)、白细胞介素1(IL-1)、TNF-α等致炎因子[16].TNF-α与TNF受体结合,能够引起细胞内的信号传导,调控目的基因的表达,造成炎症反应和骨关节损伤[17].IL-17的致炎性很强,在RA的发病过程中有着重要作用,IL-17信号通路可激活多条通路如NF-κB、JNK等,吕芳[18]通过观察Actl基因表达下降后IL-17诱导的IL-6和IL-8表达的变化,验证了其参与了RA的发病.以上这些通路大多被证实对治疗RA具有一定的调控作用.
综上所述,本研究采用网络药理学方法对桑白皮治疗RA的作用机制进行了预测,其发挥作用途径涉及到多个成分、靶点及信号通路,但关键途径的调控仍要深入研究,后续将通过体外细胞实验和体内动物实验等验证.
