羟基化多壁碳纳米管电化学传感器制备以及应用研究
2022-11-23李军涛李向前陈素霞
李军涛,王 艳,李向前,陈素霞
(石家庄市第八医院,河北 石家庄 050000)
抑郁症是现代较为常见的心理障碍疾病,患者长时间处于情绪低落、运动抑制的状态,对身体健康造成极大的影响,严重者甚至危及生命。抗抑郁药是帮助缓解抑制症的有效方法,目前常见的抗抑郁药有氟伏沙明、舍曲林、氟西汀、帕罗西汀。这些药物能够有效缓解抑郁症患者的症状,但是对我们体内代谢酶CYP2D6有一定的抑制作用。研究抗抑郁药的抑制性能对指导临床用药有至关重要的作用,广大学者进行了很多研究。有学者提出用高效液相色谱法分析药物成分的抑制作用,但色谱法存在操作复杂、检测时间长,仪器设备昂贵的问题[1];用荧光光谱法对药物成分进行抑制分析,改善了色谱法检测时间长、操作复杂的问题,但设备昂贵的问题还是没有得到很好的解决[2]。而电化学酶传感器具有操作简单、仪器简单,选择性好等优点,在2020年对近 5 年生物传感器在酶抑制剂类药物检测中的应用进展进行综述,证实电化学传感器能够有效检测酶抑制活性[3];但是电化学传感器的具体应用还存在问题。本文在文献[3]的研究基础上,针对传统酶体外检测光谱法、色谱法设备昂贵的问题,用硝酸和硫酸混合溶液对多壁碳纳米管进行羧基化,然后以此为基体制备Nafion/CYP2D6/c-MWCNTs/GCE 传感器,并探讨不同抗抑郁药物对CYP2D6 的抑制作用,从而为临床抗抑郁药的指导用药提供数据参考。
1 材料与方法
1.1 材料与设备
本试验主要材料:硝酸(佛山市华希盛化工有限公司)、硫酸(山东辰达化工有限公司)、氢溴酸右美沙芬(北京汇智泰康医药技术有限公司)、舍曲林(辉瑞制药有限公司)、帕罗西汀(浙江华海药业股份有限公司)、氟西汀(武汉多普乐生物医药有限公司)、氟伏沙明(武汉欣欣佳丽生物科技有限公司):均为AR;多壁碳纳米管(湖北科沃德化工有限公司,>95%);CYP2D6(上海恒远生物科技有限公司,PMO)。
本试验主要设备:ADS-1720Q超声波清洗机 (佛山市安迪信超声清洗设备有限公司);DZF-6090真空干燥箱(上海仪天科学仪器有限公司);LIDA-20傅里叶变换红外光谱仪(天津恒创立达科技发展有限公司);SS-150冷场扫描电子显微镜(深圳市善时仪器有限公司)。
1.2 试验方法
1.2.1c-MWCNTs的制备
(1)将H2SO4与HNO3按照体积比3∶1混合,取10 mL混合溶液,将10 mg多壁碳纳米管分散于混合溶液中;
(2)将混合溶液置于ADS-1720Q型超声波清洗机中进行超声分散,超声时间为30 min。取出混合溶液后,在室温条件下充分搅拌,搅拌时间为4 h;
(3)对混合溶液进行抽滤,并用去离子水冲洗抽滤产物4次。然后将产物置于DZF-6090型真空干燥箱内充分干燥,干燥温度和时间分别为60 ℃和12 h,得到羧基化多壁碳纳米管;
(4)在4 mL去离子水中融入4 mg羧基化多壁碳纳米管;然后置于ADS-1720Q型超声波清洗机中超声分散,超声时间为30 min。
1.2.2Nafion/CYP2D6/c-MWCNTs/GCE 传感器的组装
(1)依次在1.0、0.3和0.05 μm的α-氧化铝粉中对玻碳电极进行打磨;然后依次在体积比为1∶1的硝酸溶液、乙醇额溶液和去离子水中进行超声清洗,清洗时间为3 min。捞出后置于室温通风环境中干燥;
(2)将玻碳电极置于浓度为1 mol/L的H2SO4溶液中,然后采用CV法对玻碳电极进行活化[4];CV法参数如表1所示 ;

表1 CV法参数Tab.1 CV method parameters
(3)活化后在玻碳电极上滴涂5 μL羧基化多壁碳纳米管溶液,然后置于室温通风环境中干燥。将干燥后电极置于100 mmol/L的EDC/NHS 溶液中浸泡1 h,之后在电极上滴涂5 μL的CYP2D6 酶溶液,继续干燥,干燥温度和时间分别为4 ℃和12 h;
(4)用pH值为7.4的浓度为0.1 mol/L的PBS冲洗掉玻碳电极中未固化的酶;然后在电极上滴加5 μL质量分数为0.5%的Nafion 溶液,继续置于温度为4 ℃环境下干燥保存[5]。
1.2.3Nafion/CYP2D6/c-MWCNTs/GCE 传感器的电化学测量条件
本试验采用三电极体系,其中参比电极为Ag/AgCl电极,辅助电极为铂丝电极。传感器直接电化学行为由CV法测得,循环伏安扫描电位和扫描速度分别为-0.8~0.1 V、50 mV/s[6]。对抗抑郁药的测定则是采用DPV法,以含有20 μmol/L、pH值为7.4的右美沙芬作为测试底液,测试温度为20 ℃。
抗抑郁药抑制率(Inhibition)表达式[7]:
拟制率=(ip0-ipt)/ip0×100%
(1)
式中:ip0为抗抑郁药抑制前的电流信号;ipt为抗抑郁药抑制后的电流信号。
1.3 性能表征
1.3.1红外光谱分析
用LIDA-20型傅里叶变换红外光谱仪对c-MWCNTs进行扫描。
1.3.2扫描电镜分析
用导电胶将c-MWCNTs固定在样品台上,然后放入SS-150型冷场扫描电子显微镜中进行扫描。
2 结果与讨论
2.1 c-MWCNTs表征
2.1.1c-MWCNTs 的红外表征
图1为c-MWCNTs 的红外谱图。

图1 c-MWCNTs的红外谱图Fig.1 Infrared spectrum of c-MWCNTs

2.1.2扫描电镜表征
图2为c-MWCNTs的扫描电镜图,其中图2(a)为整体形貌;图2(b)为局部放大图。由图2可知, c-MWCNTs较长,管径分布较为均匀,且外壁光滑。

图2 c-MWCNTs的扫描电镜图Fig.2 SEM of c-MWCNTs
2.2 Nafion/CYP2D6/c-MWCNTs/GCE 电化学行为
2.2.1电化学交流阻抗
图3为玻碳电极交流阻抗谱图;测试底液为0.1 mol/L的KCl和5 mmol/L的[Fe(CN)6]3-/4-混合溶液。
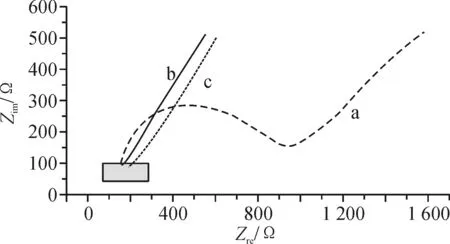
a-玻碳电极;b-c-MWCNTs/玻碳电极;c-CYP2D6/c-MWCNTs/玻碳电极图3 交流阻抗谱图Fig.3 AC impedance spectrum
由图3可知,未经修饰的玻碳电极电子转移阻抗大概为590 Ω。在玻碳电极修饰了羧基化多壁碳纳米管后,其电子转移阻抗下降比较明显,这证明了羧基化多壁碳纳米管具有良好的导电性,对电极表面的电子转移有较好的促进作用[9]。将CYP2D6固定在修饰电极后,电子转移的阻抗出现小幅度增加;这是因为CYP2D6为电的不良导体,玻碳电极固定了CYP2D6后,离子难以从溶液扩散至电极表面,使得阻抗变大。
2.2.2电极修饰过程直接化学
图4为循环伏安曲线;测试底液是浓度为0.1 mol/L、pH值为7.4的PBS溶液;扫描速度为50 mV/s。

a-玻碳电极;b-c-MWCNTs/玻碳电极;c-CYP2D6/c-MWCNTs/玻碳电极
由图4可知,未经CYP2D6修饰的玻碳电极和多壁碳纳米管修饰电极上都没有电流峰存在;而经过CYP2D6修饰后,循环伏安曲线有一对比较明显的氧化还原峰出现[10-13]。这证明经过CYP2D6的修饰,玻碳电极上发生一定的电子转移,进而表明在玻碳电极上成功固定了CYP2D6。
2.3 Nafion/CYP2D6/c-MWCNTs/GCE 在探针底物中的电催化
图5为Nafion/CYP2D6/c-MWCNTs/GCE传感器在不同浓度的右美沙芬中,用DPV法测定的还原峰电流。

图5 Nafion/CYP2D6/c-MWCNTs/GCE传感器在不同浓度右美沙芬中的还原峰电流Fig.5 Reduction peak current ofNafion/CYP2D6/c-MWCNTs/GCE sensorin different concentrations of dextromethorphan
由图5可知,随右美沙芬浓度的增加,还原峰电流也持续增加;这证明本文制备的传感器具备了CYP2D6对抑郁药的代谢能力。
2.4 传感器优化
图6为DPV法测定Nafion/CYP2D6/c-MWCNTs/GCE传感器在含有10 μmol/L帕罗西汀,pH值为7.4、浓度为0.1 mol/L的PBS溶液中的抑制前后酶的生物活性,其中图6(a)为还原峰电流信号随时间变化图;图6(b)为抑制率随时间变化图。

图6 抑制前后酶的生物活性Fig.6 Biological activity of enzyme before and after inhibition
由图6可知,抑制前期,酶抑制率快速增加。当抑制时间达到36 min时,酶抑制率高达70.3%;当继续增加抑制时间,抑制率增加趋势变缓,因此,本试验选择的抑制时间为36 min。
2.5 抗抑郁药对CYP2D2酶活性的抑制
表2为几种抗抑郁药的抑制效果。其中IC50是抑制率为50%时抗抑郁药的浓度,IC50值大小表示该抑郁药对CYP2D6的抑制能力。IC50值越小,则抗抑郁药对CYP2D6抑制能力越强;当IC50比1 μmol/L小时,则该抑制剂为强抑制剂;当IC50位于1~10 μmol/L时,则该抑制剂为中抑制剂;当IC50位于10~50 μmol/L时,则该抑制剂为弱抑制剂;当IC50大于50 μmol/L时,该抑制剂为较弱抑制剂,此时可认定该抑制剂对CYP2D6没有抑制[14-17]。

表2 几种抗抑郁药的抑制效果Tab.2 Inhibitory effect of several antidepressants μmol/L
由表2可知,几种抗抑郁药对CYP2D6的抑制能力从小到大依次为:氟伏沙明(IC50 22.8 μmol/L)、舍曲林(IC50 10 μmol/L)、氟西汀(IC50 3.9 μmol/L)、帕罗西汀(IC50 1.8 μmol/L),这证明了舍曲林和氟伏沙明为弱抑制剂;帕罗西汀和氟西汀为中抑制剂。
2.6 传感器的稳定性和重现性
测定Nafion/CYP2D6/c-MWCNTs/GCE传感器在含有20 μmol/L右美沙芬,浓度为0.1 mol/L、pH值为7.4的PBS溶液中的还原峰电流值。10次试验结果标准偏差为4.3%,这证明了本文制备的传感器具有比较好的重现性。将制备好的电极置于温度4 ℃条件下进行保存,7 d后观察信号损失为4.5%;这证明该传感器具有较好的稳定性。
3 电化学传感器的应用
基于以上传感器对不同抗抑郁治疗药物抑制作用的分析,以对CYP2D6抑制最强的帕罗西汀药物为例,结合于2020年1月~2021年4月收治的抑郁患者102例作为研究对象,将102例患者分为观察组和对照组,其中对照组给予帕罗西汀,每早1次;观察组给予帕罗西汀+失眠认知行为指导。由此对比患者在治疗前及治疗1、3和6个月的PSQ-T评分[18-20];具体结果如图7所示。

图7 治疗前后的PSQ-T评分对比Fig.7 Comparison of the PSQ-T scores beforeand after treatment
由图7可知,与治疗前比较,2组患者治疗1、3和6个月后PSQ-T评分显著降低(P<0.05);治疗1个月联用PSQ-T评分显著低于单用组(P<0.05)。在采用帕罗西汀+失眠认知行为指导的观察组的PSQ-T得分低于对照组,说明采用这种治疗方式可有效治疗抑郁并有失眠的患者。
4 结语
本试验以体积比为3∶1的H2SO4与HNO3混合溶液制备的以c-MWCNTs为基底制备Nafion/CYP2D6/c-MWCNTs/GCE 传感器。通过对 c-MWCNTs微结构和Nafion/CYP2D6/c-MWCNTs/GCE 传感器电化学行为进行表征,得到的具体结论为:
(1)经过体积比为3∶1的H2SO4与HNO3混合溶液作用,成功在多壁碳纳米管上引入羧基。且制备的c-MWCNTs管径均匀,外壁较光滑;
(2)玻碳电极表面成功固定CYP2D6后,离子难以从溶液扩散至电极表面,传感器阻抗变大;
(3)DPV法测定的还原峰电流证明Nafion/CYP2D6/c-MWCNTs/GCE传感器具备CYP2D6对抑郁药的代谢能力;
(4)DPV法对抑制前后酶的生物活性进行测定,在抑制时间为36 min时,酶抑制率为70.3%。而后随时间增加,酶抑制增长速度变慢,确定抑制时间为36 min;
(5)几种抗抑郁药中,舍曲林和氟伏沙明为弱抑制剂,帕罗西汀和氟西汀为中抑制剂。对CYP2D6的抑制能力大小依次为:氟伏沙明(IC50 22.8 μmol/L)、舍曲林(IC50 10 μmol/L)、氟西汀(IC50 3.9 μmol/L)、帕罗西汀(IC50 1.8 μmol/L);
(6)传感器在4 ℃环境下保存7 d,信号损失仅为4.5%;10次还原峰电流值标准偏差仅为4.3%,证明本试验制备的传感器具有较好的重现性和稳定性。
