多模态MRI联合超声显微手术对脑胶质瘤患者的临床效果及预后的影响
2022-11-23蒋琼蒋琳尚晋
蒋 琼 蒋 琳 尚 晋
脑胶质瘤为常见颅内肿瘤,起源于神经胶质细胞,早期可无明显症状,若不及时治疗,甚至可威胁患者生命[1-2]。临床治疗脑胶质瘤仍以手术为主,通过切除病灶组织能够阻止浸润及转移,改善患者病情[3]。但脑胶质瘤具有浸润性生长、恶性程度高等特点,使得肿瘤边界较为模糊,术前还需准确评估切除范围。超声显微手术为当前常见术式,借助超声定位便于术中手术切除范围定位,以实现精准切除,减少病灶残留,但仍存在图像质量欠佳、无法透过颅骨定位等局限性[4-5]。而随着磁核共振成像(MRI)技术的发展,多模态MRI因具有图像分辨率高、磁场均匀性佳等优势被逐渐应用于术前辅助诊断、术中定位引导中,能获取软组织成像、神经血管成像等多种参数成像,更有助于手术方案制定及切除范围精准选取[6]。鉴于此,本研究旨在分析多模态MRI联合超声显微手术治疗脑胶质瘤的临床效果。报告如下。
1 资料与方法
1.1 一般资料
经医学伦理委员会批准,选取68例我院2018年1月至2020年12月收治的脑胶质瘤患者,按随机数字表法分为对照组(34例)及观察组(34例)。对照组男性27例,女性7例;年龄24~65岁,平均年龄(38.96±4.25)岁;临床分期:20例Ⅰ期,14例Ⅱ期;肿瘤位置:10例额叶,15例颞叶,9例枕叶;肿瘤直径2~6 cm,平均肿瘤直径(4.25±0.43)cm;肿瘤类型:22例星形细胞瘤,12例胶质母细胞瘤。观察组男性28例,女性6例;年龄23~67岁,平均年龄(39.05±4.29)岁;临床分期:19例Ⅰ期,15例Ⅱ期;肿瘤位置:9例额叶,17例颞叶,8例枕叶;肿瘤直径2~6 cm,平均肿瘤直径(4.28±0.45)cm;肿瘤类型:24例星形细胞瘤,10例胶质母细胞瘤。一般资料两组对比,无统计学差异(P>0.05)。
1.2 入选标准
纳入标准:符合《中国中枢神经系统胶质瘤诊断与治疗指南(2015)》[7]中诊断;伴有肿瘤压迫、头痛、视物模糊等症状;经病理检查、MRI等综合确诊;患者及家属签署知情同意书。排除标准:凝血系统障碍;肝肾功能不全;精神严重障碍;合并严重心血管疾病;心肺功能欠佳;合并其他恶性肿瘤;妊娠期女性。
1.3 方法
对照组予以超声显微手术治疗:在德国博医来公司Brain-Lab系统引导下设计手术入路,确定切除范围,全麻下开颅后,剪开硬脑膜,术区冲洗、止血后,以凸阵探头平行贴附于硬脑膜表面,查看肿瘤位置、大小、回声特点等具体信息,规划离术区最短路径,选取适宜脑沟、脑回皮质切口、手术通道,并开展血流成像检查,帮助术者掌握病灶周围血供情况;超声完全掌握肿瘤位置、周围结构后,选择最佳入路,并于超声引导下达到显微镜下完全切除,之后对比术前超声图像,评估切除范围及残余程度,留存相应图像。观察组在对照组基础上联用多模态MRI技术:术前开展弥散加权成像、弥散张量成像、氢质子磁共振波谱等检查,由手术医生与磁核室医生共同评估肿瘤级别、边界及周围症状关系,从而评估可切除程度,并确定头皮切开部位来选取手术入路、切开;术中依据弥散张量成像结果判断肿瘤与重要功能区、纤维束等空间结构关系,且超声引导下避开功能区,选择距离肿瘤近、无大血管行走的脑沟、脑回入路,镜下逐渐切除病灶,并反复进行超声探查,判断有无残留。两组术后均动态监测意识状态、血压、颅内压等变化,做好脑积水、脑水肿等预防工作,并随访1年。
1.4 观察指标
(1)手术切除范围:术后1周复查MRI,评估手术切除范围;肿瘤切除超过95%及以上为全切;肿瘤切除85%~95%之间为次全切;肿瘤切除<85%为部分切除。(2)血清肿瘤标志物:术前及术后3个月,采集两组3 ml空腹血,离心处理后以全自动分析仪测定糖类抗原153(CA153)、CA125及癌胚抗原(CEA)水平变化。(3)神经肽水平:术前及术后3个月,腰椎穿刺取5 ml脑脊液,以放射免疫法测定精氨酸升压素(AVP)、β-内啡肽(β-EP)水平。(4)神经功能:术前及术后3个月,两组用神经功能缺损评分(NIHSS)评价神经功能,总分42分,得分越低越好。(5)日常生活能力:术前及术后3个月,采用日常生活能力(ADL)评分评价生活能力,总分100分,得分越高越好。(6)生存质量:术前及术后1年,采用卡氏评分(KPS)评价两组生存质量,总分100分,得分越高越好。(7)并发症:语言不利、肢体麻木、头痛头晕等。
1.5 统计学方法

2 结果
2.1 手术切除范围
观察组全切除率较对照组高,有统计学差异(P<0.05),见表1。

表1 两组手术切除范围对比(例,%)
2.2 血清肿瘤标志物
观察组术后CA153、CA125、CEA水平较对照组低,有统计学差异(P<0.05),见表2。

表2 两组血清肿瘤标志物对比
2.3 神经肽水平
观察组术后AVP、β-EP水平较对照组高,有统计学差异(P<0.05),见表3。
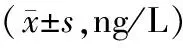
表3 两组神经肽水平对比
2.4 神经功能、日常生活能力及生存质量
观察组术后NIHSS评分较对照组低,ADL评分、KPS评分较对照组高,有统计学差异(P<0.05),见表4。
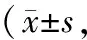
表4 两组神经功能、日常生活能力及生存质量对比分)
2.5 并发症
对照组出现2例肢体麻木,4例头痛头晕,2例语言不利,发生率为11.76%(8/34);观察组出现1例头痛头晕,1例语言不利,发生率为5.88%(2/34)。观察组并发症发生率低于对照组,差异有统计学意义(χ2=4.221,P=0.040)。
3 讨论
脑胶质瘤病因复杂、恶性程度较高,肿瘤可呈浸润性生长,会持续破坏周围正常组织,引起颅内肿瘤占位组织,且随着肿瘤的不断压迫,可引起神经功能损害,诱发共济失调、视物模糊、癫痫等症状,降低患者生存质量[8-9]。手术治疗脑胶质瘤重要方法,但瘤体不断向周围组织浸润,可使得病灶边界模糊,增加手术治疗难度,且肿瘤生长于脑深处,切除过程中如何避免脑功能损害也是手术开展的重点[10-11]。
超声显微手术为当前脑胶质瘤重要术式,相较于传统开颅手术,显微手术可于内窥显微镜下更为精准切除病灶,且精细性高,能最大限度减轻周围正常神经及血管损伤,保护神经系统功能[12-13]。同时,在超声引导下开展显微手术可实现肿瘤精确定位,并实时显示病灶声像图,判断病变的切除程度及范围,达到良好切除效果,避免术后残余发生。但超声引导术中图像多为二维图像,且图像质量偏差,且术前无法辅助手术计划制定。CA153、CA125、CEA为常见肿瘤标志物,当脑胶质瘤发生后上述因子水平可异常升高。AVP、β-EP为内源性物质,具有神经系统保护作用,术中操作损伤神经功能,可促使其水平下降。本研究结果显示,观察组全切除率高于对照组,术后CA153、CA125、CEA水平低于对照组,术后AVP、β-EP水平较对照组高,术后NIHSS评分较对照组低,ADL评分、KPS评分较对照组高,并发症较对照组少。表明多模式MRI联合超声显微手术可提高脑胶质瘤切除效果,加快肿瘤标志物复常,且能减轻神经功能损害,促进日常生活能力恢复,且并发症少。其原因为多模式MRI是一种更为精准的检查技术,其融合常规MRI、弥散加权成像等多种技术,能将脑结构及脑功能影像相结合,实现肿瘤病灶、重要功能区的可视化,从而更为直观显示肿瘤位置、周围组织关系,有助于临床术前制定手术方案,最大限度切除病灶,并能够减轻手术创伤,保护脑神经功能[14-15]。多模式MRI图像分辨率高、成像效果好,能更好的反映肿瘤类型、重塑脑白质纤维传导束与胶质瘤关系,直观显示神经纤维走行,便于明确肿瘤边界,减小手术创伤的,提高切除效果。与超声显微手术联用后则可进一步明确肿瘤定位及周围空间结构,以便于术中精细化操作的开展,兼顾精准切除及微创伤。
综上所述,多模式MRI联合超声显微手术可提高脑胶质瘤患者全切除率,降低血清CA153、CA125、CEA水平,减轻神经功能损害,减少并发症发生,改善生存质量。
