体素内不相干运动成像在预测肝癌微血管侵犯中的价值
2022-11-22陈俊羽殷江浩李侠
陈俊羽,殷江浩,李侠
肝细胞肝癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一。虽然手术切除、射频放疗、肝移植方法均等对肝癌有一定的治疗效果,但其术后复发率仍居高不下,严重影响患者的预后[1]。微血管侵犯(microvascular invasion,MVI)是肝癌复发的重要因素[2],因此,明确是否存在MVI对肝癌治疗方案的制定具有重要意义。
扩散加权成像(diffusion weighted imaging,DWI)可无创反映肿瘤内水分子的扩散特征,揭示微观结构,在MVI的预测中已有报道[3-4]。然而,传统DWI是基于单指数模型,并不能完全反映扩散信号的变化。体素内不相干运动(intravoxel incoherent motion,IVIM)成像包括真实扩散及毛细血管微循环灌注两个方面,对扩散运动的描述更接近真实。IVIM成像在预测MVI中的价值尚未有报道,因此本研究探讨IVIM成像在预测HCC中MVI的应用价值。
材料与方法
1.一般资料
回顾性分析2016年2月-2021年8月经手术和病理证实的145例HCC患者的MR图像资料。纳入标准:①所有患者为初发首诊,MR检查前未进行各种治疗;②影像检查和手术时间间隔在一个月之内。排除标准:图像质量不佳,不符合测量要求。最终纳入104例患者,男78例,女26例,年龄42~81岁,平均年龄(60.4±9.3)岁。本研究通过了本院伦理委员会批准,免除受试者知情同意。
2.检查方法
采用1.5T超导磁共振成像系统(SIGNA 1.5T HDi,GE Healthcare),8通道腹部相控阵线圈。扫描前患者空腹6~8 h,并进行平静呼吸和屏气训练。扫描序列及参数如下:①T2WI:FOV 38 cm×38 cm,矩阵320×256,层厚6 mm,层间距2 mm,TE 85 ms,TR 8000 ms;②单b值DWI序列:FOV 38 cm×38 cm,矩阵128×128,层厚6 mm,层间距2 mm,TR 6000 ms,TE 78 ms,b值分别为0和800 s/mm2;③多b值IVIM序列:常规参数同前,b值分别为0、20、50、100、150、200、400、600、800、1000 s/mm2;④肝脏加速容积采集技术(liver acquisition with volume acceleration,LAVA)动态增强序列,FOV 38 cm×38 cm,翻转角(FA)12°,TR 3.8 ms,TE 1.8 ms,矩阵288×224,层厚4.0 mm。对比剂采用钆喷酸葡胺(Gd-DTPA,拜耳药业),注射剂量为0.2 mmol/kg体重,流率2.0 mL/s,随后用等速等量生理盐水冲管,采集蒙片、动脉期、门静脉期、平衡期及延迟期。
3.图像分析
将图像传至AW 4.6工作站(Advantage Workstation 4.6,GE Healthcare),分别处理DWI和IVIM图像。DWI后处理得到表观扩散系数(apparent diffusion coefficient,ADC)图。ADC值的计算基于以下公式:Sb/S0=exp(-bADC)。IVIM参数计算基于以下公式:Sb/S0= fexp(-bD*)+(1-f)exp(-bD),其中S0为b值为0时的信号强度,而Sb则为b值为非0时的信号强度。D值为扩散系数,代表纯的水分子扩散运动,单位为mm2/s,D*值为灌注相关的扩散运动,单位为mm2/s,f值为灌注分数。两名腹部专业硕士研究生勾画肿瘤所有层面的边界,以增强图像作为参考,尽量避开囊变坏死区。计算肿瘤整体各参数的平均值,最终由一名有15年腹部MR诊断经验的副主任医师对ROI勾画的准确性进行审核。
4.HCC病理结果及MVI判定
由一名8年诊断经验的病理专家进行HCC病理分级及有无MVI的判定,标准为显微镜下内皮细胞衬覆的血管腔内可见癌细胞巢团即可诊断MVI,常见于癌旁肝组织内门静脉小分支及肿瘤包膜内血管。
5.统计学分析
采用SPSS 22.0软件将数据进行统计分析,采用组内相关系数(intraclass correlation coefficient,ICC)评价两名研究生测量结果的一致性(ICC≤0.5,一致性差;ICC为0.51~0.75,中度一致性;ICC为0.76~0.90,一致性较好;ICC>0.90,一致性很好)。采用K-S检验分析数据的正态分布性,检验结果显示各参数均服从正态分布,测量结果以均数±标准差表示。采用独立样本t检验比较MVI阳性和MVI阴性组的D、D*及f值,采用Logistic回归分析预测MVI的独立影响因素。采用受试者操作特征(receiver operating characteristic,ROC)曲线评估差异有统计学意义的参数对MVI阳性的诊断效能。以P<0.05表示差异有统计学意义。
结 果
1.HCC患者MVI分组结果及临床病理特征
在104例HCC中,MVI阳性组57例,其中男43例,女14例,平均年龄63.2±12.6岁。MVI阴性组47例,其中男35例,女12例,平均年龄56.7±8.5岁。两组间年龄和性别的差异无统计学意义(P>0.05),见表1。
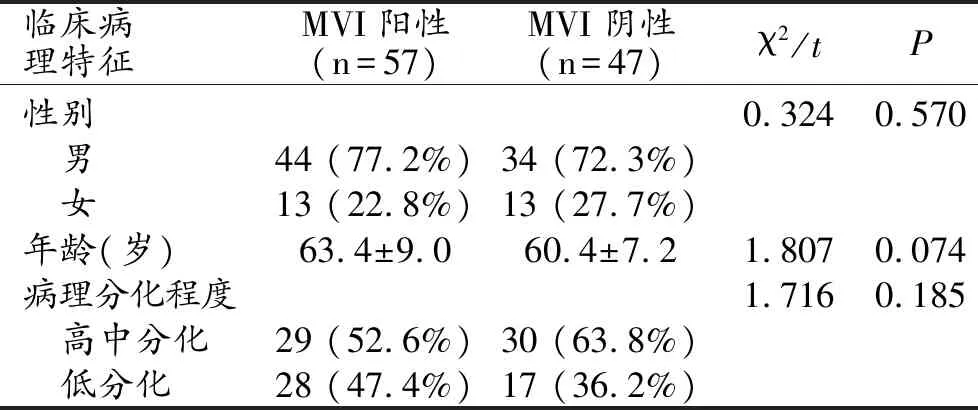
表1 两组患者临床资料及病理结果对比
2.测量结果一致性检验及DWI和IVIM参数比较
两名研究生测量结果的ICC值在0.825~0.930之间,一致性较好。HCC MVI阳性患者平扫、增强及IVIM影像表现见图1。MVI阳性组及阴性组DWI/IVIM参数比较结果显示,MVI阳性组的ADC值和D值均低于MVI阴性组(P<0.05),而两组的D*和f值差异无统计学意义(P>0.05),见表2。

表2 MVI阳性组和阴性组ADC及IVIM参数比较
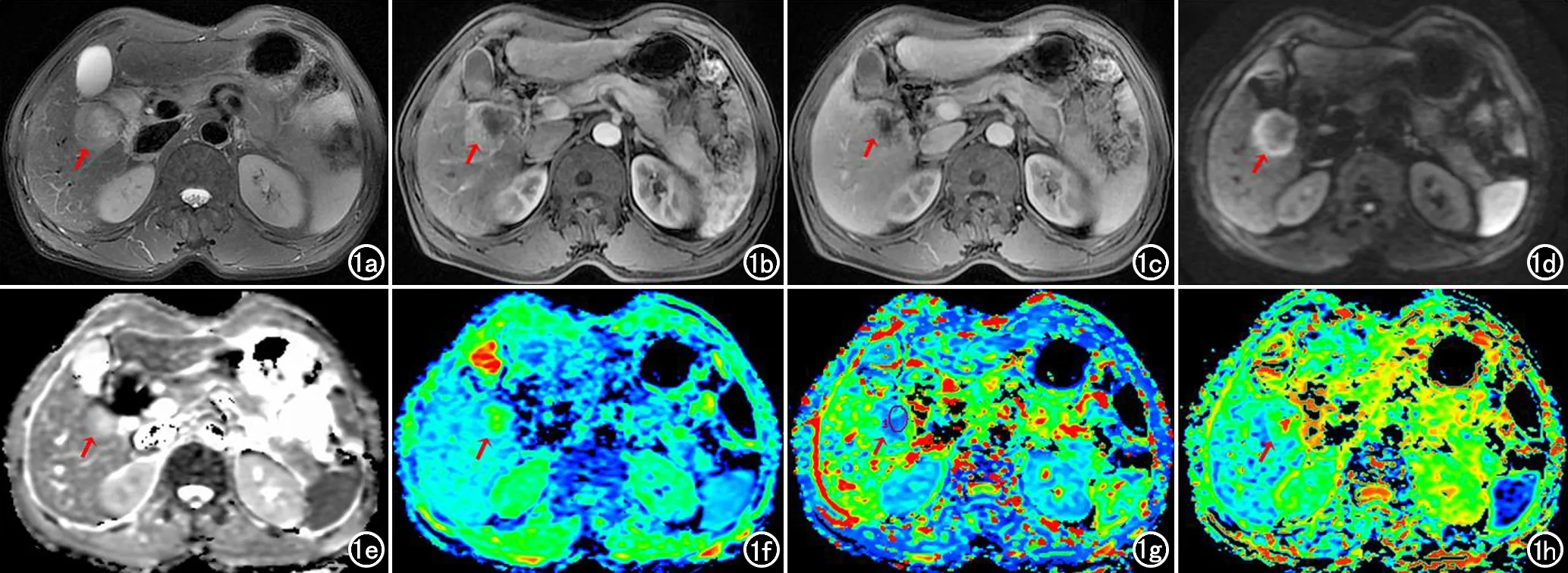
图1 男,64岁,肝右叶HCC,MVI阳性。a)T2压脂序列可见肿瘤信号混杂;b)动脉期,肿瘤不均匀强化;c)门静脉期,强化退出;d)b值为800s/mm2时的DWI图;e) ADC图,ADC=1.13×10-3mm2/s;f)IVIM D图,D=0.92×10-3mm2/s;g)IVIM D*图,D*=11.6×10-3mm2/s;h)IVIM f图,f=27.4%。
3.Logistic回归及ROC曲线分析
将存在组间差异的参数进行单因素回顾分析,结果显示,MVI阳性组与MVI阴性组的ADC值(OR=1.486,95%CI:1.253~1.762,P<0.001)和D值(OR=1.690,95%CI:1.372~2.082,P<0.001)差异具有统计学意义。继续进行多因素回归分析,D值是预测MVI阳性的独立危险因素(OR=3.274,95%CI:1.670~6.421,P<0.01),而ADC值则不是独立危险因素(P>0.05)。ADC值和D值预测MVI的ROC曲线分析见图2。ADC值和D值的AUC分别为0.787和0.826。当D的截断值为0.853×10-3mm2/s时(95%CI:0.749~0.903),敏感度为80.9%,特异度为71.2%。
讨 论
微血管癌栓,是指在显微镜下在内皮细胞衬覆的血管腔内的癌细胞巢团,当管腔内出现悬浮癌细胞数目≥50个时,即可称为MVI。MVI反映HCC早期侵袭及转移能力,与术后复发和远期生存率密切相关[5]。早期确定MVI,就可进行更大范围的手术切除或射频消融改善预后。然而,目前MVI只能通过术后病理证实,术前穿刺活检虽然有一定的帮助,但属于有创性方法,且存在取样误差。因此,术前无创评估MVI对于HCC的精准治疗尤为重要。
研究报道,MR常规形态学成像,如肿瘤大小、边缘、动脉期瘤周强化、肝胆期肿瘤信号、瘤周低信号等表现均可帮助预测是否存在MVI[6-8]。然而,影像特征与MVI的相关性仍不明确。DWI及ADC值在肝脏病变检出、鉴别诊断等方面的价值优于解剖成像,而其在判断MVI中的价值也越来越受到关注。本研究发现,MVI阳性组的ADC值低于MVI阴性组,表明ADC值可帮助预测MVI,这与以往的研究结果一致[9-11]。然而,在多因素回归分析中,ADC值并不是预测MVI的独立因素。随着对扩散成像研究的深入,有学者发现组织中毛细血管随机排列类似水分子的扩散,当b值较低(<200 s/mm2)的时候,微循环灌注是影响扩散信号的主导因素,因此提出了基于双指数模型的IVIM理论[12]。国内外研究均证实,IVIM在肝脏病变的良恶性鉴别及疗效评价等方面的价值均要优于单指数的ADC值[13-14]。本研究表明,MVI阳性组的D值显著下降,诊断效能优于ADC值,且多因素回归分析提示其也是预测MVI的危险因素,这也提示微循环灌注会影响ADC的测量。MVI阳性组中ADC和D值的下降可能与以下原因有关,MVI阳性的肿瘤恶性程度更高,侵袭性更强,增殖速度更快,使得细胞密度更大,因此细胞间水分子扩散受限。同时,异质性更高的肿瘤核浆比例更高,细胞内水分子扩散也受影响。此外,MVI患者的门静脉、肝静脉分支内的微小癌栓也是阻碍水分子的自由扩散的因素之一。在本研究中,D*值和f值在MVI阳性与阴性组中差异并无统计学意义,这与Wei等[15]研究结果一致。D*值反映血流灌注量,而f值与肿瘤血管生成有关,两组D*和f值无差异的原因可能在于MVI主要存在于镜下微血管中,轻微的血流改变尚不足以引起宏观的血流量变化。Li等[16]的研究报道MVI阳性患者D*值和f值有轻微升高,这可能与序列参数设置的不同有关,以往研究报道TE值、T2效应、噪声等对D*和f值均有一定影响,且测量结果的稳定性和可重复性都有待提高[17]。

图2 a)ADC值预测MVI的ROC曲线;b)D值预测MVI的ROC曲线。
本研究存在一些不足之处:第一,样本量较小,需要更大样本量及多中心的研究。第二,DWI基于单次激发平面回波成像,图像分辨率低,且存在变形及磁敏感伪影,勾画肿瘤边界容易出现误差。下一步的研究可采用多次激发成像技术改善DWI的图像质量[18],提高测量准确性。第三,组织病理的采样部位和图像测量点难以匹配,因此,本研究测量了肿瘤整体的参数值,以尽可能减少这种误差。
总之,MVI严重影响HCC患者复发和预后,术前无创的预测MVI至关重要。IVIM参数中的D值优于传统ADC值,能更好的帮助判断MVI,且是预测MVI的独立危险因素,因此在HCC患者治疗方案的选择和预后评价中具有一定价值。
