ZooMit-DWI对肺癌的病理分型诊断价值:与常规DWI的对照研究
2022-11-22李广政黄仁军杜明占胡粟李勇刚李平
李广政,黄仁军,杜明占,胡粟,李勇刚,李平
肺癌是全世界人类癌症死亡的主要原因之一[1]。术前准确的诊断、分期和组织学分型等对于选择最佳的治疗策略至关重要,直接影响肺癌患者的预后[2-3]。胸部磁共振成像(magnetic resonance imaging,MRI)无电离辐射,且能通过结构和功能成像对肺部疾病进行综合评估。扩散加权成像(diffusion weighted imaging,DWI)是其中一种无辐射、无创、无需对比剂的功能成像检查方法[4-5],通过探测病灶内水分子扩散受限的变化来表征组织的微观结构,扩散受限的变化可量化为表观扩散系数(apparent diffusion coefficient,ADC)[6]。既往研究表明其在评估胸腔内病变和肺部肿瘤特征方面的应用和潜在优势[7-11]。然而常规DWI(conventional DWI,C-DWI)序列采用单次激发回波平面成像(echo planar imaging,EPI),其优点是成像速度快,但空间分辨率低、图像几何畸变较重,图像质量难以保证。ZooMit-DWI(Z-DWI)通过采用两个脉冲序列选择性激发兴趣区获取信号,在不增加扫描时间的情况下使图像几何变形程度减少、磁敏感伪影减低、空间分辨力提高[12-14]。已有文献报道ZooMit-DWI在前列腺[15]、胰腺[16]、肾脏[17]等病变方面显示了较高的应用价值,但在肺癌研究中尚未得到证实。本研究旨在探讨ZooMit-DWI在肺癌成像中的可行性,并进一步研究其在评估肺癌不同病理类型及分化程度中的初步应用价值。

表1 扫描序列及参数
材料与方法
1.一般资料
连续收集2020年6月-2021年5月经本院收治的76例疑似肺癌患者的临床及影像资料。纳入标准:①常规影像学(X线或CT等)证实的肺部原发占位;②病灶直径≥1.5 cm;③临床资料完整;④检查前未行放疗、化疗、穿刺、靶向治疗及手术治疗。排除标准:①病情较重,配合不佳者(n=3);②有磁共振禁忌症,如体内金属植入物等;③临床资料不完整(n=3);④肿瘤最大直径<1.5 cm(n=3);⑤良性病例或临床少见肿瘤,如肉芽肿、大细胞癌、腺鳞癌等(n=4)。最终入组63例。所有患者均经穿刺或手术病理证实,并于穿刺或手术前一周内完成磁共振检查。所有患者检查前均签署知情同意书,本研究获得伦理委员会批准。
2.检查方法
采用Siemens 3.0T磁共振扫描仪(MAGNETOM Skyra,Siemens Heahhcare,Edangen,Germany)及体部18通道表面相控阵线圈。患者仰卧位,双臂上举,检查前对患者进行呼吸训练,以减少呼吸运动伪影。图像采集包括冠状面T2WI、横轴面3D-T1WI、T2WI、常规DWI、ZooMit-DWI和增强后横轴面3D-T1WI。C-DWI图像是在横轴面和全视野激发下获得的。而Z-DWI是通过缩小FOV放大病变区域选择性激发获得。ADC图采用低b值和高b值的单指数函数计算。具体参数见表1。
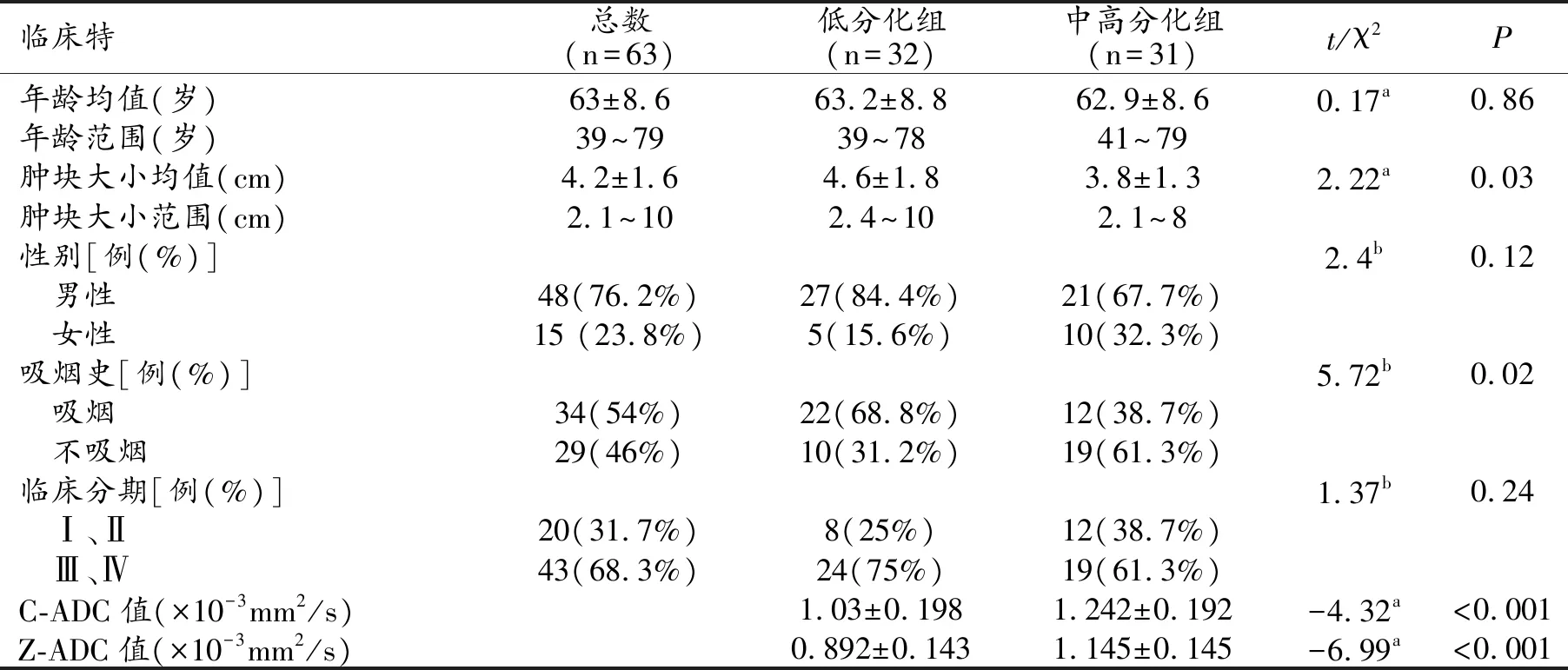
表2 一般临床资料
3.图像分析与测量
图像使用RadiAnt DICOM Viewer软件查看,将C-DWI图像放大到与Z-DWI图像相同大小。由两名具有10年以上胸部影像诊断经验的医师以匿名和随机的方式对C-DWI及Z-DWI图像进行评价和分析,分析前对与图像相关的临床和组织病理学结果不知情。两位观察者根据图像质量和总体偏好分别对C-DWI和Z-DWI序列进行排序独立评价,以李克特量表5分制评估,5分表示图像质量最佳(病变信号明显增高,边缘清晰,无图像失真),4分图像质量好(病变信号明显增高,边缘较清晰,图像轻微失真),3分图像质量一般(病变信号中度增高,边缘模糊,图像失真较严重),2分图像质量较差,但不影响诊断(病变信号略增高,边缘模糊,图像失真严重),1分表示图像无法诊断(病灶无法识别,显示不清)[17]。根据纳入标准纳入的所有患者图像均能达到诊断要求(图像评分均≥2分)。计算两组DWI图像信噪比(SNR),对比度(CR)、对比噪声比(CNR)。SNR=SI病灶/SD病灶,CR=SI病灶/SI脊髓,CNR=|SI病灶-SI脊髓|/SD病灶,其中SI病灶是b=800 s/mm2时DWI图像中病变区域的信号强度,SD病灶为病变区域信号强度的标准差,SI脊髓为同层面脊髓信号强度。由于Z-DWI小视野原因,有9例未能包含同层面脊髓,因此笔者选择了能够测量的54例,进行SNR、CR、CNR的计算。
图像上传至Siemens Syngo后处理工作站,由两人盲法随机测量C-DWI及Z-DWI序列中病灶组织的ADC值。选取肿瘤直径最大横断面,结合CT和磁共振图像避开坏死、囊变、出血和图像变形区,将兴趣区(region of interest,ROI)置于病灶实体部分。在每次测量中对最大层面的相邻上下两层用同样方法进行测量,将三个值的平均值作为测量结果。同一病灶ROI 大小尽量一致,ROI范围取0.5~2 cm2。C-ADC及Z-ADC最终值取两人测量平均值。
4.统计学方法
采用SPSS 25.0统计分析软件。数据的正态性分布通过Shapiro-Wilk W检验进行评估。符合正态分布的计数资料采用平均值±标准差表示,组间差异采用t检验(两组间)或方差分析(大于两组间)比较。不符合正态分布的计数资料采用中位数(四分位数,IQR)进行表示,组间差异采用配对样本Wilcoxon秩和检验进行比较。计量资料采用数值(百分比)表示,组间差异采用卡方检验比较。采用组内相关系数(interclass correlation coefficient,ICC)评估两个观察者测量图像ADC值的一致性。当ICC>0.75时被认为一致性较高。采用受试者操作特征(receiver operating characteristic,ROC)曲线对肺癌中高分化组、低分化组ADC值进行诊断效能分析。以P<0.05认为差异有统计学意义。
结 果
1.一般临床资料
最终入组63例肺癌患者,腺癌34例,鳞癌20例,小细胞癌9例,其中低分化32例,中高分化31例,共有63个病灶纳入研究。其中男48例,女15例,年龄39~79岁,平均63±8.8岁。肿块直径2.1~10 cm,平均(4.2±1.6) cm。34例患者有吸烟史(5~33年)。
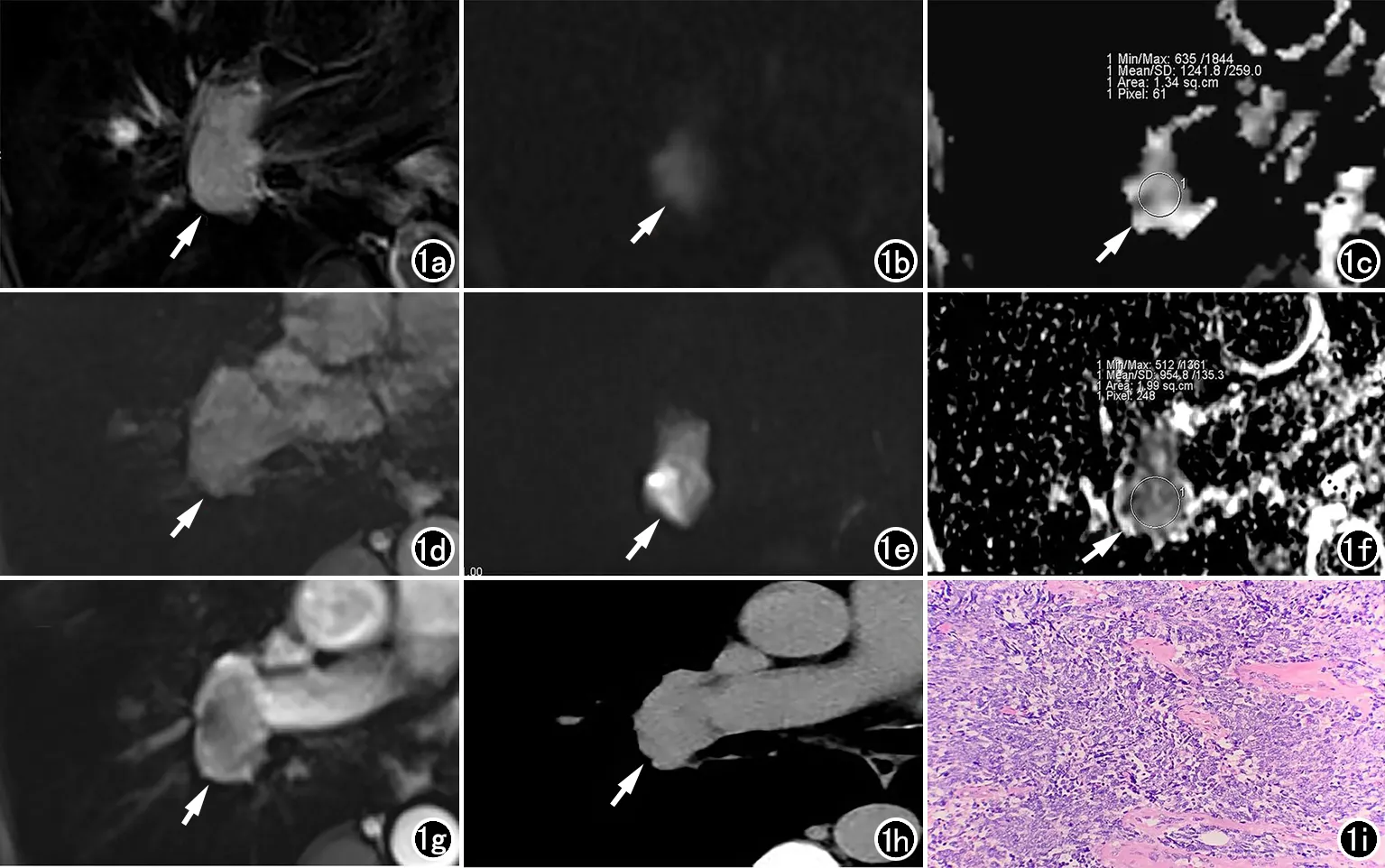
图1 男,57岁,右肺门部占位,病理提示低分化小细胞肺癌。a)自由呼吸T2压脂横轴面示病灶边缘不规则(箭),病变大小约2.5 cm×3.6 cm,信号较均匀;b、c)分别为C-DWI序列DWI(b=800 s/mm2)图及ADC图像,评分2分,病灶ADC值(1.24±0.26)×10-3mm2/s;e、f)分别为Z-DWI序列DWI(b=800 s/mm2)图及ADC图像,可见图像模糊和失真更少,边界更清晰,病灶扩散受限明显,图像质量显著优于常规DWI,评分4分,ADC值(0.95±0.13)×10-3mm2/s;d、g)分别为T1平扫和增强图像,增强后病灶内部不均匀强化;h)CT纵膈窗示右肺门部软组织肿块;i)病理提示小细胞癌(HE,×200)。
63例肺癌患者中,中央型35例,周围型28例。详见表2。
2.图像质量评价及ADC值测量一致性比较
Z-DWI序列整体图像质量、SNR、CR、CNR得分均显著高于C-DWI序列(P<0.001,表3)。
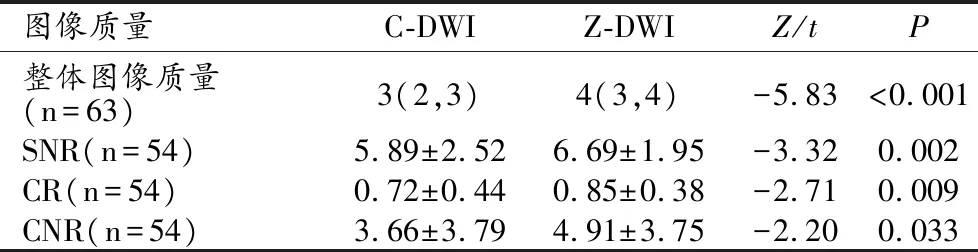
表3 C-DWI和Z-DWI的图像质量评价
不同观察者间测量病灶的ADC平均值差异无统计学意义(P>0.05),不同观察者在Z-DWI序列上测量ADC值的一致性优于C-DWI序列 (表4)。

表4 C-DWI和Z-DWI序列不同观察者间ADC值测量一致性
3.不同病理亚型肺癌C-ADC值及Z-ADC值比较
C-ADC值在腺癌、鳞癌组均较Z-ADC值高,差异有统计学意义(P<0.05)。C-ADC值与Z-ADC值在小细胞癌组差异没有统计学意义(P>0.05,表5)。C-ADC值组间两两比较,小细胞癌组和鳞癌组、腺癌组之间的差异有统计学意义(P<0.05),鳞癌组和腺癌组间差异没有统计学意义(P=0.166)。三组Z-ADC值组间两两比较,差异均有统计学意义(P<0.05)。图1~3为三例典型病例图像。
4.两种DWI序列ADC值在鉴别肿瘤分化程度中的比较
中高分化组C-ADC值及Z-ADC值均明显高于低分化组,差异有统计学意义(P<0.001,表2)。C-ADC、Z-ADC值诊断中高分化肺癌的ROC曲线下面积分别为0.776、0.897(图4),当C-ADC值为1.049×10-3mm2/s时诊断的敏感度为87%,特异度为56%。当Z-ADC值为1.052×10-3mm2/s时诊断的敏感度为77%,特异度为87%。

表5 不同病理亚型肺癌C-ADC值及Z-ADC值的比较
讨 论
相对于CT检查,MRI检查在胸部病变方面的应用依然有极大的挑战,尽管其软组织成像优势以及扩散特征对疾病诊断有很大帮助,但胸部解剖区域特殊性、扫描时间长、受检者呼吸配合程度、以及扫描参数的设置等带来的难度高于其它部位,并且由于磁敏感伪影、化学位移伪影和空间分辨率等问题,磁共振胸部扩散成像质量一直不太令人满意。因此保证DWI定量研究的准确性和提高诊断可信度方面尤为重要。
在本研究中笔者采用C-DWI和Z-DWI成像,并对两组图像质量进行对比,发现与C-DWI相比Z-DWI成像提供了更好的图像质量,并且显示了较好的ADC值测量一致性。胸部常规DWI检查采用单次激发回波平面成像(single shot echo planar imaging,SS-EPI),大视野激发成像同时包含了气体、骨骼和软组织等磁敏感伪影较重,并且3.0T磁共振胸部检查中B0场不均匀性也会更加明显。Z-DWI成像除了回波平面成像还同时使用另一个并行射频脉冲序列,即采用二维选择性激励射频技术,可以有效地避免在多层扫描时各层之间的射频交叉干扰,同时缩小相位方向上的视野(field of view,FOV)大小、减少相位编码步数、缩短平面回波成像(EPI)回波链长度及回波时间,将卷褶伪影的负面影响降至最低,并减少失真和模糊、减少运动和流动伪影、提高空间分辨率[12-13,18-19],使整体的图像质量得到改善。在客观评价定量比较中,Z-DWI图像的SNR、CR、CNR均高于C-DWI,与Attenberger等[15]的研究结果相一致。亦有研究报道Z-DWI技术在甲状腺[20]和胃癌[21]成像中较C-DWI相比提供了更好的图像质量改进并且提高了诊断信心。因此Z-DWI相较于采用SS-EPI技术的C-DWI技术具有更好的磁场均匀性、更少的图像失真和磁化伪影、更高的空间分辨率,从而使DWI在胸部成像方面具有较大的潜力。

图2 女,47岁,右下肺占位,病理提示高分化腺癌。a)自由呼吸T2压脂横轴面示病灶边缘不规则,大小约3.5 cm×3.1 cm,信号较均匀,伴远处阻塞性炎症;b、c)分别为C-DWI图像DWI(b=800 s/mm2)图及ADC图像,评分2分,ADC值(0.998±0.159)×10-3mm2/s;e、f)分别为Z-DWI图像DWI(b=800 s/mm2)图及ADC图像,可见图像模糊和失真更小,边界较清晰,病灶扩散受限明显,图像质量优于常规DWI,评分3分,ADC值(1.147±0.101)×10-3mm2/s;d、g)分别为T1平扫和增强图像,增强后病灶明显强化;h)CT纵膈窗示右下肺软组织肿块;i)病理提示高分化腺癌(HE,×200)。
在本研究中,C-DWI和Z-DWI的扫描层厚、定位、b值等参数均保持一致以获得较高的DWI图像质量和较准确的ADC值。虽然胸部磁共振扩散成像的最佳b值还有待确定,但随着b值的增加,对扩散效应的敏感性增加,图像失真会更大。以往研究人员使用过不同的b值集进行过研究,例如0和800 s/mm2,0和600 s/mm2,0和1000 s/mm2[22-24]。Abdel Razek等[25]建议b值大于500 s/mm2以避免灌注的影响,建议b值小于1000 s/mm2以获得更好的胸部MRI信噪比。因此笔者采用b值0和800 s/mm2进行研究,以获得较高的图像质量和较准确的ADC值。由于ADC值的再现性是比较不同技术时的主要关注点,因此笔者对肺癌常见的几种病理类型进行了两种DWI序列ADC值的比较。发现在腺癌组、鳞癌组Z-ADC均值低于相应组C-ADC均值,差异有统计学意义。这与东强等[21]在胃癌C-DWI与Z-DWI技术评估ADC值的结果相一致,笔者认为这可能是因为C-DWI图像分辨率低,部分容积效应明显,并且EPI序列的固有磁敏感伪影、化学位移伪影、几何畸变和图像分辨率差等[26]缺点,容易使ADC值的测量受到影响。而Z-DWI在缩小FOV的同时对采集矩阵保证最大,提高了图像分辨率以及图像细节的显示能力,对病灶的显示变形程度小,病灶显示的图像质量得到了一定的改善,从而使测得的ADC值更加的准确。然而Sim等[27]研究Z-DWI在鉴别胆管远端良恶性狭窄中的应用时,发现与C-DWI获得的ADC值相比,两组ADC值差异没有统计学意义,但在良恶性鉴别方面Z-DWI与C-DWI相比提供了更高的AUC值和敏感度,并显示了较高的一致性。这些发现同样提示了Z-DWI可能具有更准确的ADC值,但同时还需要更多的病例进一步研究。
尽管目前肺癌的治疗取得了一些进展,但一些组织学类型、肿瘤细胞分化程度较差仍然预示着不良的预后[28]。因此,在术前通过可靠的成像方式来预测肿瘤组织学类型以及分化程度有助于评估患者的预后。不同组织类型及分化程度的肿瘤细胞密度、生长排列方式、细胞外间隙和细胞膜结构等的改变都会导致水分子运动受限,ADC值有所差别,以往研究[29,30]也显示了在不同组织学类型或分化程度中肿瘤病灶ADC值的差异。因此提示ADC值也可能反映了肺肿瘤的内部特征。在本研究中,三种肺癌组织学类型的Z-ADC值两两比较均有显著的差异,而C-ADC值仅在小细胞癌和鳞癌、腺癌的比较中显示出了显著差异,此外本研究还显示,Z-ADC值在鉴别中高分化肿瘤中较C-ADC值具有更大的AUC值和更高的特异度,可能是因为Z-ADC值比C-DWI更加敏感[31],提示Z-ADC值可能在鉴别肺癌不同组织学类型及分化程度中具有更好的应用价值。此外,作为无创性的诊断方法,对于有禁忌症而无法进行有创活检的肺癌患者,胸部MRI有望作为补充手段进行术前诊断,为治疗方案的选择提供依据。

图3 男,64岁,右肺上叶占位,病理提示浸润性腺癌(腺泡+实体+乳头亚型)。a)自由呼吸T2压脂横轴面示病灶边缘不规则似见多发分叶(箭),病变大小约2.2 cm×2.5 cm,信号呈混杂高信号;b、c)分别为C-DWI图像DWI(b=800 s/mm2)图及ADC图像,图像失真较大,评分2分,ADC值(1.107±0.199)×10-3mm2/s;e、f)分别为Z-DWI图像DWI(b=800 s/mm2)图及ADC图像,可见图像模糊和失真更小,边界较清晰,病灶扩散受限明显,图像质量优于常规DWI,评分4分,ADC值(1.071±0.083)×10-3mm2/s;d、g)分别为T1平扫呈混杂低信号和增强病灶不均匀强化;h)CT纵膈窗示右肺上叶软组织肿块;i)病理提示浸润性腺癌(HE,×200)。

图4 C-ADC、Z-ADC值用于诊断中高分化、低分化肺癌的ROC曲线,曲线下面积分别为0.776、0.897。
当然本研究有一定局限性。首先,Z-DWI成像对于特定结构成像具有优势,比如病灶的成像,但对视野之外病变的检测和评估是有限的,比如纵隔内淋巴结的转移,如果将Z-DWI纳入临床常规检查,可能会对视野之外的病灶遗漏。因此,在临床常规中实施Z-DWI序列需要额外的序列对周围结构进行评估,可能导致更长的扫描时间。其次,关于最佳的DWI技术和图像分析程序,包括感兴趣区(ROI)放置的大小和位置,在以往文献中没有共识,这不可避免的会造成一定的测量误差。此次研究的样本量有限,并且病变类型方面只纳入了腺癌、鳞癌和小细胞癌,未对其他类型肿瘤或者良性病变进行比较,未来还需要进一步扩大样本量,纳入更多的病变类型,验证本研究的结果。
总而言之,本研究显示ZooMit-DWI成像技术在肺癌成像中,较C-DWI序列具有更好的图像质量及ADC值测量的稳定性。且ZooMit-DWI序列有助于肺癌不同病理亚型及组织分化程度的鉴别诊断。
