慢性束缚应激对大鼠杏仁核细胞凋亡的影响
2022-11-21董丽儒连俊波霍双杰罗丹杨虎宋旭东张晓静丛斌
董丽儒,连俊波,霍双杰,罗丹,杨虎,宋旭东,张晓静,丛斌
1.华北理工大学附属医院病理科,河北 唐山 063000;2.武警河北省总队医院病理科,河北 石家庄 050081;3.河北医科大学法医学院,河北 石家庄 050017
在法医学鉴定中经常遇到受害人在遭受长期捆绑或限制体位等应激情形后出现一定程度焦虑或抑郁样精神损伤的案件[1]。由于此类精神损伤的分子机制尚不清楚,且缺乏客观的评判标准,使此类应激原与精神损伤之间的关系难以界定,常导致案件久拖不决,给社会造成不良影响。因此,揭示此类应激原导致精神损伤的病理分子机制具有重要的法医学意义。
杏仁核是参与情感、认知形成的脑区,与焦虑、恐惧密切相关[2]。毁损双侧杏仁核的大鼠缺乏对恐惧事件的分辨能力。临床影像学研究[3]发现,重度抑郁和痴呆患者的杏仁核体积会发生明显变化,胶质细胞占据了杏仁核内细胞成分的1/2,在维持杏仁核正常神经系统功能方面发挥了重要作用。有研究[4-5]结果显示,星形胶质细胞凋亡与许多中枢神经损伤性及退行性病变密切相关。机体对持续改变的外界环境的适应是维持精神、神经系统功能稳态的重要基础,适度的应激对机体学习和认知是有利的,极度或慢性的应激会引起相反的效果,包括学习和认知障碍以及与应激相关的神经精神紊乱(如焦虑、抑郁、创伤后应激障碍等)[6-8]。因此,探讨应激对杏仁核胶质细胞的影响及其机制对于揭示应激致精神损伤的分子机制具有重要意义。本研究拟通过建立大鼠慢性束缚应激(chronic restraint stress,CRS)模型,观察CRS 大鼠杏仁核糖皮质激素受体(glucocorticoid receptor,GR)和胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)的表达以及胶质细胞超微结构和细胞凋亡状态的改变,以期揭示应激导致精神损伤的分子机制。
1 材料与方法
1.1 实验动物
健康雌性SD 大鼠170 只,体质量200~250 g,购自河北医科大学实验动物中心[实验动物生产合格证号:SCXK(冀)2013-1-003]。将大鼠置于恒温[(24±2)℃]、湿度60%±10%的环境下,常规高压灭菌饮食,适应性喂养7 d 后随机分组进行后续实验。
本研究经华北理工大学动物伦理委员会批准(审批文号:LAEC-NCST-2020139),实验严格按照动物伦理学要求进行。
1.2 主要试剂及仪器
BCA 蛋白浓度测定试剂盒、增强化学发光法(enhanced chemiluminescence,ECL)检测试剂盒(小鼠/兔IgG)购自北京索莱宝科技有限公司,过氧化物酶标记纯化亲和抗兔IgG(H+L)购自美国KPL 公司,戊巴比妥钠(纯度99.99%)购自美国Sigma-Aldrich公司,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自英国Abbexa 公司,NR3C1 抗体购自美国Affinity Biosciences 公司,抗GFAP 抗体[GF5]购自中国台湾arigo Biolaboratories 公司,GAPDH 抗体购自美国Santa Cruz Biotechnology公司,AnnexinV-FITC/PI 细胞凋亡双染试剂盒购自美国BD 公司,一抗稀释液、通用型SAP 试剂盒(小鼠/兔通用型)、DAB 显色试剂盒购自北京中杉金桥生物技术有限公司。
FACSCaliburTM流式细胞仪(美国BD 公司),FA2004N电子分析天平(上海精密科学仪器有限公司),Infinite F200 型多功能酶标仪(瑞士TECAN 公司)。高架十字迷宫视频分析系统(上海吉量软件科技有限公司),大鼠专用脑模具和CRS 模型模具均为自制。
1.3 大鼠CRS 模型的建立及验证
CRS 装置参考WANG 等[9]的CRS 模型,采用木质自制捆绑束缚架。束缚架分为上下两层:下层为底座,大小为10.0 cm×20.0 cm×2.8 cm;上层为平台,大小为22.0 cm×6.6 cm。上层平台的一端有两个小架子用于固定大鼠头部,两边各有4 个凹槽用于固定大鼠四肢,平台中部有两组可调节绑带用于固定大鼠胸腹部。大鼠被绑带固定在平台上,以大鼠置于其中不能自由移动和转身为宜,每日光照12 h(7:30~19:30),其间束缚6 h。束缚期间禁食禁水,其余时间自由进食进水。
1.3.1 实验分组
对照组:不接受任何刺激,自由进食进水,共40只大鼠,随机分为4 组,每组10 只;其中1 组每日称体质量,并行高架十字迷宫实验、肾上腺组织病理学检查和流式细胞术实验;其余3 组分别用于免疫组织化学实验、Western 印迹实验和透射电镜实验。
CRS 组:按上述方法建立CRS 模型,每日束缚6 h,按照束缚时间分为1 d、7 d、14 d 和21 d 组。1 d、7 d、14 d 每组30 只大鼠,均随机分为3 组,每组10 只,分别用于免疫组织化学实验、Western 印迹实验和透射电镜实验,其中1 组同时行高架十字迷宫实验和肾上腺组织病理学检查。21 d组有40只大鼠,随机分为4组,每组10 只,其中1 组每日称体质量,并行高架十字迷宫实验、肾上腺组织病理学检查及流式细胞术实验;其余3 组分别用于免疫组织化学实验、Western 印迹实验和透射电镜实验。
1.3.2 高架十字迷宫实验
各组大鼠于建模完成后24 h 检测行为学改变。高架十字迷宫视频分析系统包含2 个开臂(50 cm×15 cm)和2 个闭臂(50 cm×15 cm×40 cm),均用黑色树脂玻璃制造,距离地面50 cm。大鼠被放置在开臂与闭臂交叉点处朝向其中一个开臂方向,视频分析系统监测时间为5 min。监测指标:(1)进入开臂的次数;(2)进入开臂的时间;(3)进入闭臂的次数;(4)进入闭臂的时间;(5)总运动距离;(6)总进臂次数。
行为学评价指标包括:(1)进入开臂次数百分比=进入开臂的次数/总进臂次数;(2)开臂停留时间百分比=进入开臂的时间/总进臂时间;(3)总运动距离;(4)总进臂次数=进入开臂的次数+进入闭臂的次数。
本研究通过监测大鼠开臂停留时间百分比[开臂停留时间/(开臂停留时间+闭臂停留时间)]和进入开臂次数百分比[进入开臂的次数/(进入开臂的次数+进入闭臂的次数)]来评价其焦虑行为,开臂停留时间百分比和进入开臂次数百分比越低,提示动物越焦虑;应用总进臂次数和总运动距离评价大鼠自发运动功能。
1.3.3 ELISA 检测大鼠血清下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)相关激素的浓度
各组大鼠于束缚后进行行为学实验,并常规称体质量。用4%戊巴比妥钠溶液以50 mg/kg 腹腔注射麻醉,经腹主动脉取血5 mL,加入乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)抗凝管中,4 ℃下以12 000×g离心15 min,留取上清液检测血清促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)和皮质醇的浓度。
将ELISA 试剂盒内试剂置于室温平衡30 min,将浓缩洗涤液用蒸馏水按1∶20 的体积比稀释后,混匀备用。将酶标板取出,设1 个空白对照孔,孔中不加任何液体;每个标准孔均设1 个复孔,每孔加入相应的标准品50 μL;其余各孔直接加入血液标本离心后的上清液50 μL。除空白对照孔外,每孔加入酶结合物50 μL,再按同样顺序加入抗体50 μL,充分混匀,密封,37 ℃孵育2 h。加入显色剂A 液50 μL 和显色剂B液50 μL,显色15 min 后终止显色,使用Infinite F200型多功能酶标仪读数,选取波长为450 nm,先用空白对照孔调零点,然后测定各标准孔和待测样品孔的光密度值,根据标准品的光密度值绘制浓度标准曲线,根据标准曲线计算待测样品的浓度。
1.3.4 肾上腺的病理学检查
大鼠腹主动脉取血后,随即冰上断头取脑,参照大鼠脑立体定位图谱[10]标记杏仁核位置,快速分离双侧杏仁核组织,放入微量离心管中标记后投入液氮中,迅速冷冻后置于-80 ℃留存。同时快速分离双侧肾上腺组织。
生理盐水冲洗肾上腺组织并用擦镜纸吸干水分后称质量,之后常规中性甲醛固定、乙醇脱水、二甲苯透明、石蜡包埋,常规切取5 μm 厚石蜡切片,行HE 染色后观察。
1.4 CRS 大鼠杏仁核的改变
1.4.1 免疫组织化学法检测GR、GFAP 的表达
大鼠经左心室用中性甲醛行全身灌注固定后开颅取脑,参照大鼠脑立体定位图谱[10]用自制脑模具切取脑组织(矢状面,距离前囟-1.80~-3.30 mm),常规固定、脱水、石蜡包埋后制片。采用免疫组织化学SP三步法检测GR 和GFAP 的表达,以1×磷酸盐缓冲液(phosphate buffer saline,PBS)代替GR 或GFAP 抗体作阴性对照。一抗用一抗稀释液按体积比稀释,稀释浓度分别为GR(1∶200)、GFAP(1∶1 500),二抗为通用型SAP 试剂盒。
GR 和GFAP 阳性产物为棕黄色颗粒,均位于细胞质。在每只大鼠脑切片标本中随机抽取5 张进行染色,每张切片随机观察10 个高倍镜视野。GFAP 的表达情况根据阳性细胞百分比进行分析,GR的表达情况以阳性细胞百分比和染色强度的乘积进行评分分析。
阳性细胞百分比=阳性细胞数/总细胞数×100%。评分标准:0分,无阳性细胞;1分,阳性细胞百分比<10%;2 分,10%<阳性细胞百分比<50%;3 分,50%<阳性细胞百分比<75%;4 分,阳性细胞百分比>75%。
阳性细胞染色强度评分标准:0 分,阴性;1 分,弱阳性;2 分,中等强度阳性;3 分,强阳性。
1.4.2 Western 印迹法检测杏仁核GR、GFAP 的表达
杏仁核组织标本用眼科剪剪碎后加入约5 倍体积的裂解液,用玻璃研磨器将组织块研碎,冰上裂解30 min,4 ℃下高速离心(14 000×g,20 min),上清液即为杏仁核组织的总蛋白溶液。应用BCA 蛋白浓度测定试剂盒进行蛋白质定量,根据标准曲线计算总蛋白溶液的蛋白浓度。将蛋白样品配平后等量分装,置于-80 ℃低温冰箱保存。电泳分离蛋白质并转膜,转膜完毕后,将聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜取出并放入TBST 中浸泡5 min,用TBST 配制的5%脱脂奶粉于37 ℃恒温封闭2 h。加入用5%脱脂奶粉稀释的抗GR 抗体(体积比1∶1 000)、抗GFAP 抗体(体积比1∶1 000)和抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(体积比1∶1 000),4 ℃孵育过夜。TBST摇床洗膜3 次,每次20 min,加入用TBST 稀释的辣根过氧化物酶(horseradish peroxidase,HRP)标记的IgG(按体积比1∶5 000 稀释),37 ℃孵育1 h。TBST 避光摇床洗膜3 次,每次25 min,将ECL 检测试剂盒中的A 液和B 液等量混合,滴加于膜上,反应1 min 后对Western印迹法条带进行显影,分析目的条带和GAPDH 条带的光密度比值。
1.4.3 透射电镜观察杏仁核胶质细胞超微结构改变
灌注固定后将大鼠脑组织参照大鼠脑立体定位图谱[10]杏仁核位置分离双侧杏仁核组织(1 mm×1 mm×1 mm),置于4%戊二醛溶液中(4 ℃,避光48 h)用于前固定,随后经过清洗、后固定等常规步骤切成50 nm的超薄切片,电子染色后用透射电镜观察杏仁核细胞凋亡情况。
1.4.4 流式细胞术检测杏仁核细胞凋亡
将大鼠双侧杏仁核组织置于预冷的平皿内,用眼科剪将杏仁核组织剪成1 mm×1 mm×1 mm 的小块,放入已经高压灭菌的200 目不锈钢筛网中,用研磨棒轻轻研磨并用预冷的PBS 液不断冲洗,将研磨后的组织碎片全部冲入小烧杯内,研磨后的组织碎片再次过200 目和400 目不锈钢筛网过滤,将过滤到烧杯内的溶液全部收集到微量离心管中,经离心、清洗、重悬,杏仁核单细胞悬液最终计数调整至1×106/mL,上流式细胞仪检测细胞凋亡率,细胞总凋亡率=早期细胞凋亡率+晚期细胞凋亡率。
1.5 统计分析
用SPSS 17.0 软件(美国IBM 公司)进行统计分析。数据用表示。采用单因素方差分析,使用最小显著性差异(least significant difference,LSD)法对各组均数进行两两比较。检验水准α=0.05。
2 结果
2.1 模型验证结果
2.1.1 大鼠体质量的变化
CRS 组大鼠与相同时间点对照组大鼠体质量相比,差异有统计学意义(P<0.05,表1)。
表1 CRS 对大鼠体质量的影响Tab.1 Effect of CRS on the body weight of rats(n=10,,g)

表1 CRS 对大鼠体质量的影响Tab.1 Effect of CRS on the body weight of rats(n=10,,g)
注:1)与相同时间点对照组相比,P<0.05。
2.1.2 高架十字迷宫实验结果
各组大鼠总进臂次数和总运动距离差异无统计学意义(表2)。与对照组相比,CRS 7 d、14 d、21 d 组大鼠开臂停留时间百分比和进入开臂次数百分比减少(P<0.05)。
表2 CRS 大鼠高架十字迷宫实验结果Tab.2 Elevated plus maze test results of CRS rats (n=10,)

表2 CRS 大鼠高架十字迷宫实验结果Tab.2 Elevated plus maze test results of CRS rats (n=10,)
注:1)与对照组相比,P<0.05。
2.1.3 ELISA 检测各组大鼠血清CRH、ACTH 和皮质醇浓度的改变
与对照组相比,CRS 7 d、14 d 和21 d 组大鼠血清CRH 水平升高,CRS 21 d 组大鼠血清ACTH 水平升高,CRS 14 d、21 d 组大鼠血清皮质醇水平升高(P<0.05,表3)。
表3 CRS 对大鼠血清CRH、ACTH、皮质醇质量浓度的影响Tab.3 Effects of CRS on CRH,ACTH,cortisol concentration in rats plasma(n=10,,ng/mL)

表3 CRS 对大鼠血清CRH、ACTH、皮质醇质量浓度的影响Tab.3 Effects of CRS on CRH,ACTH,cortisol concentration in rats plasma(n=10,,ng/mL)
注:1)与对照组相比,P<0.05。
2.1.4 大鼠肾上腺的组织病理学变化
与对照组大鼠相比,CRS 7 d、14 d、21 d 组大鼠肾上腺质量增加(P<0.05)。两两比较结果显示,CRS 7 d和14 d 组相比差异无统计学意义(P>0.05),7 d 和14 d组与21 d 组相比差异均有统计学意义(P<0.05,表4)。光镜下见肾上腺皮质显著增宽(图1)。
表4 CRS 对大鼠肾上腺质量的影响Tab.4 Effect of CRS on the adrenal weight of rats(n=10,,g)
表4 CRS 对大鼠肾上腺质量的影响Tab.4 Effect of CRS on the adrenal weight of rats(n=10,,g)
注:1)与对照组相比,P<0.05;2)与CRS 21 d 组相比,P<0.05。
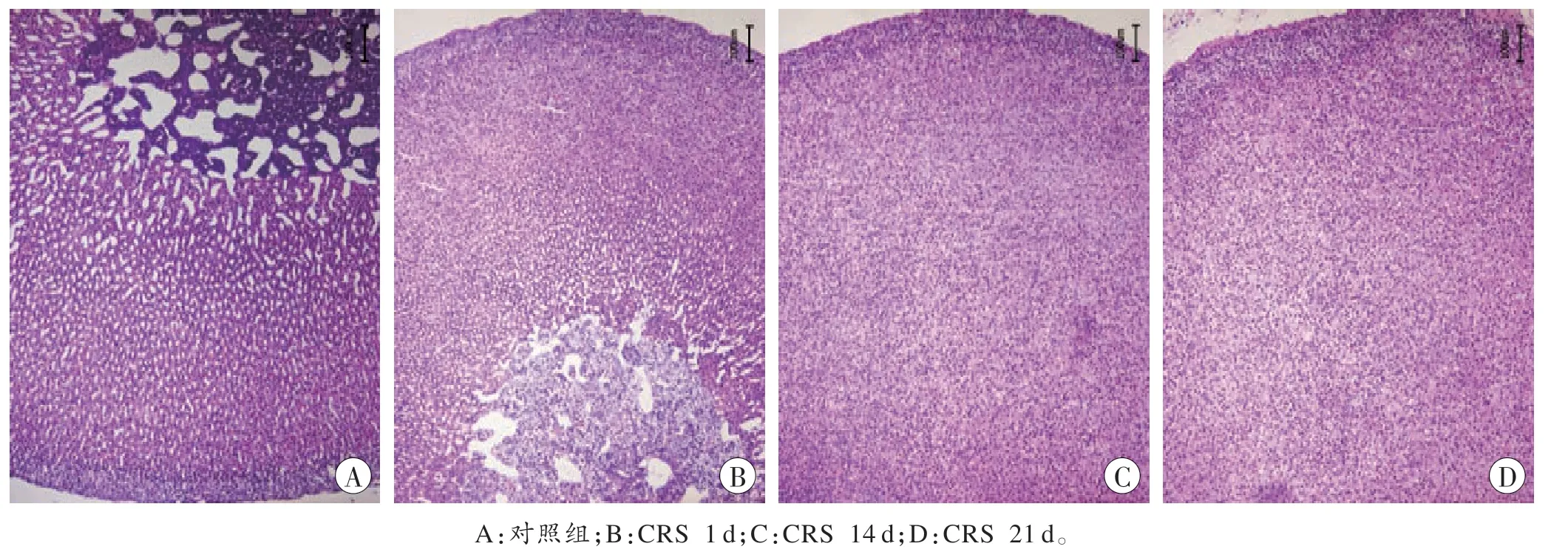
图1 对照组和CRS 组大鼠肾上腺的形态变化(HE×100)Fig.1 The morphological changes of rats adrenal in control and CRS groups(HE×100)
2.2 CRS 大鼠杏仁核改变情况
2.2.1 免疫组织化学法检测GR 和GFAP 在大鼠杏仁核的表达
GR 和GFAP 的阳性信号均定位于细胞质(图2)。与对照组相比,CRS 14 d、21 d 组大鼠杏仁核GR 表达逐渐增加,而GFAP 在CRS 7 d、14 d、21 d 组杏仁核的表达降低(P<0.05,表5)。
表5 免疫组织化学法检测大鼠杏仁核GR和GFAP的表达Tab.5 The expression of GR and GFAP in rats amygdala by immunohistochemistry(n=10,)

表5 免疫组织化学法检测大鼠杏仁核GR和GFAP的表达Tab.5 The expression of GR and GFAP in rats amygdala by immunohistochemistry(n=10,)
注:1)与对照组相比,P<0.05。

图2 GFAP 和GR 在大鼠杏仁核的表达(SP×400)Fig.2 The expression of GFAP and GR in rats adrenal(SP×400)
2.2.2 Western 印迹法检测GR 和GFAP 在大鼠杏仁核的表达
Western 印迹法检测结果显示,与对照组相比,CRS 7 d、14 d、21 d 组大鼠杏仁核GR 的表达明显增加,而GFAP 的表达明显降低(P<0.05,表6)。
表6 Western印迹法检测大鼠杏仁核GR和GFAP的表达Tab.6 The expression of GR and GFAP in rats amygdala by Western blotting(n=10,)
表6 Western印迹法检测大鼠杏仁核GR和GFAP的表达Tab.6 The expression of GR and GFAP in rats amygdala by Western blotting(n=10,)
注:1)与对照组相比,P<0.05。
2.2.3 各组大鼠杏仁核胶质细胞超微结构的变化
透射电镜观察结果显示,CRS 组大鼠杏仁核胶质细胞呈现不同程度的损伤性变化,包括细胞水肿,核周隙增宽,线粒体嵴和膜融合,糙面内质网颗粒融合并脱颗粒,染色质边集,核固缩(图3)。
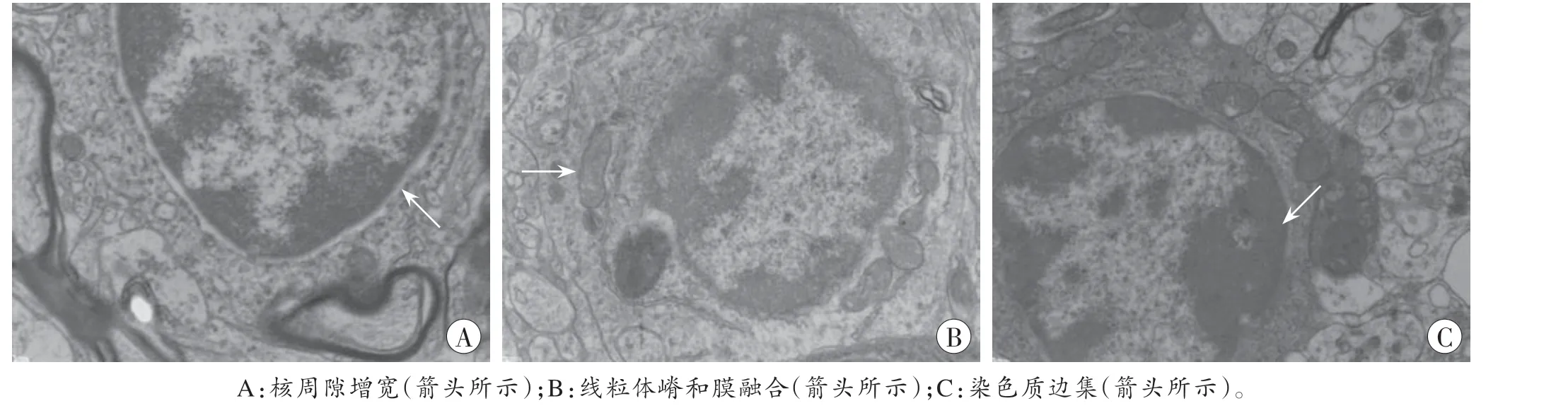
图3 大鼠杏仁核胶质细胞超微结构的变化(×15 000)Fig.3 Ultrastructural changes of glial cells in rats amygdala
2.2.4 大鼠杏仁核细胞凋亡情况
流式细胞术检测结果显示,与对照组(19.30±3.29)相比,CRS 21 d 组(30.27±2.00)杏仁核细胞凋亡率增加(P<0.05,图4)。
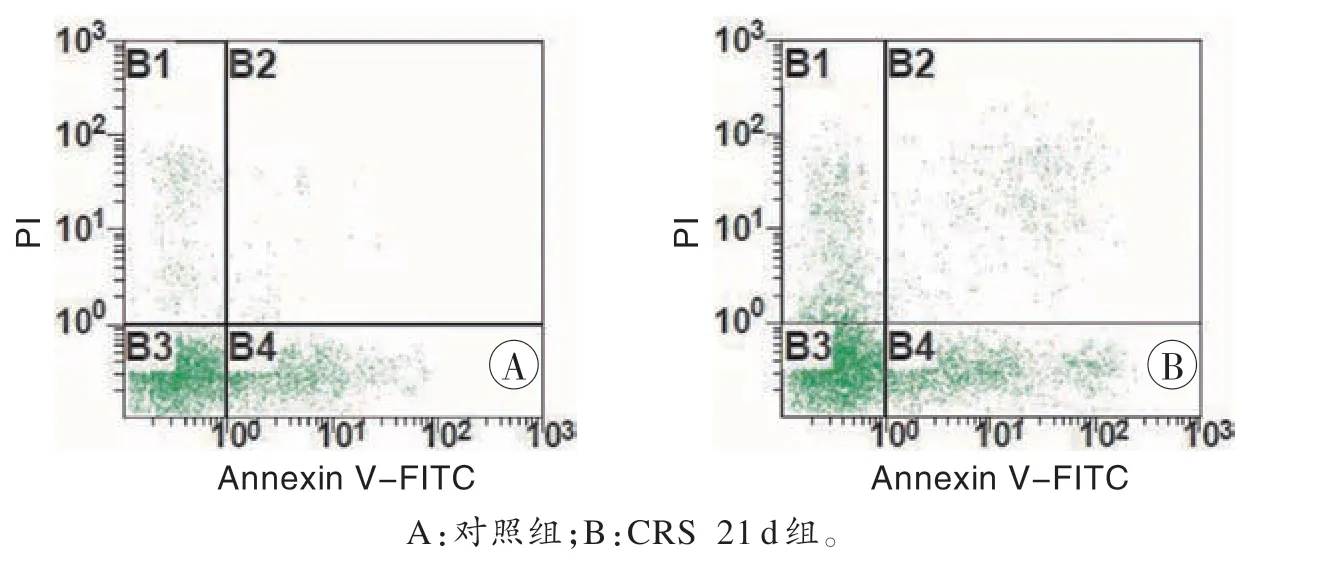
图4 大鼠杏仁核细胞凋亡情况Fig.4 Apoptosis of rats amygdala
3 讨论
慢性应激作为心理性应激原可以导致机体学习、认知和情绪障碍。随着应激相关神经科学研究的深入,CRS 动物模型应运而生。本研究按照WANG 等[9]的方法建立的大鼠CRS 模型是一种良好的心理应激模型,通过限制大鼠胸腹部的方式可较好地模拟刑讯逼供和虐待等实际检案中遇到的长时间束缚或限制体位的情形,可重复性好。
本研究结果显示,对照组大鼠体质量逐渐增加,而CRS 组大鼠体质量增长缓慢,各CRS 组大鼠的体质量与相同时间点对照组大鼠相比差异具有统计学意义,提示CRS 可以延缓大鼠体质量增长。分析CRS 延缓体质量增长的原因可能有以下几种:(1)应激状态下大鼠的焦虑状态导致活动增加、能量代谢增加,即消耗增加;(2)应激状态下大鼠进食和进水量减少;(3)血液中升高的皮质醇会影响机体代谢,包括抑制蛋白质合成,促进蛋白质及脂肪分解并转变成糖,同时还会影响糖代谢,包括促进糖原异生和糖原合成,抑制糖的有氧氧化和无氧酵解,使血糖来路增加、去路减少,升高血糖[11-12]。
HPA 是主要的应激反应标志轴之一,由下丘脑的室旁核、垂体及肾上腺皮质组成。在生理状态下,HPA 激活有利于机体保持内环境稳态。慢性应激时,下丘脑分泌CRH,CRH 进入垂体柄特化了的门脉循环中,从这里到达垂体前部,引起促ACTH 释放,ACTH到达肾上腺皮质,引起糖皮质激素(在啮齿类动物主要是皮质醇)分泌增加。正常生理状态下,糖皮质激素通过与其上游组织受体结合负反馈调节HPA 活性。本研究CRS 14 d 组和CRS 21 d 组大鼠血清皮质醇水平明显增加,提示本实验的CRS 强度能够导致HPA 功能紊乱,表现为HPA 功能亢进。
除了检测外周血激素的变化,本研究进一步观察了肾上腺的组织病理学改变。肾上腺是由两个内分泌器官组成的复合体,一个为来自中胚层的皮质,另一个为来自外胚层的髓质。肾上腺皮质占肾上腺体积的80%~90%,根据其皮质细胞的形态结构和排列特征可以分为球状带、束状带和网状带,均受ACTH 的影响[13]。肾上腺皮质球状带主要分泌盐皮质激素;束状带和网状带分泌糖皮质激素和性激素。束状带细胞大且具有明显的包膜,排列成双排细胞条索;网状带细胞排列紊乱,细胞小且具有颗粒状嗜酸性胞质[13]。本研究发现,CRS 组大鼠肾上腺质量增加、功能代谢增强,形态学表现为肾上腺皮质增厚,主要为束状带和网状带细胞的增生。此外,在肾上腺形态发生变化的同时,CRS 组大鼠伴有血清皮质醇水平明显升高,提示本研究的CRS 强度可以引起大鼠比较强烈的应激反应。
高架十字迷宫实验是公认的评价啮齿类动物焦虑反应的实验方法,简单易操作,可重复性好,可以直观地反映啮齿类动物的焦虑状态。本研究通过监测大鼠进入开臂的次数和开臂内停留的时间来评价其焦虑行为,发现CRS 大鼠自7 d 开始出现焦虑样症状,表现为进入开臂次数百分比和开臂停留时间百分比减少。本研究结果显示,CRS 模型可以作为应激原引起大鼠出现焦虑样行为学改变。糖皮质激素对于维持生存至关重要,但是持续增高也会产生不利的影响,包括出现情绪改变和高血糖等[14]。本研究实验中CRS 组大鼠血清皮质醇水平升高并伴随异常行为学改变,提示大鼠异常行为学改变可能与血清中升高的皮质醇相关。
应激模型公认的评价指标包括行为学水平的检测指标和内分泌水平的检测指标。行为学指标是以动物的自发行为为基础,能够反映动物整体的行为学变化,但较为主观,本研究应用高架十字迷宫视频分析系统评价大鼠行为学改变,结果相对客观;内分泌指标能够反映动物整体激素水平的变化。本研究结果显示,CRS 大鼠体质量增加,肾上腺质量增加,肾上腺皮质增厚,且大鼠出现了明显的焦虑样行为学改变,同时,血中CRH、ACTH 和皮质醇水平明显增加,各项评价指标结果提示本研究大鼠CRS 模型建模成功。
适度的应激对机体学习和认知是有利的,但是慢性应激则会引起应激相关性神经精神紊乱[15]。杏仁核是参与情感、认知形成的脑区,杏仁核功能障碍与抑郁症和焦虑症等精神疾病的发病相关[16]。重度抑郁患者除了情绪和生理的改变,还表现出边缘系统的神经解剖学改变,如影像学显示的杏仁核体积变化等[17]。此外,抑郁动物模型研究[18]发现,杏仁核会出现结构和功能的缺陷,如神经元树突改变及活性变化等。研究[19]结果显示,海马、杏仁核和前额叶皮质等边缘系统含有丰富的GR,糖皮质激素可以通过与受体的结合活化上述脑区,参与人类和啮齿类动物的情绪调节。强烈的慢性应激会引起认知损害及精神神经功能障碍性疾病,如抑郁和创伤后应激障碍(posttraumatic stress disorder,PTSD)等,机制与应激引起的糖皮质激素释放和GR 激活有关[20]。本研究发现,CRS 14 d 组大鼠血中皮质醇水平升高,杏仁核GR 表达明显增加。糖皮质激素具有亲脂特征,可以穿过细胞膜并激活两种细胞内受体,即GR 和盐皮质激素受体(mineralocorticoid receptor,MR)。MR 对糖皮质激素具有高亲和力(为GR 的10 倍),在基础水平,糖皮质激素主要与MR 结合,应激时糖皮质激素水平明显增高,GR 才被激活。GR、MR 在脑内无处不在,包括神经元和胶质细胞,尤其在海马和杏仁核水平更高,这两个部位在应激、恐惧、威胁时发挥重要作用[21]。
胶质细胞占据了脑内细胞成分的1/2,其中星形胶质细胞是数量最多的胶质细胞,且分布最广。星形胶质细胞在维持正常神经系统功能方面发挥了重要作用,如神经递质传递、新陈代谢、抗氧化应激、抗感染和维持中枢神经系统内稳态[22-24]。有研究[25-26]结果显示,星形胶质细胞凋亡参与了许多中枢神经损伤性及退行性病变(如重度抑郁、帕金森病和阿尔茨海默病等)的发生发展。GFAP 是星形胶质细胞的特异性标志物,属于细胞结构蛋白。有研究[27]表明,神经精神相关性疾病(如焦虑、抑郁)患者海马、前额叶皮质GFAP 阳性细胞数目减少,GFAP 蛋白表达降低。本研究发现,CRS 大鼠杏仁核GFAP 表达降低,GFAP 阳性细胞数目明显较少,同时透射电镜结果发现杏仁核内胶质细胞出现早期凋亡改变,包括细胞水肿,核周隙增宽,线粒体嵴和膜融合,糙面内质网颗粒融合并脱颗粒,染色质边集,核固缩等。本研究所有指标,包括大鼠体质量,血清激素水平,肾上腺形态及质量,GR 和GFAP 的表达,均在21 d 发生了明显变化,流式细胞术检测结果发现CRS 21 d 组大鼠杏仁核细胞凋亡率明显增加。上述研究结果证实,CRS 可能引起细胞凋亡。研究[28]显示,星形胶质细胞与神经可塑性密切相关,星形胶质细胞损伤很可能与CRS 大鼠焦虑样行为学改变相关。
本研究成功建立了大鼠CRS 模型:整体水平上,CRS 大鼠出现了焦虑样行为学改变,血清糖皮质激素水平升高;组织学水平,大鼠杏仁核GFAP 阳性细胞数目显著减少,杏仁核细胞凋亡率明显增加,杏仁核胶质细胞出现了损伤性的超微结构改变。由此推测,糖皮质激素很可能通过GR 作用于杏仁核星形胶质细胞导致杏仁核功能紊乱,这将在后续研究中加以证实。
