茯苓多糖对2型糖尿病大鼠丝裂原激活的蛋白激酶通路及胰岛素抵抗的影响
2022-11-21李乔张博
李乔,张博
作者单位:中国中医科学院广安门医院南区内分泌科,北京 102618
胰岛素是体内唯一可降血糖的激素,胰岛素抵抗(IR)是指胰岛素促进葡糖摄取和利用率下降,导致机体代偿性分泌过多,是2型糖尿病(T2DM)发病过程的中心环节,但关于IR发生机制尚不明确[1-2]。临床常用二甲双胍(MET)及噻唑烷二酮类等药物改善IR和降低血糖[3-4]。近来研究显示,一些中药可明显改善IR,茯苓为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf的干燥菌核,单独或与其他草药联合使用,具有抗肿瘤、抗病毒和抗氧化应激等作用,可用于治疗糖尿病及癌症等,其有效成分为茯苓多糖(PAC)[5-6],但关于PAC对T2DM IR的影响尚鲜有研究。因此2019年3—10月,本研究拟初步探究PAC对IR的影响及可能机制,以期为临床IR治疗研究提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF雄性SD大鼠,周龄范围7~8周,体质量范围200~220 g,购自南京君科生物工程有限公司(动物合格证号110322211100491580)。所有大鼠饲养在中国中医科学院中药研究所[SYXK(京)2020-0042],于12 h/12 h光照/黑暗循环、温度(23±1)℃、湿度为45%~55%的空调房间内进行常规饲料喂养,自由饮水。本研究符合一般动物实验伦理学原则。
1.1.2 药品与试剂PAC(货号SP8930,纯度≥90.0%)购自北京索莱宝科技有限公司,盐酸二甲双胍肠溶胶囊(批号H20103017)购自北京协和药厂;链脲佐菌素(STZ)(货号111607-200301),纯度>98%,购自Sigma公司;兔源一抗anti-磷酸化p38丝裂原激活的蛋白激酶(p-p38MAPK)(货号PA5-110135)、磷酸化c-Jun氨基末端激酶(p-JNK)(货号44-682G)、anti-JNK(货号44-690G),鼠源anti-p38 MAPK(货号AHO1202)、anti-GAPDH抗体(货号AM4300),二抗羊抗鼠IgG(批号B-2752)、羊抗兔IgG(A32731)均 购自美 国Invitrogen公 司。日立7600全自动生化仪;雅培安妥Optium Xceed血糖/血酮仪;MODEL550酶标仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 造模及分组 参照Barrière等[7]文献方法采用高脂饲料结合腹腔注射STZ(65 mg/kg)制备T2DM大鼠模型,1周后尾静脉采血测得空腹血糖≥16.7 mmol/L、体质量无明显降低者为模型成功。按照随机数字表法分为五组:T2DM组(灌胃等量生理盐水)、二甲双胍(MET)(0.65 mg·kg-1·d-1)组、PAC低(PAC-L,0.05 mg·kg-1·d-1)、中(PAC-M,0.10 mg·kg-1·d-1)、高剂量(PAC-H,0.20 mg·kg-1·d-1)组[8],每组12只。另取12只正常喂养非T2DM大鼠为正常对组(NC组,灌胃等量生理盐水),干预8周。给药结束后,处死各组大鼠,腹主动脉采血,分离血清;另取肝脏组织置于液氮中保存备用。
1.2.2 血清生化指标检测 采用全自动生化仪检测各组大鼠空腹血糖、血清三酰甘油含量,采用放射性免疫法检测空腹血清胰岛素(FINS)含量,并计算胰岛素抵抗指数(HOMA-IRI)及胰岛素敏感指数(ISI),其中HOMA-IRI=空腹血糖×FINS/22.5,ISI=1/(空腹血糖×FINS)。
1.2.3 肝脏氧化应激指标水平检测 制备各组小鼠肝脏组织匀浆上清液,采用比色法测定谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)及丙二醛活性,具体步骤严格按照试剂盒说明书进行。
1.2.4 肝脏组织MAPK通路相关及其磷酸化蛋白表达水平检测 采用蛋白印迹法检测各组大鼠肝脏组织中p-p38MAPK、p-JNK蛋白表达。取适量提取的各组大鼠肝脏组织总蛋白样品进行SDS-PAGE电泳变性,转至PVDF膜,脱脂奶粉封闭,依次添加一抗anti-p-p38 MAPK(稀释比1∶1 000)、p38 MAPK(稀释比1∶1 000)、anti-p-JNK(稀释比1∶1 000)、an⁃ti-GAPDH(稀释比1∶500)4℃孵育过夜,添加二抗IgG(稀释比1∶5 000)室温孵育1 h,显色、曝片,用Image J软件对蛋白条带灰度值进行定量分析。
1.3 统计学方法采用SPSS 25.0统计软件进行数据处理,计量资料以±s表示,多组间比较采用单因素方差分析,进一步多组间的两两比较采用SNKq检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PAC对T2DM大鼠血清生化指标的影响与NC组比较,T2DM组大鼠血清空腹血糖、FINS、三酰甘油含量显著升高(P<0.05);与T2DM组比较,MET组大鼠血清空腹血糖、FINS、三酰甘油含量显著降低(P<0.05),PAC-L组、PAC-M组、PAC-H组大鼠血清空腹血糖、FINS、三酰甘油含量显著降低,且呈剂量依赖性(P<0.05),其中PAC-M组优于MET组(P<0.05)。见表1。
表1 各组大鼠血清生化指标含量的比较/(mmol/L,±s)

表1 各组大鼠血清生化指标含量的比较/(mmol/L,±s)
注:FINS为空腹血清胰岛素。①与NC组比较,P<0.05。②与T2DM组比较,P<0.05。③与MET组比较,P<0.05。④与PAC-L组比较,P<0.05。⑤与PAC-M组比较,P<0.05。
组别NC组T2DM组MET组PAC-L组PAC-M组PAC-H组F值P值鼠数12 12 12 12 12 12空腹血糖5.08±0.29 12.35±1.27①7.49±0.52①②7.54±0.53①②6.71±0.49①②③④5.93±0.36②③④⑤178.59<0.001 FINS 25.61±3.17 95.48±9.82①86.59±8.32①②88.37±8.25①②71.28±7.03①②③④56.93±4.89①②③④⑤154.48<0.001三酰甘油0.64±0.07 1.69±0.24①1.39±0.14①②1.43±0.13①②1.13±0.11①②③④0.92±0.08①②③④⑤88.97<0.001
2.2 PAC对T2DM大鼠胰岛素敏感性的影响与NC组比较,T2DM组大鼠HOMA-IRI水平显著升高,ISI水平显著降低(P<0.05);与T2DM组比较,MET组大鼠HOMA-IRI水平降低,ISI水平显著升高(P<0.05),PAC-L组、PAC-M组、PAC-H组大鼠HOMAIRI水平降低,ISI水平显著升高,且呈剂量依赖性(P<0.05)。其中PAC-M组优于MET组(P<0.05)。见表2。
表2 各组大鼠胰岛素敏感性的比较/±s

表2 各组大鼠胰岛素敏感性的比较/±s
注:HOMA-IRI为胰岛素抵抗指数,ISI为胰岛素敏感指数。①与NC组比较,P<0.05。②与T2DM组比较,P<0.05。③与MET组比较,P<0.05。④与PAC-L组比较,P<0.05。⑤与PAC-M组比较,P<0.05。
组别NC组T2DM组MET组PAC-L组PAC-M组PAC-H组F值P值鼠数12 12 12 12 12 12 HOMA-IRI 5.81±1.05 62.56±5.11①47.73±4.42①②49.47±4.56①②31.14±3.03①②③④26.59±2.16①②③④⑤360.78<0.001 ISI/×10-3 7.69±0.14 0.86±0.05①1.53±0.09①②1.51±0.11①②2.14±0.12①②③④3.73±0.15①②③④⑤5 851.02<0.001
2.3 PAC对T2DM大鼠肝组织氧化应激的影响与NC组比较,T2DM组大鼠肝脏组织GSH-Px、SOD活性降低,丙二醛含量升高(P<0.05);与T2DM组比较,MET组大鼠肝脏组织GSH-Px、SOD活性升高,丙二醛含量降低(P<0.05),PAC-L组、PAC-M组、PACH组大鼠肝脏组织GSH-Px、SOD活性升高,丙二醛含量降低,且呈剂量依赖性(P<0.05)。其中PAC-H组优于MET组(P<0.05)。见表3。
表3 各组大鼠氧化应激指标水平的比较/±s
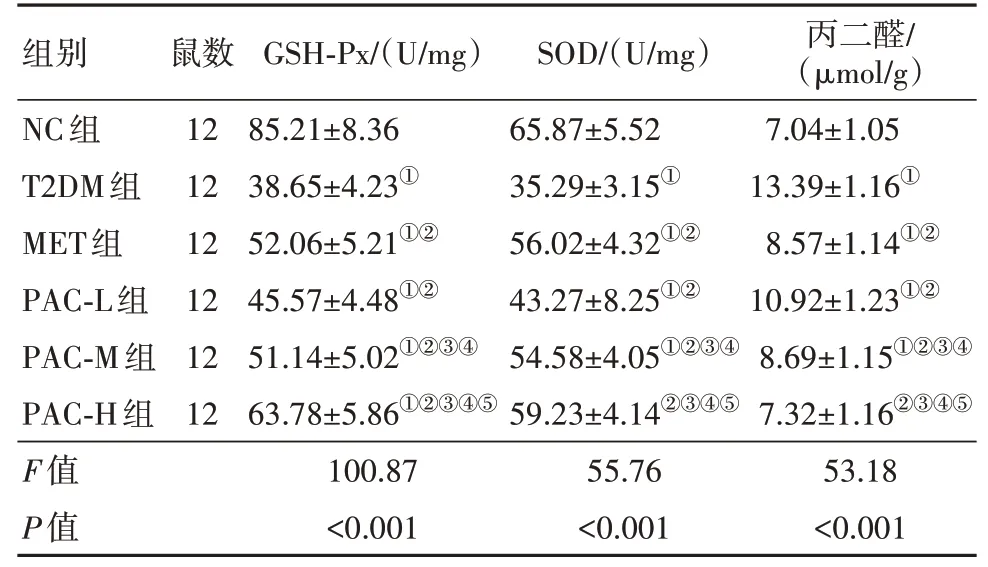
表3 各组大鼠氧化应激指标水平的比较/±s
注:GSH-Px为谷胱甘肽过氧化物酶,SOD为超氧化物歧化酶。①与NC组比较,P<0.05。②与T2DM组比较,P<0.05。③与MET组比较,P<0.05。④与PAC-L组,P<0.05。⑤与PAC-M组,P<0.05。
组别NC组T2DM组MET组PAC-L组PAC-M组PAC-H组F值P值鼠数12 12 12 12 12 12 GSH-Px/(U/mg)85.21±8.36 38.65±4.23①52.06±5.21①②45.57±4.48①②51.14±5.02①②③④63.78±5.86①②③④⑤100.87<0.001 SOD/(U/mg)65.87±5.52 35.29±3.15①56.02±4.32①②43.27±8.25①②54.58±4.05①②③④59.23±4.14②③④⑤55.76<0.001丙二醛/(μmol/g)7.04±1.05 13.39±1.16①8.57±1.14①②10.92±1.23①②8.69±1.15①②③④7.32±1.16②③④⑤53.18<0.001
2.4 PAC对T2DM大鼠肝组织MAPK通路相关蛋白表达的影响与NC组比较,T2DM组大鼠肝脏组织p-p38MAPK、p-JNK蛋白水平显著升高(P<0.05);与T2DM组比较,MET组大鼠肝脏组织p-p38MAPK、p-JNK蛋白水平显著降低(P<0.05),PAC-L组、PACM组、PAC-H组大鼠肝脏组织p-p38MAPK、p-JNK蛋白水平降低,且呈剂量依赖性(P<0.05)。其中PACM组优于MET组(P<0.05)。见图1,表4。

图1 蛋白质印迹法检测各组大鼠肝脏组织p-p38MAPK、p-JNK蛋白水平的表达
表4 各组大鼠肝脏组织p-p38MAPK、p-JNK蛋白水平的比较/±s

表4 各组大鼠肝脏组织p-p38MAPK、p-JNK蛋白水平的比较/±s
注:p-p38MAPK为磷酸化p38丝裂原激活的蛋白激酶,p-JNK为磷酸化c-Jun氨基末端激酶。①与NC组比较,P<0.05。②与T2DM组比较,P<0.05。③与MET组比较,P<0.05。④与PAC-L组,P<0.05。⑤与PAC-M组,P<0.05。
组别NC组T2DM组MET组PAC-L组PAC-M组PAC-H组F值P值鼠数12 12 12 12 12 12 p-p38MAPK 0.16±0.03 1.35±0.08①0.87±0.04①②1.04±0.06①②0.89±0.03①②③④0.39±0.02①②③④⑤990.40<0.001 p-JNK 0.17±0.02 1.29±0.08①0.74±0.04①②0.85±0.02①②0.72±0.05①②③④0.31±0.01①②③④⑤1 014.57<0.001
3 讨论
茯苓是我国常用中草药,性平,味甘淡,据《神农百草经》记载其“主胸膈逆气,利小便,久服安魂补神,不饥延年”[9],现代药理学研究表明,PAC是其最主要活性成分,具有降血糖和抗脂质过氧化等作用[10-11]。Chen等[12]研究报道,茯苓可配伍甘草、柑桔、陈皮、半夏、竹节组成温胆汤,经多途径、多通路治疗代谢综合征。黄聪亮等[13]研究报道,PAC可有效降低T2DM小鼠血糖、血清胰岛素及血脂水平,改善T2DM引起的脂质代谢紊乱。本研究采用高脂喂养SD大鼠结合注射STZ建立T2DM大鼠IR模型,与NC组比较,T2DM组大鼠血清空腹血糖、FINS、三酰甘油含量及HOMA-IRI水平显著升高,ISI水平显著降低,符合T2DM基本特征及IR临床特点,提示造模成功。与T2DM组比较,PAC呈剂量依赖性降低空腹血糖、FINS、三酰甘油含量、HOMA-IRI水平,升高ISI水平,提示PAC可能对T2DM大鼠IR具有显著改善作用。
IR是T2DM疾病发生过程中重要特征。肝脏是调节糖、脂代谢等能量调节的主要器官,肝脏IR在机体IR中占重要地位。本研究结果发现,与NC组比较,T2DM组大鼠肝脏组织GSH-Px、SOD活性降低,丙二醛含量升高;与T2DM组比较,PAC可呈剂量依赖性升高大鼠肝脏组织GSH-Px、SOD活性,降低丙二醛含量,提示在IR可引起机体氧化应激,破坏氧化与抗氧化动态平衡,而PCA可调节二者平衡,具有抗氧化应激、改善IR作用,与文献报道一致[14-15]。
肝细胞胰岛素信号转导通路涉及环节众多,其中以MAPK通路、PI3K通路等研究居多。MAPK可分为细胞外信号调节激酶(ERK)、p38、JNK和ERK5 4个亚族,其中p38 MAPK是一种重要应激信号传导蛋白,可被高脂、高糖等多种内源性及(或)外源性信号分子激活[16],抑制p38 MAPK信号转导途径可减轻氧化应激,改善高脂诱导的T2DM小鼠IR[3]。JNK可广泛参与细胞分化和凋亡、胚胎发育、免疫反应及IR等多种生理病理过程[17-18],下调JNK表达可改善IR[19]。本研究结果发现,与NC组比较,T2DM组大鼠肝脏组织p-p38MAPK、p-JNK蛋白水平显著升高;与T2DM组比较,PAC可呈剂量依赖性降低大鼠肝脏组织p-p38MAPK、p-JNK蛋白水平,提示PAC可能通过抑制MAPK通路激活,减轻T2DM氧化应激,改善胰岛素抵抗。
综上所述,PAC可改善T2DM大鼠胰岛素抵抗,该作用可能与其抑制MAPK/p38MAPK、MAPK/JNK通路,减轻氧化应激有关。但关于PAC改善胰岛素抵抗的作用过程是否涉及其他代谢通路,有待进一步深入探究。
