白藜芦醇改善α-突触核蛋白A53T 转基因小鼠运动功能障碍和调节外周免疫的作用研究
2022-11-21冯胜蓝孙晓东谢丽霞叶俊杰覃冰清许倩倩杜凯丽王敏桑明
冯胜蓝,孙晓东,谢丽霞,叶俊杰,覃冰清,许倩倩,杜凯丽,王敏,桑明*
(1.湖北医药学院附属襄阳市第一人民医院转化医学中心,湖北 襄阳 441000;2.湖北省帕金森病临床医学研究中心,湖北 襄阳 441000;3.武当特色中药研究湖北省重点实验室,湖北 十堰 442000)
帕金森病(Parkinson’s disease,PD)也称为震颤麻痹(paralysis agitans),在中老年人群中多发,随着人口老龄化的不断加剧,PD 的发病率不断升高[1]。PD 的主要病理特征为中脑黑质和纹状体处多巴胺(dopamine,DA)能神经元进行性丢失以及α-突触核蛋白(α-synuclein,α-Syn)的积累,临床上伴随典型运动迟缓、静止性震颤等运动功能障碍[2]。 有研究发现,PD 患者的血清及脑脊液中促炎因子IL-6(interleukin-6)、IL-1β 升高,抗炎因子IL-10 降低,说明PD 患者存在神经炎症反应[3]。 PD 患者的外周血中CD3+T 细胞、CD4+T 细胞占比减少,说明PD患者存在免疫调节异常的现象[4]。 目前,PD 的具体发病原因及机制尚不明确,缺乏有效的治疗方法[5]。 白藜芦醇(resveratrol,RES)是一种药食同源的天然多酚类化合物,具有抗炎、抗凋亡、抗氧化及神经保护等作用[6]。 同时,RES 是沉默信息调节器1(silence information regulator 1,SIRT1)的变构激活剂,具有调控自噬作用[7]。 在PD 患者中,SIRT1 的酶活性降低,减弱了其抵抗神经毒素的能力,导致神经炎症发生[8]。 研究表明,RES 在帕金森动物模型中具有神经保护作用[9-11]。 Prnp-SNCA-A53T 转基因小鼠是过表达包含A53T 突变的人源SNCA 基因的PD 模型小鼠,后代纯合子小鼠从8 月龄开始出现进行性运动障碍[12-13]。 该模型很好的模拟帕金森症发病情况,是研究PD 发病机制较理想的小鼠模型。 研究发现RES 对该模型小鼠运动、认知功能和神经病理具有积极改善作用[14-16]。 RES 的上述作用机制尚不明确,因此,本实验以RES 灌胃治疗A53T 转基因小鼠3 个月,研究RES 对该模型小鼠运动功能、T 淋巴细胞亚群和外周炎症因子影响,为应用RES 治疗PD 提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
12 只SPF 级8 月龄A53T 转基因阳性小鼠及12 只同窝转基因阴性小鼠,雄性,体重20 ~ 30 g,本研究所用A53T 转基因小鼠是武汉大学张振涛教授实验室【SCXK(鄂)2019-0004】赠予,在襄阳市第一人民医院转化医学中心动物实验室【SYXK(鄂)2022-0093】扩繁和饲养。 昼夜各半循环照明,环境相对湿度40% ~ 60%,温度控制范围20 ~ 24℃之内,日温差 ≤ 1℃,食物供给充足,按照实验动物使用原则(3R 原则)给予人道主义关怀。 本项目动物实验均通过襄阳市第一人民医院动物伦理委员会审批(2021DW008)。
1.1.2 主要试剂与仪器
白藜芦醇(1602105-100MG,Sigma-Aldrich,美国);IL-6(MM-1011M2)、IL-18(MM-0169M1)、TNFα(MM-0132M2)及TGF-β(MM-45041M2)ELISA 试剂盒(江苏酶免实业有限公司),单抗试剂:APC-Cy7 anti-mouse,Percpcy 5.5 anti-mouse CD3e,FITC antimouse CD4,PE anti-mouse CD8a(BD,美国),SYBR Green PCR Mix(Promega,美国),实验所用引物由湖北省武汉市金开瑞生物工程有限公司合成(武汉),Phospho-alpha-Synuclein(S129) Antibody(PPS091,R&D SYSTEMS, 美 国)。 SpectraMax i3x 酶 标 仪(Molecular Devices,美国);ABI 7500 PCR 仪(Life technology,美国);BD FACS AriaII 流式细胞分析仪(BD,美国);XR501 型大小鼠抓力测定仪(上海欣软信息科技有限公司);XR-6C 型小鼠转棒疲劳仪(上海欣软信息科技有限公司);自备一根直径1 cm、长度50 cm 的表面粗糙的木杆。
1.2 方法
1.2.1 实验设计
8 月龄SPF 级A53T 转基因阳性小鼠12 只,随机分成两组,模型组(PD),模型治疗组(PD +RES);选取同窝转基因阴性小鼠12 只,随机分成两组,对照组(WT),对照治疗组(WT + RES),给药组每3 d 灌胃1 次RES(30 mg/kg),至11 月龄;对照组和模型组每3 d 灌胃等容积生理盐水。 在治疗的4 个时间点(0、1、2、3 月)进行运动行为学测试,治疗终点取小鼠外周血进行T 淋巴细胞亚群和血清炎症因子检测。
1.2.2 荧光定量PCR 检测SNCA 基因表达
剪小鼠尾尖组织,提取小鼠组织DNA。 按SYBR Green 试剂盒说明进行扩增,PCR 体系为20 μL,反应条件:95℃变性15 s,60℃ 30 s,40 个循环。每个样品设3 个复孔,引物序列见表1。 转基因阳性小鼠的基因型是通过使用适当的内源参照基因片段,将每个未知样本的2-ΔΔCt值与已知的纯合子和杂合子对照进行比较确定的。 计算方法如下,将样本差异以内参基因均一化,ΔCt = Ct目的基因-Ct内参基因;然后,将待测样本与对照样本比较得出ΔΔCt,ΔΔCt = ΔCt处理样本-ΔCt对照样本;利用公式计算获得待测样本的RQ 值(倍数变化)= 2-ΔΔCt。

表1 引物列表Table 1 List of primers
1.2.3 免疫组化检测P-α-Syn(S129)蛋白在小鼠中脑组织中的表达
取小鼠中脑脑组织,4%的多聚甲醛固定、石蜡包埋,5 μm 连续切片。 采用免疫组织化学方法检测中脑组织中,P-α-Syn 蛋白的表达。 阳性染色为棕黄色。 首先选择在低倍镜观察整个组织切片,圈定4 个细胞染色清晰、组织结构良好的区域视野,最后选择高倍镜观察。
1.2.4 小鼠行为学测试
(1)爬杆实验:记录小鼠从爬杆顶部爬至杆底的时长,每只小鼠重复3 次,取平均值。 (2)转棒实验:将小鼠置于恒定转速(30 r/min,以正常小鼠3 min 内掉下为标准)的转棒仪上,记录小鼠掉落时所转的总路程,每只小鼠重复3 次,取平均值。 (3)抓力实验:依次将小鼠放于抓力测试仪上,抓住鼠尾,当小鼠前爪在仪器抓杆上抓牢后,以匀速匀力向后拉,待小鼠松爪,记录小鼠前爪最大拉力,每只小鼠重复3 次,取平均值。 (4)下肢抱紧实验:尾根部悬吊小鼠并坚持15 s 后,根据后肢抱紧的严重程度进行评分,进行评分从0 到3 计算:0 = 后肢远离腹部,向外张开;1 = 观察期间一侧下肢部分向腹部内缩回至少50%;2 = 在观察期双下肢部分向腹部内缩回至少50%;3 = 观察期间两后肢完全向腹部内缩少于50%。 评分为0.5 分属正常数值,在连续3 d的3 个独立实验后,取平均值。
1.2.5 外周血T 淋巴细胞及其亚群检测
采用多色抗小鼠单克隆抗体(mAbs)联合试剂APC-Cy7 anti-mouse CD45,Percpcy 5.5 anti-mouse CD3,FITC anti-mouse CD4,PE anti-mouse CD8 和匹配的同型对照,在灌胃RES 治疗3 个月后,取血至EDTA 抗凝小管中,进行抗体染色,PBS 清洗两次后,进行流式细胞术检测,计数1 × 105个细胞。 所有样本均采用BD FACS Aria II 流式细胞仪进行检测,应用Flow J 软件对检测结果进行分析。
1.2.6 外周血血清炎症因子检测
取外周血后,分离血清,-20℃保存,测定前复融,混匀,2000 r/min 转速离心20 min,取上清后按ELISA 试剂盒说明书进行操作。 检测IL-6、IL-18、TNF-α 及TGF-β 表达。
1.3 统计学分析
应用SPSS 24.0 统计学软件对数据进行统计学分析并整理,连续变量用均值表示,计量资料采用平均值 ± 标准差(±s)表示,两组间比较采用独立样本t检验,P< 0.05 为差异具有统计学意义。
2 结果
2.1 帕金森病A53T 转基因小鼠鉴定
荧光定量PCR 检测A53T 转基因阳性小鼠的SNCA 基因鉴定结果如表2 所示;免疫组化检测小鼠中脑中P-α-Syn(S129)蛋白的表达,结果与对照组相比,A53T 小鼠的P-α-Syn 蛋白表达显著增多(图1),表明本实验所用小鼠基因型正确符合要求。
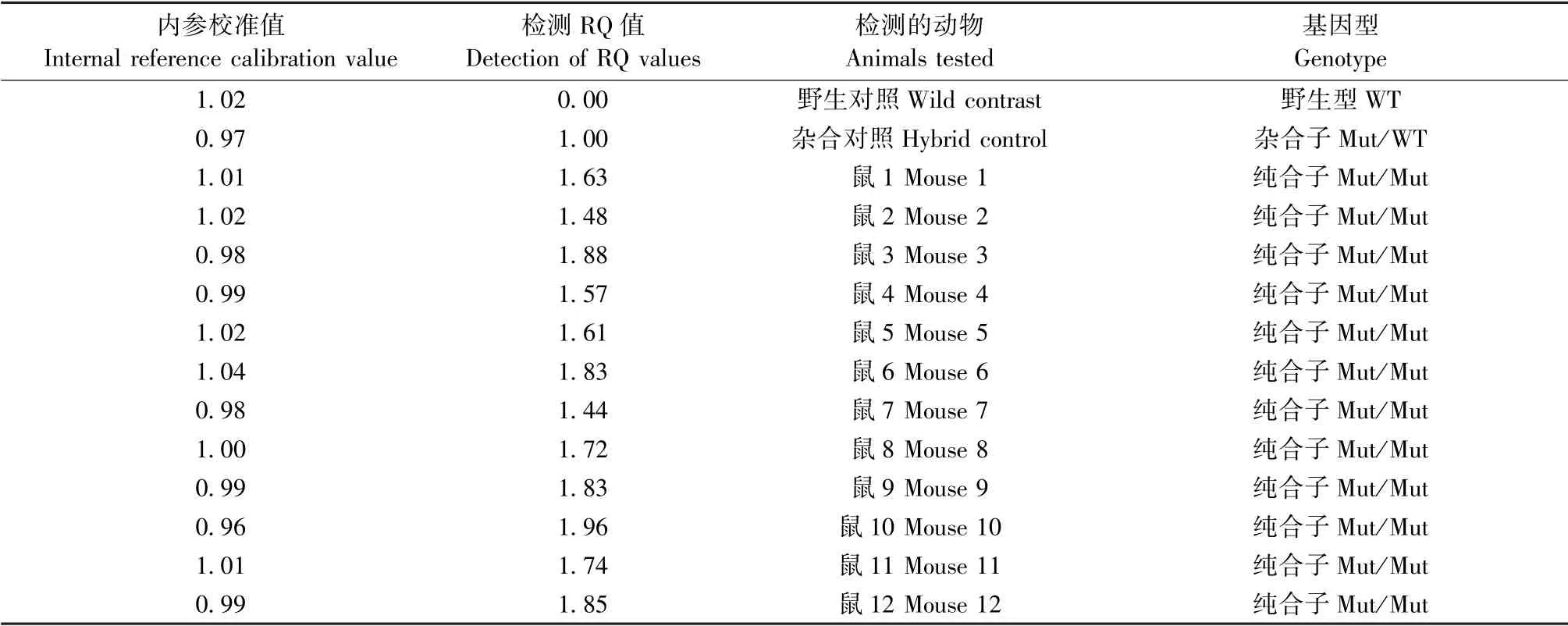
表2 A53T 转基因小鼠SNCA 基因鉴定Table 2 SNCA gene identification in α-Synuclein A53T mice
2.2 RES 对A53T 转基因小鼠运动功能障碍的影响
RES 治疗3 个月后,与模型组相比,模型治疗组小鼠爬杆总时长显著缩短(P< 0.01)(图2A)。 与对照组相比,模型组小鼠前脚抓力显著较小(P<0.05),RES 治疗后,与模型组相比,模型治疗组小鼠前脚抓力显著增加(P< 0.05)(图2B)。 同时,与对照组相比,模型组小鼠转棒总路程显著缩短(P<0.05),RES 治疗后,与模型组相比,模型治疗组小鼠转棒总路程显著延长(P< 0.05)(图2C)。 与对照组相比,对照治疗组爬杆时长,抓力大小以及转棒总路程均不具有统计学意义(图2)。
同时,对小鼠体重进行测量,发现RES 对小鼠体重无显著差异(图3A);与对照组相比,模型组小鼠在尾部悬吊之后表现出下肢抱紧行为,这是神经退行性疾病小鼠模型常见的运动障碍特征;RES 治疗后,与模型组相比,模型治疗组小鼠抱紧行为改善(图3B)。 与对照组相比,模型组小鼠四肢抱紧运动功能评分升高(P< 0.005);RES 治疗后,与模型组相比,模型治疗组小鼠四肢抱紧运动功能评分显著降低(P< 0.01)。 与对照组相比,对照治疗组四肢抱紧运动功能评分无显著性差异(图3C)。
2.3 RES 对A53T 转基因小鼠外周T 淋巴细胞及其亚群影响
流式圈门策略及典型示例见图4 所示。 流式检测结果显示:与对照组相比,模型组T 淋巴细胞占比显著降低,差异具有显著性(P< 0.001);经3 个月RES 灌胃治疗后,与模型组相比,模型治疗组T淋巴细胞占比增加,差异具有统计学意义(P<0.001)(图5A)。 与对照组相比,模型组Th 细胞(CD3+CD4+)占比显著降低,差异具有统计学意义(P< 0.001);与模型组相比,模型治疗组Th 细胞(CD3+CD4+)占比增加,差异具有统计学意义(P<0. 005)(图5C)。 与对照组相比,模型组Tc 细胞(CD3+CD8+)占比差异不具有统计学意义;与模型组相比,模型治疗组Tc 细胞(CD3+CD8+)占比不具有统计学意义(图5B)。 与对照组相比,模型组CD4+/CD8+比值降低,差异具有统计学意义(P<0.05);与模型组相比,模型治疗组CD4+/CD8+比值增加,差异不具有统计学意义(图5D)。 与对照组相比,对照治疗组T 淋巴细胞占比、CD4+T 淋巴细胞占比、CD8+T 淋巴细胞占比及CD4+/CD8+比值均不具有统计学意义(图5)。
2.4 RES 对A53T 转基因小鼠外周血血清炎症因子的影响
与对照组相比,模型组小鼠血清中IL-6、IL-18含量显著增加,差异具有统计学意义(P< 0.005,P< 0.01);经3 个月RES 灌胃治疗后,与模型组相比,模型治疗组小鼠血清中IL-6、IL-18 含量显著减少,差异具有统计学意义(P< 0.001,P<0.05)(图6A,6B)。 在各组间血清TNF-α 含量差异不具有显著性(图6C)。 与对照组相比,模型组小鼠血清TGF-β 含量显著减少,差异具有统计学意义(P< 0.05);与模型组相比,模型治疗组小鼠血清中TGF-β 含量回升,差异不具有统计学意义(图6D)。 与对照组相比,对照治疗组IL-6、IL-18、TNF-α及TGF-β 含量均不具有统计学意义(图6)。
3 讨论
近年来大量研究证实RES 可以减少神经元细胞的凋亡,从而减少神经炎症发生[17]。 RES 作为SIRT1 基因的激活剂,可激活线粒体自噬,减轻DA能神经元中α-Syn 低聚物的形成,保护神经元,从而改善PD 模型大鼠运动障碍[8,18]。 本研究显示,RES缩短A53T 转基因小鼠爬杆时长,降低小鼠四肢抱紧运动功能评分,增加A53T 转基因小鼠转棒路程及前脚抓力,说明应用RES 治疗PD 有较大潜力,这与已有报道一致。
PD 患者普遍存在免疫功能异常,T 淋巴细胞介导的细胞免疫功能减退[19]。 正常情况下,在中枢神经系统中激活的T 淋巴细胞较少出现,当中枢神经系统发生炎症反应时,神经元释放促炎因子(IL-1β、TNF-α 等),改变血脑屏障通透性,从而在中枢神经系统中产生激活的T 淋巴细胞,被激活的T 淋巴细胞会进一步迁移至神经元损伤部位,加速神经炎症的发展[20]。 研究发现,激活的小胶质细胞以及星形胶质细胞会释放IL-6、TNF-α 和IL-1β 等细胞因子,诱导神经炎症的发生,导致DA 能神经元的损伤以及神经元数量减少[21-22]。 以上研究提示,免疫功能的紊乱及神经炎症的发生是PD 病理进展的重要方面。 研究指出,PD 患者外周血中CD3+T 淋巴细胞占比、CD4+T 细胞占比及CD4+/CD8+T 细胞比值与健康对照人群相比显著降低[23],IL-6 作为主要的炎症因子参与炎症反应,是组织损伤程度与炎症反应的重要标志物之一,与健康对照相比,在PD 患者血浆中IL-6 的表达增高[24-25]。 IL-18 作为白细胞介素的重要成员,通过参与CD4+T 细胞的增值与分化过程、增加促炎因子TNF-γ 的产生发挥免疫应答作用[26],最近的研究发现IL-18 可以与小胶质细胞受体结合,加快小胶质细胞的激活,激活的小胶质细胞进一步释放炎性因子,恶性循环的过程导致神经炎症的发生,加速PD 的进展[27]。 同时,研究指出另一种参与免疫调节的重要成员TGF-β,其是具有免疫抑制功能的细胞因子,可以通过对黏附分子的下调作用,参与机体免疫耐受过程。 TGF-β 可刺激T 细胞分化成CD4+CD25+调节性T 细胞(Treg)细胞,分泌IL-10 等抑制性细胞因子维持机体免疫系统的平衡,这也是Treg 细胞发挥免疫抑制功能的重要途径之一[28]。 因此,T 淋巴细胞的免疫调节作用和炎症因子异常释放参与PD 发病进展。
本研究发现A53T 转基因小鼠与野生型小鼠相比,T 淋巴细胞占比、CD4+T 细胞占比、CD4+/CD8+比值均显著降低,说明A53T 转基因小鼠存在免疫功能减退和免疫系统失调。 有研究证实,淋巴细胞占比下降和CD4+T 细胞百分比减少有关[29],这说明A53T 转基因小鼠CD4+T 细胞介导的免疫过程存在异常。 CD4+/CD8+比值可以间接反应机体免疫状态,A53T 转基因小鼠与野生型小鼠相比CD4+/CD8+比值下降,说明A53T 转基因小鼠存在免疫调节异常。 同时,A53T 转基因小鼠与野生型小鼠相比,IL-6、IL-18 表达显著增高,TGF-β 表达降低,一方面说明,A53T 转基因小鼠存在机体内的神经炎症反应;另一方面说明,抗原提呈细胞抗原提呈的过程受到影响,抑制了T 淋巴细胞及CD4+T 细胞增殖与分化,免疫系统的平衡存在紊乱。 RES 治疗后显著增加T 淋巴细胞占比、CD4+T 细胞占比以及CD4+/CD8+比值;显著降低了IL-6、IL-18 炎症因子的表达,说明RES 可改善A53T 转基因小鼠的免疫功能异常。
综上所述,Prnp-SNCA-A53T 转基因小鼠可模拟帕金森病的部分外周免疫异常状态,本研究结果证实RES 可显著改善该模型小鼠的运动功能障碍,通过调节小鼠外周T 淋巴细胞数量和炎症因子水平,使小鼠免疫状态恢复正常。 本研究为RES 在PD 的临床应用提供了实验依据。
参 考 文 献(References)
[ 1] Jankovic J, Tan EK. Parkinson’s disease: etiopathogenesis and treatment [J]. J Neurol Neurosurg Psychiatry, 2020, 91(8):795-808.
[ 2] 霍孝成, 张瑜, 王普清, 等. 帕金森病伴纹状体畸形的研究进展 [J]. 湖北医药学院学报, 2021, 40(4): 437-440.Huo XC, Zhang Y, Wang PQ, et al. Progress in the study of Parkinson’s disease with striatal malformation[J]. J Hubei Univ Med, 2021, 40(4): 437-440.
[ 3] Zhang H, Wu J, Shen FF, et al. Activated Schwann cells and increased inflammatory cytokines IL-1β, IL-6, and TNF-α in patients’ sural nerve are lack of tight relationship with specific sensory disturbances in Parkinson’s disease [J]. CNS Neurosci Ther, 2020, 26(5): 518-526.
[ 4] Hirsch EC, Standaert DG. Ten unsolved questions about neuroinflammation in Parkinson’s disease [J]. Mov Disord,2021, 36(1): 16-24.
[ 5] Rahman MH, Akter R, Bhattacharya T, et al. Resveratrol and neuroprotection: impactand itstherapeutic potential in Alzheimer’ s disease [ J]. Front Pharmacol, 2020, 11(3): 619024.
[ 6] Stacchiotti A, Corsetti G. Natural compounds and autophagy:allies against neurodegeneration [J]. Front Cell Dev Biol, 2020,8(4): 55409.
[ 7] Zhang X, Wan F, You W, et al. Comparison of apoptosis between bovine subcutaneous and intramuscular adipocytes by resveratrol via SIRT1 [J]. Animal Biotechnol, 2020, 31(6):538-546.
[ 8] Li X, Feng Y, Wang XX, et al. The critical role of SIRT1 in Parkinson’s disease: mechanism and therapeutic considerations[J]. Aging Dis, 2020, 11(6): 1608-1622.
[ 9] Khan MM, Ahmad A, Ishrat T, et al. Resveratrol attenuates 6-hydroxydopamine-inducedoxidativedamageanddopamine depletion in rat model of Parkinson’s disease [J]. Brain Res,2010, 13(8): 139-151.
[10] Wang Y, Xu H, Fu Q, et al. Protective effect of resveratrol derived fromPolygonumcuspidatum and its liposomal form on nigral cells in parkinsonian rats [J]. J Neurol Sci, 2011, 304(1-2): 29-34.
[11] Su CF, Jiang L, Zhang XW, et al. Resveratrol in rodent models of Parkinson’ s disease: a systematic review of experimental studies [J]. Front Pharmacol, 2021, 12(7): 644219.
[12] Zhang Z, Kang SS, Liu X, et al. Asparagine endopeptidase cleaves α-synuclein and mediates pathologic activities in Parkinson’s disease [J]. Nat Struct Mol Biol, 2017, 24(8):632-642.
[13] 张旭, 张如意, 陈晨, 等. 二苯乙烯苷对A53T α-突触核蛋白转基因小鼠运动功能和黑质多巴胺能神经元的影响 [J]. 神经疾病与精神卫生, 2017, 17(3): 163-166.Zhang X, Zhang RY, Chen C, et al. Effects of tetrahydroxystilbene glucoside on motor function and dopaminergic neurons in substantia nigra of A53T α-synuclein transgenic mice [J]. J Neurosch Ment Health, 2017, 17(3): 163-166.
[14] Zhang LF, Yu XL, Ji M, et al. Resveratrol alleviates motor and cognitive deficits and neuropathology in the A53T α-synuclein mouse model of Parkinson’s disease [J]. Food Funct, 2018, 9(12): 6414-6426.
[15] 王嫚诗, 张玲, 秦川, 等. α-突触核蛋白A53T 突变损伤小鼠认知功能 [J]. 中国比较医学杂志, 2020, 30(5): 7-13.Wang MS, Zhang L, Qin C, et al. α-synuclein A53T mutation impairs cognitive function in mice [J]. Chin J Comp Med,2020, 30(5): 7-13.
[16] Malpartida AB,Williamson M,Narendra DP,etal.MitochondrialdysfunctionandmitophagyinParkinson’sdisease:from mechanism to therapy [J]. Trends Biochem Sci, 2021, 46(4): 329-343.
[17] Ma S, Fan L, Li J, et al. Resveratrol promoted the M2 polarization of microglia and reduced neuroinflammation after cerebral ischemia by inhibiting miR-155 [J]. Int J Neurosci,2020, 130(8): 817-825.
[18] Wu Y, Li X, Zhu JX, et al. Resveratrol-activated AMPK/SIRT1/autophagy in cellular models of Parkinson’s disease [J].Neurosignals, 2011, 19(3): 163-174.
[19] Schwab AD, Thurston MJ, Machhi J, et al. Immunotherapy for Parkinson’s disease [J]. Neurobiol Dis, 2020, 137: 104760.
[20] Levite M. Dopamine and T cells: dopamine receptors and potent effects on T cells, dopamine production in T cells, and abnormalities in the dopaminergic system in T cells in autoimmune, neurological and psychiatric diseases [J]. Acta Physiol (Oxf), 2016, 216(1): 42-89.
[21] Haque A, Samantaray S, Knaryan VH, et al. Calpain mediated expansion of CD4+cytotoxic T cells in rodent models of Parkinson’s disease [J]. Exp Neurol, 2020, 8 (3): 113-315.
[22] Yang X, Ren H, Wood K, et al. Depletion of microglia augments the dopaminergic neurotoxicity of MPTP [J]. Faseb J,2018, 32(6): 3336-3345.
[23] Bartels T, De Schepper S, Hong S. Microglia modulate neurodegeneration in Alzheimer’ s and Parkinson’ s diseases[J]. Science, 2020, 370(6512): 66-69.
[24] Li N, Wang JX, Huo TT, et al. Associations of IL-1β and IL-6 gene polymorphisms with Parkinson’s disease [J]. Eur Rev Med Pharmacol Sci, 2021, 25(2): 890-897.
[25] Green HF, Khosousi S, Svenningsson P. Plasma IL-6 and IL-17A correlate with severity of motor and non-motor symptoms in Parkinson’s disease [J]. J Parkinsons Dis, 2019, 9(4): 705-709.
[26] Fahmy E, Rabah A, Sharaf S, et al. Interleukin-18 promoter polymorphisms and idiopathic Parkinson disease: an Egyptian study [J]. Acta Neurol Belg, 2019, 119(2): 219-224.
[27] Zhang X, Zhang Y, Li R, et al. Salidroside ameliorates Parkinson’s disease by inhibiting NLRP3-dependent pyroptosis[J]. Aging (Albany NY), 2020, 12(10): 9405-9426.
[28] Tesseur I, Nguyen A, Chang B, et al. Deficiency in neuronal TGF-β Signaling leads to nigrostriatal degeneration and activation of TGF-β signaling protects against MPTP neurotoxicity in mice[J]. J Neurosci, 2017, 37(17): 4584-4592.
[29] Jiang S, Gao H, Luo Q, et al. The correlation of lymphocyte subsets, natural killer cell, and Parkinson’s disease: a metaanalysis [J]. Neurol Sci, 2017, 38(8): 1373-1380.
