H1N1 病毒感染树鼩模型的血清代谢组学研究
2022-11-21吴芳芳李太平方衡罕园园谭栀恩张孟丽林浩何艳梅欧敏金亮子代解杰王喜军
吴芳芳,李太平,方衡,罕园园,谭栀恩,张孟丽,林浩,何艳梅,,欧敏,金亮子,代解杰*,王喜军,*
(1.广西壮族自治区药用植物园, 西南濒危药材资源开发国家工程实验室,南宁 530023;2.黑龙江中医药大学, 中医方证代谢组学研究中心,哈尔滨 150040;3.中国医学科学院北京协和医学院医学生物学研究所,昆明 650118)
流感是一种流感病毒引起的丙类传染性疾病,主要以打喷嚏和咳嗽为传染途径的春冬季节多发性疾病,疾病表现为发热、乏力、肌肉酸痛、头痛、咳嗽及轻微的呼吸系统症状,流感病毒具有较强的传播和感染能力,危险人群为免疫低下的儿童和老年,严重者导致病毒性肺炎和呼吸衰竭,流感病毒可感染呼吸道的所有各类细胞,并能在其内复制,其致病的主要机制是病毒复制引起的细胞损伤及死亡[1-4]。
树鼩是一种形似松鼠、吻部较长的小型哺乳动物,是树鼩科树鼩属动物,主要分布于南亚、东南亚及我国南部等地区,由于树鼩全基因组有超过90%与灵长类动物相似,并且近似于人类的组织解剖结构、生理生化和免疫学等生物特征,因此在病毒、肿瘤、神经、代谢等疾病研究具有强大的应用潜力和应用价值[5-6]。
代谢组学是系统生物学的重要组成部分,凭借高通量和高灵敏的分析仪器洞悉生物体的代谢变化,目前,代谢组学技术被广泛用于医药作用评价,食品安全和环境污染监测[7-9]。 基于此,本研究应用代谢组学方法分析H1N1 病毒感染树鼩模型的代谢变化,阐述病毒研究的理想动物—树鼩的代谢网络,发现其生物标记物,为H1N1 流感病毒早期诊治及药物筛查提供理论支持。
1 材料与方法
1.1 材料
1.1.1 实验动物
10 只2 ~ 3 周岁普通级TupaiaBelangeri Chiensis雄性树鼩,体重120 ~ 140 g,来自中国医学科学院医学生物学研究所树鼩种质资源中心【SCXK(滇)K2018-0002】,实验在中国医学科学院医学生物学研究所进行【SYXK(滇)K2018-0002】,饲养条件:饲养室为普通环境动物隔离室;设定温度20 ~ 25℃;设定相对湿度40% ~ 70%;照明时间:12 h/12 h(8:00 开灯,20:00 关灯,采用动物照明控制系统);换气次数每小时>15 次;工作照度: >200 LX;动物照度:15 ~ 20 LX。 所有操作均符合实验动物伦理学要求,本研究方案实施前已经中国医学科学院医学生物学研究所伦理审查委员会审查批准(DWSP201902013)。
1.1.2 主要试剂与仪器
A/Michigan/45/2015(H1N1)pdm09 疫苗株(中国医学科学院医学生物学研究所);色谱级甲醇( ThermoFisher, 美 国, 批 号: 193130 ); 乙 腈(ThermoFisher,美国,批号:191778);亮氨酸脑啡肽( Sigma, 美 国, 批 号: W19091942 ); 甲 酸(ThermoFisher,美国,批号:193497);纯水(广州屈臣氏食品饮料有限公司,生产日期:20201224);戊巴比妥钠(天津市大茂化学试剂厂, 批号:20180716); 生理盐水(广西裕源药业, 批号:H19082808)。
Waters ACQUITYTMUPLC 超高效液相色谱仪(Waters, 美 国), Waters G2Si Q/TOF 质 谱 仪(Waters,美国),BEH C18色谱柱(2.1 mm × 100 mm id,1.8 μm,Waters,美国);定量梯度PCR 仪-(Bio-Rad,美国); Masslynx V4.2 数据采集工作站(Waters,美国);Progenesis QI 2.0 代谢组学数据处理平台(Waters,美国);EZ info 3.0 软件(Waters,美国);低温超高速离心机(ThermoFisher,美国);New Classic MF 型电子天平(METTLER TOLED,德国)。
1.2 方法
1.2.1 动物分组及树鼩流感模型建立
树鼩分2 组,模型组6 只(记为1#,2#,3#,4#,5#,6#),对照组4 只。 模型组树鼩麻醉后,经鼻滴入H1N1 流感病毒液100 μL,模型组树鼩中每只动物鼻内给药106.8TCID50;对照组树鼩鼻内滴入无病毒等体积的未感染尿囊液,置于树鼩专用隔离器中进行饲养。
1.2.2 生物样本采集及流感树鼩模型评价
实验期间记录树鼩体温、生存率,观察并记录有无咳嗽、流涕、呕吐、食欲缺乏等表现,称量攻毒前后树鼩体重。 此外,制备鼻洗液样品作为标本,并从每只安乐死或处死的动物中收集肺和气管的代表性切片,样品在液氮中速冻并储存在-80℃以备检测病毒载量。 7 d 后,测量咽拭子,血清和肺组织的病毒载量,检测血清抗体及组织病变。 所有血液样品静置30 min 后离心(4℃,3000 r/min,15 min),取100 μL 血清加400 μL 甲醇,涡旋30 s,静置30 min,离心(4℃,3000 r/min,20 min)取上清液400 μL,40℃真空吹干,残渣用100 μL 甲醇复溶后离心(4℃,3000 r/min,20 min),取100 μL 上清液,供UPLC-MS 分析。
1.2.3 代谢组学分析条件
应用UPLC-Q/TOF-MS 分析树鼩的血清样品。优化后的分析条件如下:
色谱条件:色谱柱:BEH C18色谱柱(2.1 mm ×100 mm ID,1.8 μm);流动相A:0.1%甲酸乙腈溶液,流动相B:0.1%甲酸水溶液;柱温:40℃;流速:0.4 mL/min;进样量:4 μL。 梯度洗脱方法见表1。
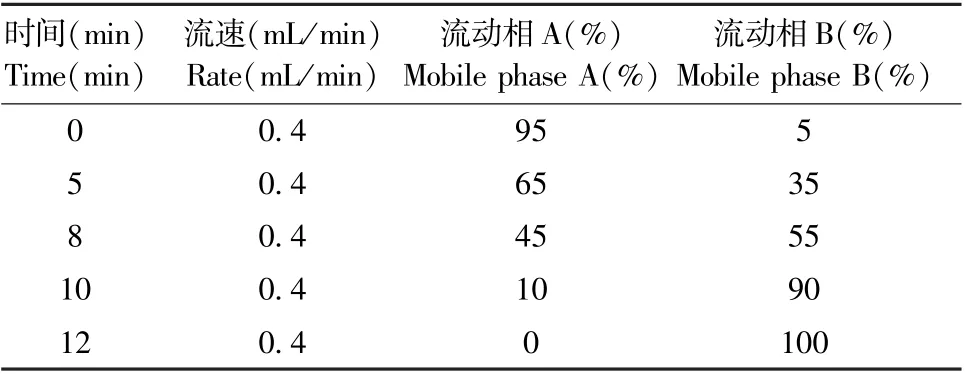
表1 树鼩血清代谢组学分析色谱梯度洗脱条件Table 1 Chromatographic gradient elution conditions of tree shrew serum metabolomics analysis
质谱条件:电喷雾离子源(ESI);正离子模式毛细管电压2.4 kV;负离子模式毛细管电压2.3 kV;样品锥孔电压30 V;脱溶剂气温度350℃;脱溶剂气流量800 L/h;锥孔反吹气流量:50 L/h;离子源温度:110℃。 锁定质量溶液:采用Lockspray 校正系统进行在线质量校正,亮氨酸-脑啡肽([M+H]+=556.2771,[M-H]-= 554.2615),溶液浓度为1 ng/μL,流速为5 μL/min;质量扫描范围:m/z 50 ~1200 Da,扫描时间0.2 s;MassLynx V4.2 工作站以continum 模式采集数据。
1.3 统计学分析
代谢组学数据应用Progenesis QI 软件进行降噪、峰提取、峰匹配和归一化,识别离子信息,以备多变量统计分析,非监督主成分分析(principal component analysis,PCA)判别模型和空白组间差异,正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)预测模型可靠性和稳定性,计算投影值的可变重要性(variable importance in projection value,VIP),同时计算组间离子的归一化丰度,t检验筛选P< 0.05的差异离子,结合MS/MS 信息和人类代谢组数据库(HMDB),脂质代谢组学数据库(Lipid maps)及京都基因和基因组百科全书数据库(KEGG)确定潜在生物标记物,对确定的生物标记物进行代谢通路富集分析,阐述其与急性肺炎疾病的生物关系。
2 结果
2.1 H1N1 感染树鼩的一般行为学评价
模型制备期间未出现动物死亡现象,但是模型制备前后所有树鼩出现饮食减少,体重下降现象(图1),模型制备第3 天,模型组树鼩开始出现咳嗽,流涕等流感症状,造模前后模型组和对照组的体温升高了近2℃(图2),但是统计分析结果显示两组无显著性差异。
2.2 H1N1 感染树鼩的组织病理学观察
所有动物于攻毒后第7 天用戊巴比妥钠麻醉后处死,进行大体解剖,观察肺组织病变程度,其中4 只攻毒树鼩肺出现病变,在镜下观测到树鼩肺组织肺间隔增宽,散在炎性细胞浸润,局部可见异物结晶体及异物巨细胞,考虑为异物肉芽肿,另有支气管固有层淋巴细胞浸润,详见图3和图4,可能由于感染大量病毒后引发的炎症损伤的病理改变。
2.3 H1N1 感染树鼩的病毒载量和血清检测
进行咽拭子,血清及肺组织的病毒载量测定,判断病毒感染情况。 结果显示,从攻毒后第1 天开始,6 只攻毒动物咽拭子都能检测到低病毒载量状态,第2、3 天仍可以检测到咽拭子的病毒载量(图5A),第5、6 天逐渐降低,到第7 天不可检出。 攻毒后第1 天直到第7 天安乐死,6 只攻毒动物血清均出现低拷贝载量(图5B),此外安乐死后肺部组织检查发现了3 只攻毒动物的低拷贝载量病毒(图5C)。 血清抗体检测发现攻毒后第1 天,动物血清开始出现抗体,第3 天升高明显,并在第7 天持续升高(图5D)。
2.4 H1N1 感染树鼩的血清代谢组学分析
采用优化后的分析条件,在正负离子模式下采集树鼩的血清代谢轮廓(图6),获取的全部代谢组数据代入Progenesis QI 软件进行预处理,利用SIMCA-P 软件对模型组不同时间点的数据进行PCA。 结果发现实验第7 天树鼩血液代谢轮廓与空白组分离明显,说明染毒第7 天树鼩体内代谢网络已经发生明显变化,最终导致代谢轨迹的偏移(图7)。
进一步筛选对第7 天的空白组与模型组组间差异生物标记物,采用OPLS-DA 寻找内源性物质的差异,计算正离子模式的R2X(CUM)= 0.981,Q2(CUM) = 0.863,负离子模式的R2X(CUM) =0.972,Q2(CUM)= 0.554,表明该统计模型具有一定的稳定新和可预测性。 通过计算,获得反应离子贡献度的VIP 值,选择VIP 值大于1 的数据,进一步计算组件差异离子的归一化丰度,同时匹配MS/MS、HMDB、Lipid map 等内源性代谢物数据库,结果共鉴定树鼩流感模型血清生物标记物24 个,其中正离子模式16 个、负离子模式8 个(表2)。 鉴定结果通过 MetaboAnalyst (https:/ /www. metaboanalyst.ca/)进行通路富集分析。

表2 树鼩流感病毒模型血清生物标记物鉴定结果Table 2 Identification results of serum biomarkers in tree shrew influenza virus model
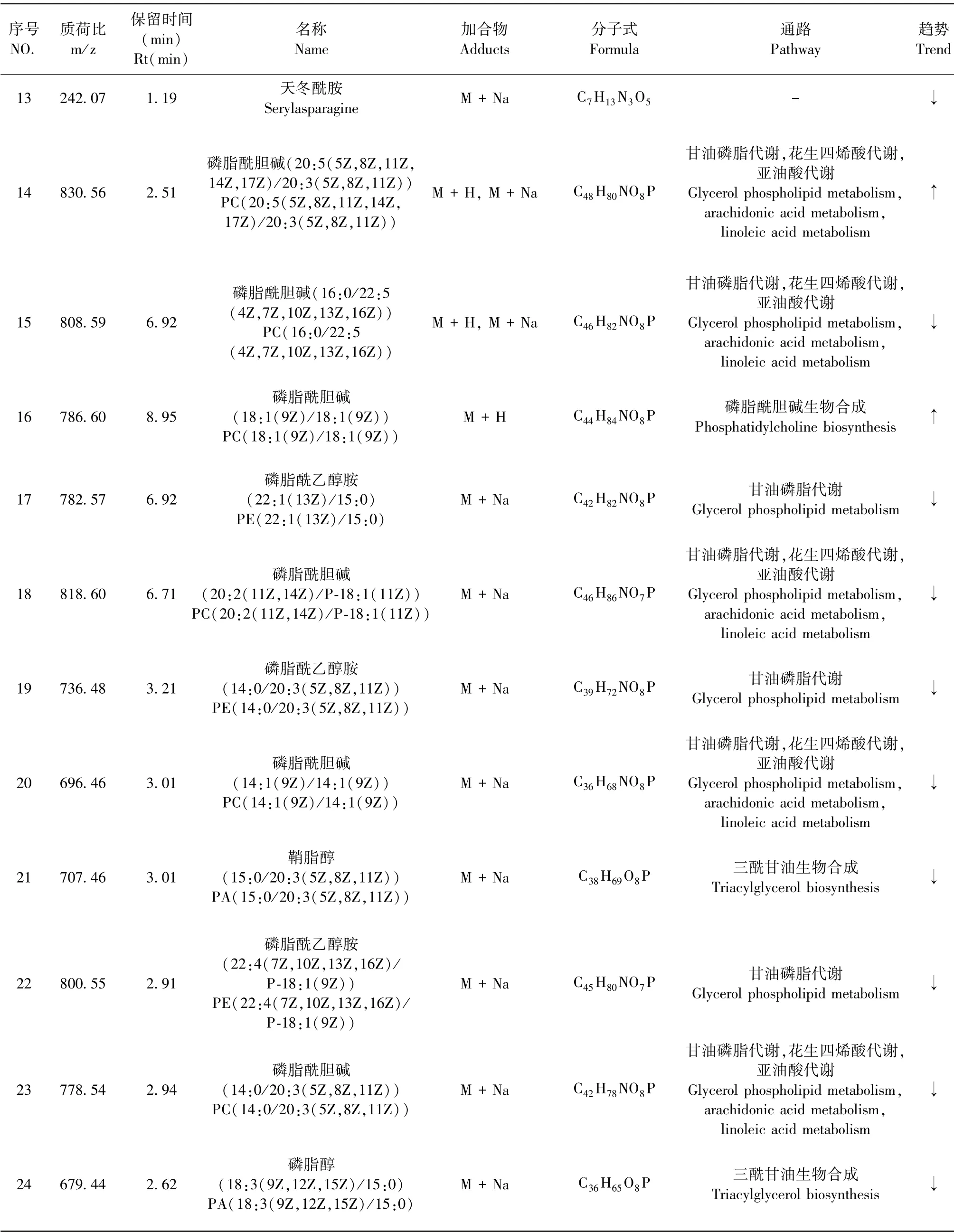
续表2
将24 个血清生物标记物进行代谢通路富集分析,异常的24 个代谢物干扰了7 个代谢通路(图8),包括甘油磷脂代谢、鞘脂代谢、花生四烯酸代谢、亚油酸代谢、嘌呤代谢等,其中甘油磷脂代谢和鞘脂代谢最为显著。
3 讨论
本次实验研究发现H1N1 流感株能够渐进式引起树鼩出现流感症状,首先滴鼻后在咽部出现病毒载量,之后成功进入肺部,并在血清内一直呈现低拷贝载量状态存在,病理结果表明与感染相关,该病毒株可感染树鼩。 树鼩感染病毒后,体温出现显著性升高,约2℃。 同时发现,感染树鼩血清第1 天开始产生抗体,其中,4 只树鼩的抗体第3 天到达峰值,2 只树鼩的抗体第7 天到达峰值,抵抗病毒感染,抗体呈现阶梯式上升。
经血清代谢组学分析,发现了24 个差异离子介导了7 条代谢通路,H1N1 感染树鼩模型发生了系列的代谢紊乱,这些差异离子和紊乱的代谢通路可能促进了炎症反应,造成树鼩流感样症状。 流感会引起系列的呼吸道症状,并且会引起脂类代谢、氨基酸代谢及糖代谢的异常[10-11]。 通过代谢通路富集分析,发现甘油磷脂代谢和鞘脂代谢发生强烈的扰动,它们属于脂质中重要的一类物质。 作为生物体重要的组成部分,脂质具有重要的生物功能和地位,脂质类化合物可以传递细胞间的信号,并介导物质进入和流出细胞,维持细胞正常的生存和凋亡。 同样,流感病毒在宿主细胞生存和复制依赖于脂质,因为流感病毒在发芽过程中获得宿主衍生的脂质包膜,流感病毒可定制过氧化物酶体,以便进行有效复制[12-13]。 本研究结果显示,许多涉及脂质代谢的磷脂酰胆碱等化合物水平在H1N1 感染树鼩的血清中相对丰度低于对照组树鼩,说明病毒的复制和生存与脂质代谢密切相关。
病毒-宿主相互作用是病毒复制和免疫反应的重要决定因素,研究表明,人支气管气道上皮细胞在感染H1N1 病毒后会发生近百种蛋白的上调,并且它们集中于嘌呤的生物合成代谢,糖代谢和蛋白质修饰[14]。 此外,作为公共卫生安全的主要威胁性传染病,流感病毒感染和登革热病毒感染也会引发嘌呤代谢的异常[15],此外,这些病毒性感染还会引起花生四烯酸代谢和脂肪酸生物合成等代谢紊乱。我们在H1N1 感染后的树鼩血清中发现了参与嘌呤代谢的二磷酸脱氧腺苷,经多变量统计分析发现它显著高于对照组血清中的归一化丰度,是感染H1N1 病毒树鼩和正常树鼩代谢轮廓差异的背景之一,代谢差异形成的原因可能与嘌呤代谢生成的尿酸致炎性相关[11]。 花生四烯酸代谢和亚油酸代谢是感染H1NI 树鼩发生的代谢异常之一。 花生四烯酸在许多疾病的发生发展中起到促进作用,花生四烯酸可由不饱和脂肪酸前体化合物转化而来,此外,经环氧化和脂氧化途径,花生四烯酸可以进一步生成促炎性化合物,例如前列腺素和血栓素[16]。
综上所述,本研究成功建立H1N1 感染树鼩流感模型,应用代谢组学技术发现了树鼩发生流感样病理改变的代谢机制,H1N1 病毒感染树鼩主要发生了甘油磷脂代谢、鞘脂代谢、花生四烯酸代谢、亚油酸代谢及嘌呤代谢异常。
参 考 文 献(References)
[ 1] 蔡祺, 陈骊婷, 郭平, 等. 外周血白细胞形态学参数在甲型、乙型流行性感冒诊断中的应用 [J]. 检验医学, 2021, 36(6): 586-589.Cai Q, Chen LT, Guo P, et al. Application of leukocyte morphological parameters in the diagnosis of influenza a and b[J]. Lab Med, 2021, 36(6): 586-589.
[ 2] 李雨鹏, 宓丹, 潘冲,等. 基于“截断”理论的柴芩石膏汤对流行性感冒临床研究 [J]. 辽宁中医药大学学报, 2021,24(2): 103-107.Li YP, Mi D, Pan C, et al. Effect of chai qin gypsum decoction on viral cold based on “truncation” theory [J]. J Liaoning Univ Tradit Chin Med, 2021, 24(2):103-107.
[ 3] 钟雪锋, 李毅, 方保民, 等. 老年流行性感冒患者临床特点及并发脓毒症的影响因素 [J]. 临床药物治疗杂志, 2021,19(6): 57-63.Zhong XF, Li Y, Fang BM, et al. The clinical characteristics of elderly patients with influenza and the influencing factors accompanied with sepsis [J]. Clin Med J, 2021, 19(6): 57-63.
[ 4] 郑贵锋, 温顺航, 陈小芳, 等. 重症和危重症流行性感冒患儿的临床特点及其影响因素分析 [J]. 中华传染病杂志,2021, 39(5): 285-288.Zheng GF, Wen SH, Chen XF, et al. Clinical characteristics and risk factors of severe and critical influenza in children [J].Chin J Infect, 2021, 39(5): 285-288.
[ 5] 贾杰, 代解杰. 树鼩在生物医学研究中的优势与挑战 [J].实验动物与比较医学, 2019, 39(1): 3-8.Jia J, Dai JJ. Advantages and challenges of tree shrews in biomedical research [J]. Lab Anim Comp Med, 2019, 39(1):3-8.
[ 6] Chen M, Ou C, Yang C, et al. A novel animal model of induced breast precancerous lesion in tree shrew [J]. Biol Pharm Bull,2019, 42(4): 580-585.
[ 7] 张帆, 王静, 颜朦朦, 等. 阵列式薄膜固相微萃取结合高效液相色谱-串联质谱法测定农产品中13 种农药残留 [J]. 食品安全质量检测学报, 2022, 13(16): 5401-5409.Zhang F, Wang J, Yan MM, et al. Determination of 13 kinds of pesticide residues in agricultural products by array-thin film micro-extractioncoupledwithhighperformanceliquid chromatography-tandem mass spectrometry [J]. Food Safe Qual Detec Technol, 2022, 13(16): 5401-5409.
[ 8] 许腾, 张玥, 张海丽, 等. 代谢组学技术在营养学研究中的应用 [J]. 中国食物与营养, 2017, 23(11): 11-16.Xu T, Zhang Y, Zhang HL, et al. Application of metabolomics in nutrition [J]. Food Nutr Chin, 2017, 23(11): 11-16.
[ 9] 闫广利, 孙晖, 张爱华,等. 基于中医方证代谢组学的中药质量标志物发现研究 [J]. 中草药, 2018, 49(16): 3729-3734.Yan GL, Sun H, Zhang AH, et al. Discovery of quality markers of chinese materia medica based on chinmedomics [J]. Chin Tradit Herbal Drugs, 2018, 49(16): 3729-3734.
[10] 李俊, 王军, 万艳, 等. 基于GC/TOF-MS 技术对流感感染小鼠粪便代谢组学的研究 [J]. 畜牧与兽医, 2019, 51(4):115-120.Li J, Wang J, Wan Y, et al. Metabolomics of feces in a murine model of influenza infection based on the GC/TOF-MS technique[J]. Anim Husbandry Veter Med, 2019, 51(4):115-120.
[11] 钱文娟, 杨瑞, 谢彤, 等. 蒲地蓝消炎口服液治疗甲型H1N1流感病毒性肺炎的GC-MS 代谢组学研究 [J]. 中草药,2018, 49(10): 2258-2264.Qian WJ, Yang R, Xie T, et al. Metabolomics on pudilan xiaoyan oral liquid in treatment of influenza A/H1N1-induced pneumonia based on GC-MS [J]. Chin Tradit Herbal Drugs,2018, 49(10): 2258-2264.
[12] Tanner LB, Chng C, Guan XL, et al. Lipidomics identifies a requirement for peroxisomal function during influenza virus replication [J]. J Lipid Res, 2014, 55(7): 1357-1365.
[13] Morita M, Kuba K, Ichikawa A, et al. The lipid mediator protectin D1 inhibits influenza virus replication and improves severe influenza [J]. Cell, 2013, 153(1): 112-125.
[14] Kroeker AL, Ezzati P, Coombs KM, et al. Influenza A infection of primary human airway epithelial cells up-regulates proteins related to purine metabolism and ubiquitin-related signaling [J].J Proteome Res, 2013, 12(7): 3139-3151.
[15] Cui L, Fang J, Ooi EE, et al. Serial metabolome changes in a prospective cohort of subjects with influenza viral infection and comparison with dengue fever [J]. J Proteome Res, 2017, 16(7): 2614-2622.
[16] 孙启慧, 张静, 李壮壮, 等. 基于代谢组学的麻黄细辛附子汤治疗流感小鼠的作用机制研究 [J].中国中药杂志, 2017,42(4): 763-771.Sun QH, Zhang J, Li ZZ, et al. Action mechanism of mahuang xixin fuzi decoction for mice with influenza based on metabolomics information [J]. Chin J Chin Mater Med, 2017,42(4): 763-771.
