浙江省1株犬源狂犬病病毒全基因组序列测定及细胞分离鉴定
2022-11-19张冉昕赵中飞任江萍卢学新朱武洋
张冉昕,马 岩,赵中飞,任江萍,凌 锋,卢学新,朱武洋
狂犬病病毒是引起人与动物间狂犬病的主要病原体,属于弹状病毒科狂犬病病毒属,基因组为不分节段的单股负链RNA,大小约为12 kb,编码5个结构蛋白[1]。狂犬病病毒长期在野生动物和犬猫等家养动物间持续循环传播,偶尔溢出感染引起人类的狂犬病。狂犬病的临床表现为进行性的脑脊髓炎,一旦出现相关症状将引起不可逆转的死亡,目前仍无有效治疗手段。在我国,超过95%的人间狂犬病是由发病犬引起[2]。
2015 年世界卫生组织(WHO)、世界动物卫生组织(OIE)和世界粮农组织(FAO)联合制定狂犬病消除计划,旨在2030年实现消除由犬引起的人间狂犬病。中国作为长期饱受狂犬病威胁的国家,参与了上述提议并制定了符合我国的消除规划[3]。目前,我国人间狂犬病病例自2007年以来持续下降,狂犬病的防控策略也从为高危人群注射疫苗转为控制并消除动物间的狂犬病[4-5]。获取动物间的狂犬病流行特征,从分子流行病学层面了解狂犬病病毒的变异等特点可为进一步开展狂犬病防控工作提供理论数据,促进防控策略的更新。本实验测定了浙江省1株犬源狂犬病病毒全基因组序列,并对序列进行比对分析,以期了解当地狂犬病病毒的分子流行特征。并通过细胞培养方法的优化,分离获得狂犬病病毒,为狂犬病疫苗更新、临床治疗等提供基础材料。
1 材料与方法
1.1 标本来源 样本来自浙江省绍兴市一犬伤多人事件的肇事犬,在负压生物安全二级实验室中采集脑组织并使用直接免疫荧光法(DFA):将阳性脑组织用80%冷丙酮固定后,用FITC标记的抗狂犬病病毒核蛋白抗体进行检测,确认为狂犬病病毒阳性。将病犬脑组织标本使用含1%青霉素-链霉素-两性霉素B混合溶液(SOLARBIO,P7630)的DMEM(GBICO,2186828)培养基研磨制备30%脑组织悬液,8000×g离心10 min保留上清,于-80℃冻存备用。
1.2 引物设计 参考近年浙江省2株狂犬病病毒(FJ712193、FJ712195)全基因组序列,设计扩增狂犬病病毒全基因组核苷酸序列引物(表1)。

表1 狂犬病病毒基因组扩增及测序用引物序列Tab.1 Primer sequences for rabies virus genome amplification and sequencing
1.3 全基因组序列测定与比对分析 使用QIAamp Viral RNA Mini Kit(QIAGEN,Cat.52904)提取脑组织悬液中的病毒RNA,提取操作参照试剂盒说明书。使用PrimeScriptTMOne Step RT-PCR Kit,Ver.2(Dye Plus)(Ta KaRa,Cat.#RR057A)进行一步法RT-PCR扩增,在25μL反应体系中加入2.5μL的病毒RNA作为模板,反应程序为50℃30 min完成逆转录过程,经过5 min的95℃预变性后,进行95℃30 s、(50~52)℃30 s、72℃60 s的扩增程序,共计35个循环。使用1%琼脂糖电泳确认目的条带扩增,对符合预期长度的片段进行序列双向测定。使用Geneious 11.0软件中De Novo Assemble方法,进行序列拼接。对序列进行间隔区和编码区校正,获得正确的全基因组序列,将其命名为ZJSX-2021。从GenBank中下载中国狂犬病病毒Ⅰ-Ⅶ型全基因组序列共32条,将本实验测得序列与32株中国地区毒株全基因组序列进行比对,用MEGA-X软件中的Neibor-Joining Method(NJ,replications=1000)绘制种系发生树。
1.4 病毒细胞分离 使用10%FBS的DMEM培养Neuro-2a细胞(ATCC,CCL-131)至对数期,消化制备细胞悬液,500×g离心5 min获取细胞,按1×106个细胞用1 m L病毒悬液重悬,置入37℃培养箱内孵育15 min,调整细胞密度为4×105cells/m L,在96孔板中每孔接种150μL病毒细胞混合液,在37℃、5%CO2条件下培养72 h后转入33℃继续培养48 h收获培养上清,同时对每孔细胞进行直接荧光法检测,孔内出现绿色荧光灶的判为阳性,收集保存上清即为F1代;同时参照已建立方法对F1代进行狂犬病病毒核酸检测[6]。将出现荧光灶较多的F1代继续扩大培养,使用MOI=0.2进行接种培养72 h用于扩增病毒,直到培养至F3代。参照中国药典中狂犬病病毒滴度测定方法测定F1-F3代的病毒滴度,同时使用1.3的方法测定F1-F3代的全基因组序列,分别比对F0与F1、F2和F3核苷酸序列和氨基酸变化情况,分析病毒基因序列的稳定性。
2 结果
2.1 狂犬病病毒ZJSX-2021全基因组序列组成 经1%琼脂糖凝胶电泳后核酸片段与预期大小相符(图1),经测序拼接获得了ZJSX-2021狂犬病病毒街毒株全基因组核苷酸序列,基因组全长11782 bp,包含3′端、5′端和5个开放阅读框(ORF),与狂犬病病毒株基因分布模式一致。3′端核蛋白基因上游有一段59个核苷酸的先导保守不翻译序列(leader),5′端L基因下游有一处117个核苷酸的非翻译区(trailer);在N-P-M-G间有2、2、6个核苷酸的间隔序列。
2.2 种系发生分析 对ZJSX-2021狂犬病病毒株基因序列与来源于GenBank中的中国其他地区代表不同基因型的32株序列进行基于狂犬病病毒全基因组序列种系发生分析(图2),结果显示,本实验分离得到的浙江绍兴狂犬病病毒(ZJSX-2021)基因序列仍属于我国狂犬病病毒株优势种ChinaⅠ型,与全部参考病毒ChinaⅠ型序列相比一致性为97.10%~99.31%。在与32株不同基因型的全基因组比对中,本株序列与2014年山东省分离得到1株狂犬病病毒株(JQ970486)一致性最高为99.31%,有79个核苷酸不同;其次与2013年北京丰台区分离得到的1株狂犬病病毒株(KC660078)一致性达99.28%,共有85个核苷酸不同;与2014年重庆分离得到的1株狂犬病病毒株(KY912036)相差最大,一致性仅仅有83.81%,有1500个核苷酸不同。在不同ORF比对后,结果显示在核苷酸序列比对中结构蛋白编码序列最低一致性在83.20%~87.91%,同一基因型内一致性均高于99%;在氨基酸序列比对中,N蛋白和L蛋白的序列较为保守,不同型别间的一致性最低在95%左右,在同一基因型内,一致性几乎为100%。P蛋白和M蛋白相较于G蛋白变异较大,P蛋白和M蛋白的最低一致性分别为87.92%和85.89%,低于G蛋白的90.67%,但在同一基因型内,一致性最高可达到100%。相关比对结果和变异位点数见表2。

表2 浙江绍兴狂犬病病毒(ZJSX-2021)不同基因变异情况统计表Tab.2 Statistical table of gene variants of Zhejiang Shaoxing rabies virus(ZJSX-2021)
2.3 病毒细胞分离培养 细胞分离培养病毒72 h后,对孔内细胞进行DFA检测,在荧光显微镜下可观察到细胞胞核周围形成绿色圆环状的病毒包涵体(图3);将获得的F1代继续传代培养,病毒滴度持续增高,从F1代3.19×102FFU/m L增至F3代5.71×107FFU/m L,可认为成功分离得到此毒株ZJSX-2021。
2.4 病毒序列稳定性分析 ZJSX-2021脑组织研磨液记作F0代,通过对F0代细胞分离培养得到F1、F2、F3代病毒悬液与F0代全基因组序列的各个蛋白区域核苷酸和氨基酸序列分别进行比较。发现F0代与F1、F2和F3代全基因组核苷酸序列表现出较高的相似性,差异在0.47%~0.51%,其中A-G的转化发生次数最多,占总变异的39.62%。核苷酸序列的一致性明显底于氨基酸序列的一致
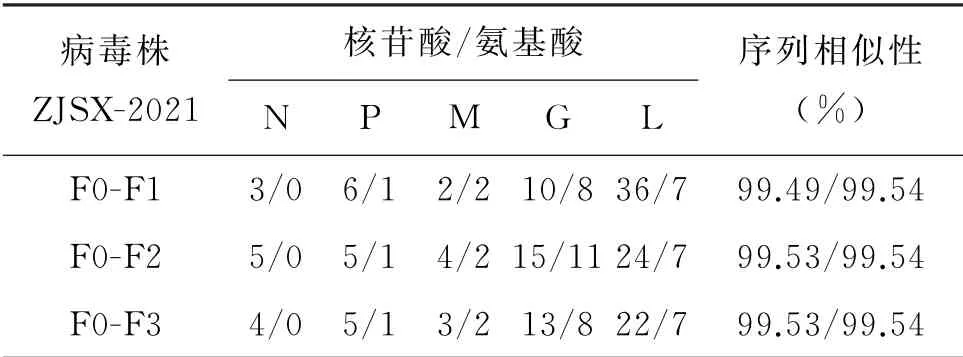
表3 浙江绍兴狂犬病病毒ZJSX-2021F0与F1、F2、F3代核苷酸氨基酸序列突变个数比较Tab.3 Comparison of nucleotide amino acid sequence mutations between Zhejiang Shaoxing rabies virus(ZJSX-2021)F0 and F1,F2 and F3 generations
3 讨论
狂犬病给我国带来沉重的社会和经济负担,严重威胁公共卫生体系。随着狂犬病疫苗免疫的普及和人们对狂犬病认识的加深,我国人间狂犬病发病率已经得到有效控制[7-8],但动物间狂犬病的流行情况尚不明确,亟需积累相关的数据,此外我国狂犬病的防控策略正处于从人间狂犬病防控向阻断动物间狂犬病传播转变的阶段,而动物间狂犬病的流行和传播目前相关研究较少,本实验通过对浙江地区1株犬源狂犬病病毒的分离与全基因序列的测定分析,也为研究我国动物间狂犬病流行特点提供相关数据。
狂犬病病毒株根据其流行情况可分为7个种群(ChinaⅠ-Ⅶ),每个毒株群的规模和流行范围各不相同[9]。我国各省份狂犬病发病情况也存在明显差异。本实验分离得到的ZJSX-2021分属ChinaⅠ型,是我国狂犬病病毒优势种群。ChinaⅠ型流行地区较广,分布范围达25个省份,在全国约2/3地区都曾出现,并以犬传播为主,目前尚未在与人更为密切的犬中建立循环[10]。浙江省处于狂犬病高发省市江苏省和福建省之间,一直存在狂犬病零星散发病例,本实验从分子流行病学层面通过研究浙江地区狂犬病病毒流行特点,为探究浙江地区狂犬病病毒种属分类提供参考,为浙江地区狂犬病防疫防控工作的开展提供思路。
狂犬病病毒共编码5种结构蛋白,其中核蛋白是狂犬病病毒稳定高效表达的蛋白,其氨基酸序列在5个结构蛋白中最为保守,往往作为狂犬病病毒的分型依据[11-12],主要与狂犬病病毒毒力有关,在位点333的精氨酸与神经侵袭力和跨突触传播能力相关,能使病毒在神经系统中扩散的速度更快[13]。本实验运用全基因组测序方法对浙江绍兴街毒株进行序列分析,与以往只针对核蛋白或糖蛋因白进行序列分析有所不同,全基因组序列比对分析以更全面的角度对序列进行比对,会使各序列之间的信息更加全面被了解。但目前利用全基因序列进行比对分析的相关数据较少,需要我们继续深入研究。
狂犬病病毒具有嗜神经性,早期狂犬病病毒分离主要通过乳鼠颅内接种完成,近年来通过细胞分离培养狂犬病病毒时有报道[14]。细胞分离培养狂犬病病毒已有成功报道,但成功率相对较低且难以达到较高滴度,实验流程尚未进行标准化。本实验对细胞培养分离狂犬病病毒方法进行了尝试,利用小鼠脑神经瘤细胞(Neuro-2a)成功分离狂犬病病毒,并在3次传代培养后获得高滴度的狂犬病病毒悬液。通过在细胞中分离培养病毒,既可以减少实验动物的使用,也可以降低时间人力成本,同时为开展病毒的复制过程探讨、抗病毒物质对病毒的作用方式与机制研究,以及研究病毒干扰现象的本质和变异的规律性研究等提供实验基础。
利益冲突:无
引用本文格式:张冉昕,马岩,赵中飞,等.浙江省1株犬源狂犬病病毒全基因组序列测定及细胞分离鉴定[J].中国人兽共患病学报,2022,38(10):849-853.DOI:10.3969/j.issn.1002-2694.2022.00.130
