应用MHC肽四聚体技术检测类风湿性关节炎患者CCP抗原特异性T细胞及初步临床应用
2022-11-19房国祥
房国祥 虞 伟
1.江苏省常州市德安医院检验科,江苏 常州 213000;2.东部战区总医院基础医学实验室,江苏 南京 210000
自身免疫性疾病是指机体对自身抗体发生免疫反应而导致自身组织损害所引起的疾病,其中类风湿性关节炎(rheumatoid arthritis,RA)在临床较为常见[1],其发病可能与遗传、感染和激素等相关,以滑膜病变和关节改变为重要特征,细胞与体液免疫在RA 的病变发展中发挥了重要作用[2-3]。目前,对于环瓜氨酸肽(cyclic citrullinated peptide,CCP)在RA 的发病中的作用研究较多,可证实RA 的病变严重程度与抗CCP 抗体水平有着紧密联系[4-5],而对于RA 患者的抗原肽的细胞特异性免疫反应研究尚不充分。
MHC 肽多聚体检测技术目前已广泛用于多种肿瘤、结核和疫苗的疗效监测等方面[6-7]。本研究基于流式细胞仪(FCM)结合肽四聚体技术的良好性能,检测了54 例临床病例的外周血单个核细胞(PBMC)中CD4+CD8-tetramer-CCP阳性细胞和作为对照的CD4+CD8- 人中间叶促皮质样肽(hCLIP)-tetramer 细胞,将携带无关肽的四聚体作为非特异性对照,预实验结果提示MHC 肽四聚体技术有一定比例的非特异性结合,为消除此影响,故以两者的差值定义为CCP抗原特异性T 细胞(CCP/AST)。分别检测RA患者与自身免疫性疾病对照组患者的CCP/AST比率,以及RA 患者中抗CCP 抗体阴、阳性患者中的比率,研究RA 患者的临床表现与检测结果有无联系。
1 资料与方法
1.1 一般资料
选取东部战区总医院2018 年4—11 月住院及门诊的确诊患者,包括:RA 组35 例;疾病对照组19 例,分别为系统性红斑狼疮12 例,强直性脊柱炎3例,Still病1例,贝赫切特病2 例,肌炎1 例。本研究中自身免疫性疾病均符合美国风湿病协会1987 年修订的诊断标准[8]。选取健康对照组30 名。所有患者和健康对照组均知情同意参与本研究。本研究获东部战区总医院医学伦理委员会批准。三组一般资料比较,差异无统计学意义(P> 0.05),具有可比性。见表1。
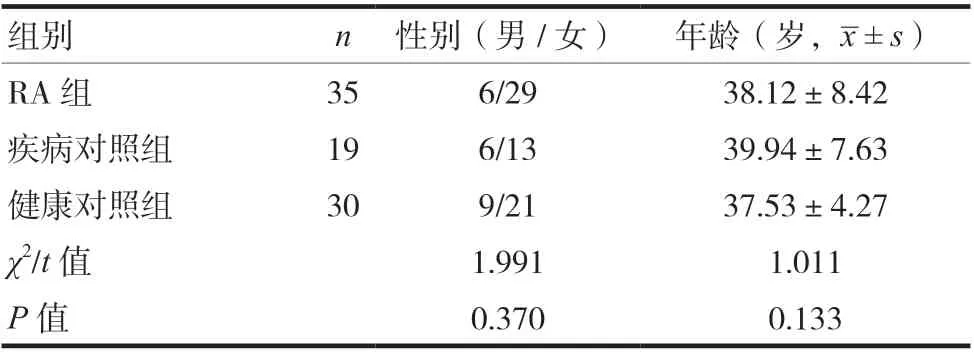
表1 三组性别与年龄比较
1.2 试剂材料
CCP 的 纯 度>95%,Gibco 公 司 提 供 的RPMI 1640 培养液;eBioscience 公司提供的硫氰酸荧光素(FITC)标记抗CD4 单抗,酶联APC 的鼠抗IgG-b 同型对照;BD 公司提供的APC 鼠抗人CD44 单克隆抗体;Invitrogen 公司提供的Cy 5.5-PE 抗人CD8 单克隆抗体;深圳联科提供的碘化丙啶(PI)染色液;挪威Axis-shield 提供的淋巴细胞分离液;实验肽为标记藻红蛋白(PE)的MHC-DRB1*0401/CCP/tetramer,对照肽为标记PE 的MHC-DRB1*0401/hCLIP/tetramer,由美国国立卫生研究院构建提供。
1.3 分离PBMC
采集6 ~9 ml 静脉血以肝素抗凝,以密度梯度离心法分离PBMC,使用细胞培养液进行重悬,并调节细胞浓度为106~107/ml。
1.4 流式细胞术的准备
在两支检测管中分别加入1 μl PE 标记的hCLIP-tetramer 及1μl PE 标 记 的CCP-tetramer,再分别加入PBMC 200 μl(浓度为106~107/ml)。混匀后,37℃下避光孵育30 min。用PBS 重悬,以1400 r/min 离心洗涤6 min,弃去上清,以100 μl PBS 重悬沉淀。分别加入15 μl 抗人CD4 单克隆抗体,2.5 μl 的Cy 5.5-PE 标记抗人CD8 单克隆抗体,10 μl 的APC 鼠抗CD44 单克隆抗体。混匀后20℃下避光孵育30 min,再次洗涤。弃上清,以500 μl PBS 重悬沉淀,加入2 μl 的PI 后检测。
收集并冻存研究对象的血清样本,并应用生物素-链霉亲合素放大ELISA 系统[9]测量标本的抗体水平,记录其吸光度(A)结果,并以此将患者分为抗CCP 抗体阳性与阴性两组。
1.5 检测抗体
1.6 调节流式细胞仪检测CCP/AST
校准BD 公司的流式细胞仪FACS Calibur后,以随机软件分析数据,将流式细胞仪的侧散射(SSC)和前散射(FSC)设置为线性增大,设置荧光信号为对数放大,以淋巴细胞设门,计数60 000 个淋巴细胞,特异性CCP/AST 为CD4+CD8-tetramer-CCP阳性细胞,计数并记录。
1.7 统计学分析
使用SPSS 22.0 统计学软件进行数据分析。计数资料用[n(%)]表示,行χ2检验,符合正态分布的计量资料用均数±标准差(±s)表示,行t检验,使用单因素方差分析比较三组计量资料。制作ROC 曲线,选择用于RA 诊断的最佳界限值,计算曲线下面积(AUCROC)。以P< 0.05 表示差异有统计学意义。
2 结果
2.1 三组CCP/AST检测结果
RA 组患者的CD4+CD8-tetramer-CCP 阳性细胞比率(即实验肽/AST 细胞数)、CD4+CD8-tetramer-CCP 阳性细胞比率与CD4+CD8-tetramer-hCLIP 阳性细胞比率(即对照肽/AST 细胞数)的差值(即CCP/AST)均高于疾病对照组、健康对照组(P< 0.05),见表2。RA 组中,抗CCP 抗体阳性组的CD4+CD8-tetramer-CCP 阳性细胞比率、CCP/AST 均高于抗CCP抗体阴性组,(P< 0.05),见表3。
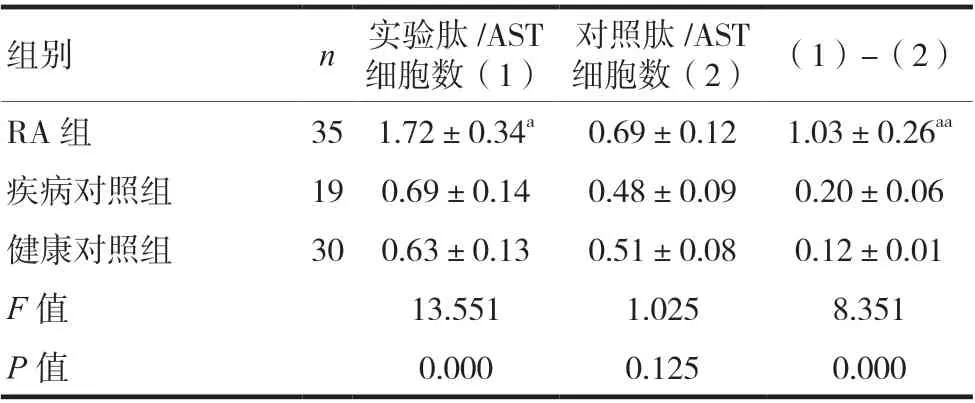
表2 三组外周血CCP/AST的检测结果(%,x ± s)
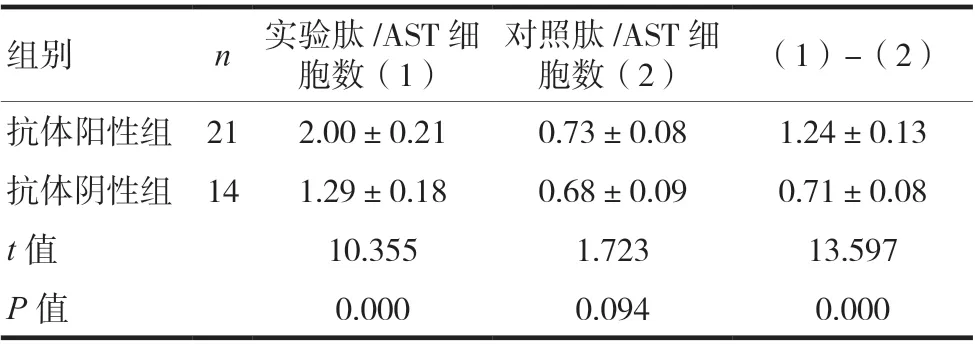
表3 RA组外周血CCP/AST的检测结果(%,x ± s)
2.2 ROC曲线分析
应用本实验方法检测的CCP/AST 比率用于RA 诊 断 时AUCROC为0.823,95% 可 信 区 间 为0.695 ~0.954(图1)。CCP/AST 比 率 为0.63% 时用于RA 诊断的敏感度为0.788,特异性0.882,达到最高的诊断效能。
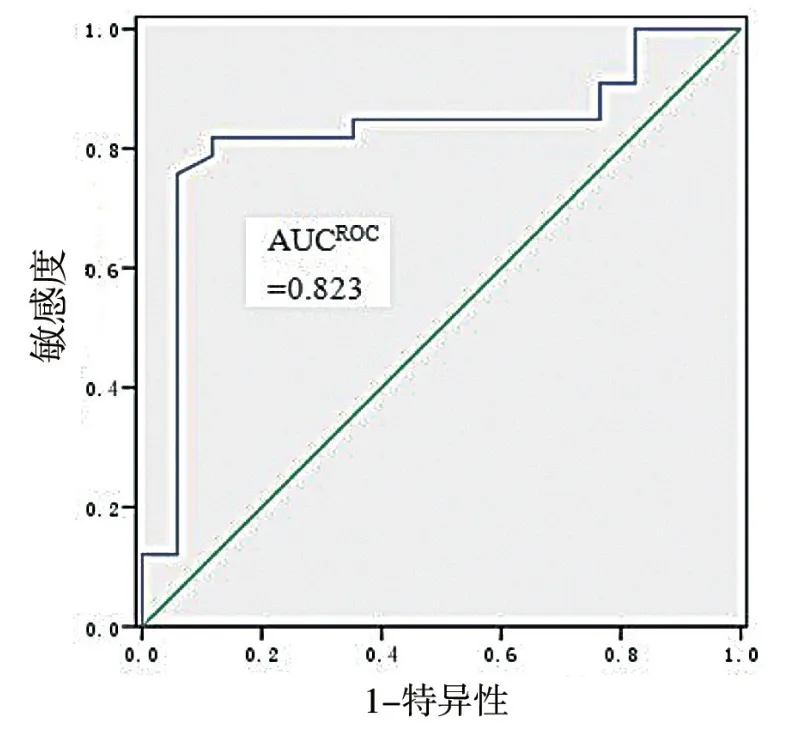
图1 CCP/AST 比率用于诊断RA 的ROC 曲线
2.3 RA患者CCP/AST检出结果与临床及实验室指标比较
依据CCP/AST 的细胞比率是否大于0.63%而将RA 患者分为CCP/AST 细胞升高与非升高两组。两组的肿痛关节数、破坏关节数、血沉及C 反应蛋白(CRP)的数据差异无统计学意义(P> 0.05),CCP/AST升高组的类风湿因子(RF)高于CCP/AST 非升高组,差异有统计学意义(P< 0.05),见表4。

表4 两组RA患者的实验室指标及临床表现比较(x ± s)
3 讨论
抗原特异性 T 淋巴细胞(AST)在免疫反应中发挥了重要作用,是细胞免疫的主要效应细胞[10],以往对AST 的检测操作繁琐且准确度不高。Altman 等[11]依据MHC 与T 细胞受体(TCR)特异性结合的原理,于1996 年首先创立MHC 四聚体技术,近年来,该技术已在针对AST 的研究领域中发挥了重要作用[12-13]。MHC 可将抗原肽递呈到细胞表面,而被TCR 识别并结合,这种识别和结合,在RA 等疾病的发病中起了重要作用,研究特定疾病的AST 对于理解疾病的发展和研究新的治疗策略具有重要意义[14]。MHC肽四聚体技术可有效提高TCR 和抗原肽的亲合力,显著增强抗原肽与T 细胞结合的稳定性,与荧光染料分子的结合进一步增强了染色效果,利于流式细胞仪的检测。其具有特异性强、敏感度高、无须无菌操作、无需体外扩增、对细胞损伤小等诸多优点[15]。不仅能定量检测AST,一定条件下,还可使用流式细胞仪直接对AST 进行分选以利于进一步的功能研究。但MHC 肽四聚体技术的运用须优化实验条件,从而提高获取可靠实验结果的特异性。
本研究以流式细胞术结合MHC 肽四聚体技术检测CCP/AST,发现RA 组检出的细胞比率结果较疾病对照组和健康对照组均显著增高(P< 0.05),且RA 患者中抗CCP 抗体阴性者的外周血CCP/AST细胞比率结果显著低于抗CCP 抗体阳性者(P< 0.05)。提示RA 患者的AST 对CCP 抗原肽的亲和力明显高于其他自身免疫疾病患者,RA 患者的AST 对CCP 抗原肽的反应性增加,提示CCP/AST 可能在RA 的发生与发展过程中发挥了重要作用,T 细胞受体与抗原递呈细胞表面的MHC 抗原肽的亲和力高低是影响机体细胞免疫的重要因素,RA 患者高比率的CCP/AST 检出提示患者体内存在针对瓜氨酸化蛋白的特异性细胞免疫的发生,持续的细胞免疫存在可能是导致疾病的迁延进展的重要因素。
流式细胞术结合MHC 肽四聚体技术检测CCP/AST细胞的比率用于诊断RA 时的AUCROC为0.823,有较高的临床应用价值。CCP/AST 升高组的RA 患者的高水平RF 提示此类患者有较高的体液免疫反应存在。同时,部分RF 检测为阴性的RA 患者存在较高的CCP/AST 的检出水平,从而提示本方法可用于RF 阴性的临床疑似患者的筛查,为临床诊疗提供较为明确的诊断依据。
综上,本研究所述的标记和检测CCP/AST 细胞的方法结果稳定,重复性较好,可作为RA 的潜在诊断用指标,与抗CCP 抗体等传统实验室指标联用可以有效提高RA 的诊断水平。
