FeS2改性及其非均相Fenton研究进展
2022-11-19熊志国江吉周廖国东邓文明白赛帅
熊志国,江吉周,廖国东,邓文明,白赛帅,邹 菁
(武汉工程大学 环境生态与生物工程学院、化学与环境工程学院,湖北 武汉430205)
0 引言
随着工业和农业的快速发展,人类赖以生存的自然环境不断被破坏,其中水污染当前亟需解决的环境问题[1]。科学家不断研发新型的绿色高效、经济环保的水处理技术。由于高级氧化技术可以生成羟基等强氧化活性物质,所以广泛用于水处理[2,3]。在所有高级氧化技术中,Fenton反应利用H2O2和Fe2+产生·OH,由于其高效率、简单、无毒性和成本效益,被认为是一种很有前途的有机废水处理方法[4]。Fenton 反应过程中 H2O2受到Fe2+催化活化而产生强氧化性得羟基自由基(·OH),而·OH可氧化绝大部分有机污染物使其矿化成CO2和H2O等无害物质[5]。然而,传统Fenton反应存在一些固有的缺点,如操作pH范围窄,产生的铁污泥量大,所需Fe2+量过高等。这些缺点,加上高污染负荷下的成本效益差,仍然影响了Fenton反应的广泛应用[6]。
铁系硫化物由于其独特的结构而表现出特殊的物理化学性质,这使得其在磁学、光学、光电转换和传感等方面有广泛的应用[7,8]。其中,黄铁矿(FeS2)无毒无害,在自然环境中的储量丰富,是地壳中含量最高的硫铁矿,在有机农药,重金属离子和有机染料有广泛的应用[9]。黄铁矿也可以使用作为潜在的非均质Fenton试剂。非均相催化反应在2~10的pH范围内仍有较高的催化活性,比传统Fenton反应更有优势[10]。
目前,FeS2常用的制备方法水热法备受关注[11],但水热法制备的FeS2由于具有比表面积小、Fe(Ⅱ)/Fe(Ⅲ)循环途径较少、循环使用次数低等不利因素。为了改进这些缺陷,有必要对FeS2进行改性后用于非均相Fenton体系以提高降解效率。
1 引入外场
非均相反应中用于还原Fe3+的途径单一,电子随着反应的进行,物种将逐渐耗尽,一些研究集中在将引入外部能量,如紫外可见光、电、超声等以增强还原性电子产生以及原位产生H2O2等效果。随着这些电子对Fe(Ⅲ) 的还原,以及额外生成的H2O2等可以最大限度地减少用于生产 Fe2+的 H2O2消耗,提高Fe2+浓度,从而大大提高 H2O2的利用效率。
1.1 光-非均相Fenton
光-非均相Fenton法将紫外光、可见光等光源引入到非均相Fenton反应中形成UV-非均相Fenton系统,紫外光和FeS2对H2O2催化分解存在协同效应,可以在很大程度上改善非均相Fenton试剂的氧化性[12]。例如,张敬东课题组[13]利用黄铁矿研究了非均相Fenton和Photo-Fenton过程的活性来对硝基苯酚的氧化反应进行了评价。黄铁矿-光-Fenton (Pyrite-PF) 体系可在4 min内实现完全的超快速氧化,而在黄铁矿-Fenton (Pyrite-F) 体系中则为10 min。Pyrite-PF的优良氧化性能可能是由于铁离子与亚铁离子在可见光下的加速循环,提高了活性氧 (ROS) 的生成,如图1所示。
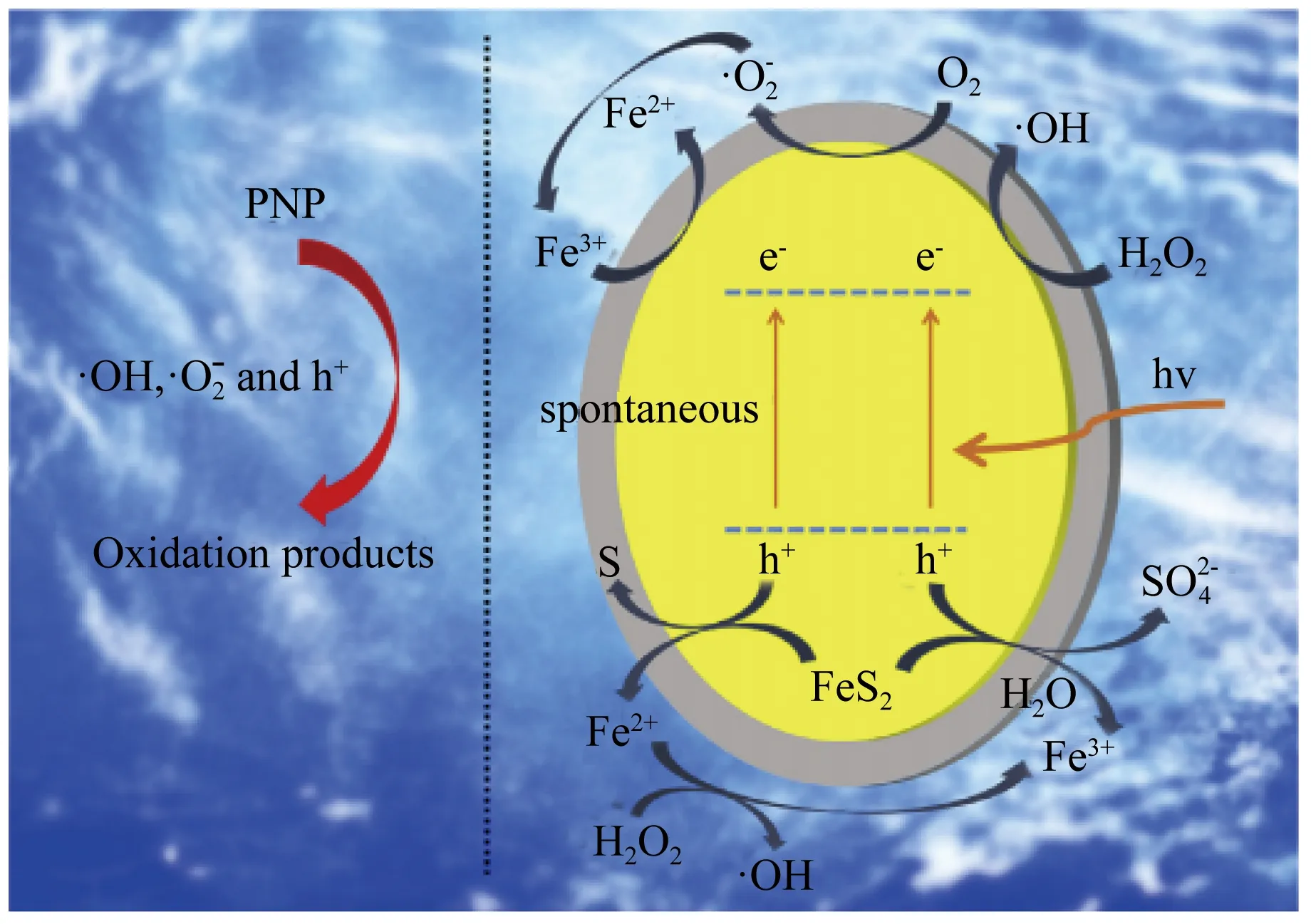
图1 Pyrite-F和Pyrite-PF体系中PNP的催化降解机理[13]
此外,曾令玉等[14]研究了可见光对FeS2异相Fenton体系的影响,研究发现:一方面,FeS2能够高效地吸收可见光,激发出电子 (e-) 和空穴 (h+),进一步氧化溶解氧和水生成·O2-和·OH,另一方面,可见光能直接加快反应体系中的铁循环,使降解过程能快速有效地进行。但是光-Fenton技术在高效氧化降解废水的同时,却也存在太阳能利用率低,能耗大,设备费用高的缺点[15]。
1.2 电-非均相Fenton
电-非均相Fenton主要反应机理是在阴极电极上发生氧化还原反应产生H2O2,含铁阳极失去电子生成Fe2+或者通过外来铁源投加生成,然后非均相Fenton反应生成氧化性强的·OH降解有机污染物[16]。原理图如图2所示。
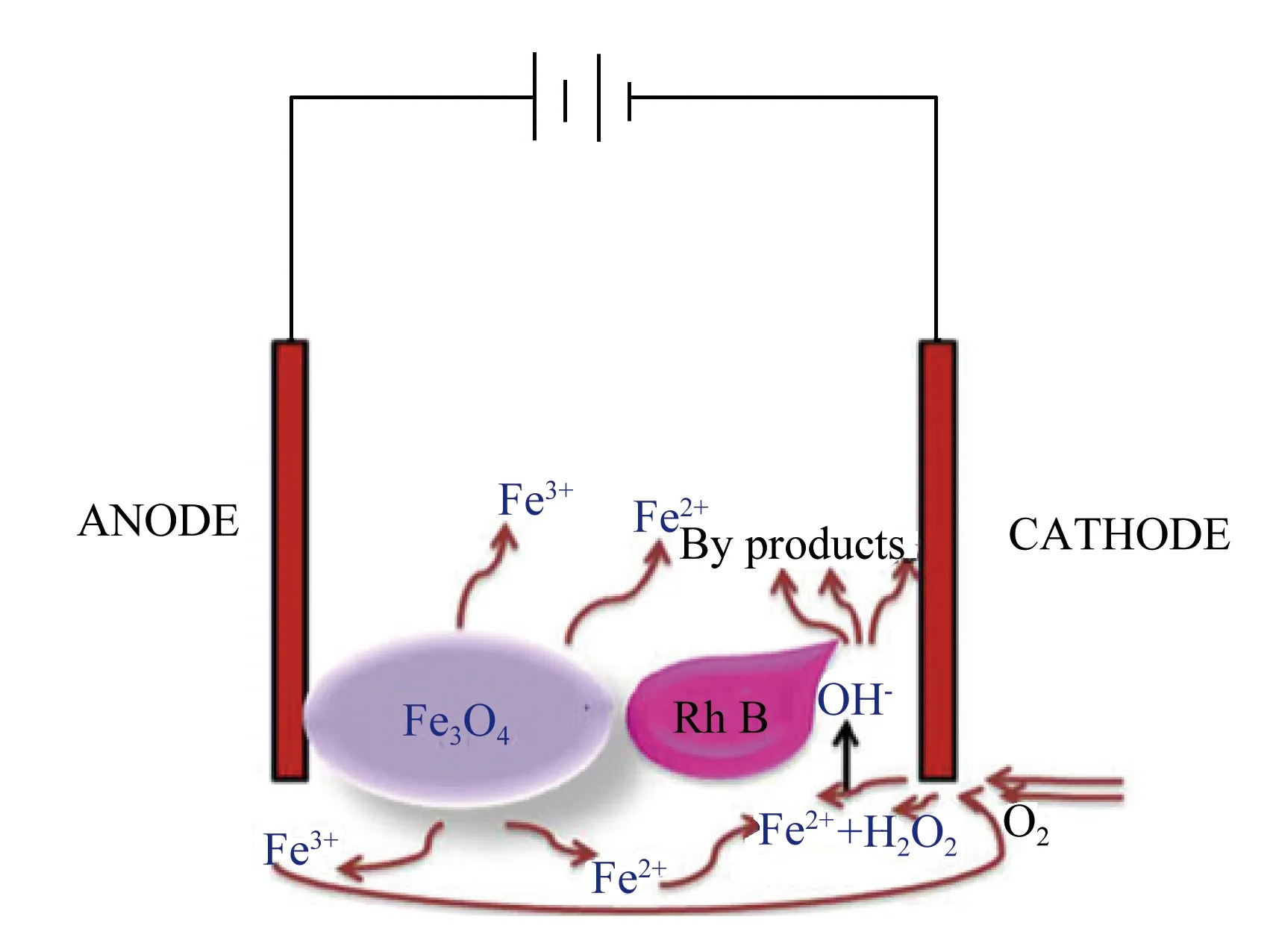
图2 电-非均相Fenton反应原理示意图[16]
电-非均相Fenton 法在不需另外的化学试剂,且处理后产物无污染,是一种效率高、处理快、无污染的高级氧化法[17]。与光-非均相Fenton 法相比,它有很多独特的优点:首先是产生 H2O2的途径更加多样化,其次,除了利用·OH的强氧化性降解有机物,还可以通过电化学吸附、电混凝、电化学氧化等共同实现对污染物的降解。
王祎等[18]将水热法制备的FeS2用于电芬顿的非均相催化体系 (FeS2-EF) 来探究降解双氯芬酸钠的效果。pH为中性条件下,FeS2-EF体系的催化效果依旧很好,即当双氯芬酸钠的浓度为200 mg/L时,只需降解8 min,其去除率超过82 %,TOC去除率达到70% (3 h),如图3所示。
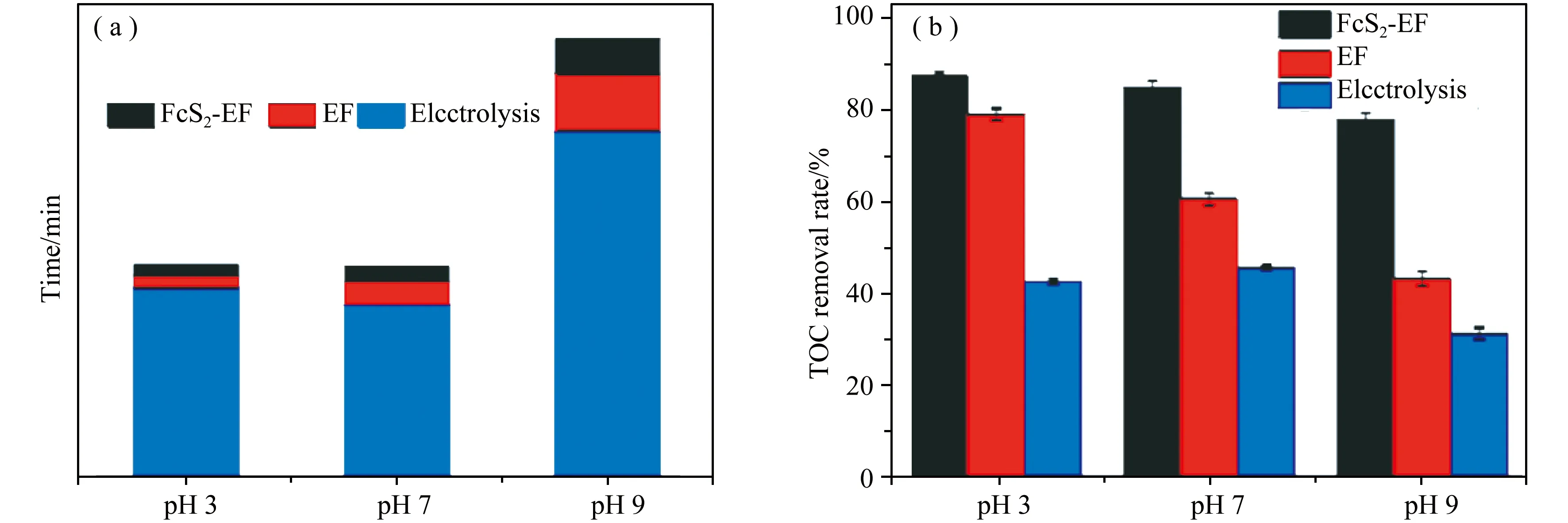
图3 DCF在不同条件下降解 93%所需要的时间(a)TOC 去除率;(b)操作条件:电流 0.1 A,50 mg/L DCF[18]
曾令玉等[14]研究了电对FeS2异相Fenton体系的影响,研究发现:引入电场,石墨阴极上可以产生H2O2,电能也能直接还原Fe3+,促进铁循环,从而促进反应进行。当电压逐渐加大时,H2O2的生成速率和Fe2+的再生速率增加,为体系提供了更多的氧化剂和催化剂,降解效率逐渐增大。因此,外加电压为反应体系提供了能量来源,是影响污染物降解效率的重要因素。
2 催化剂载体的选择
Fe(Ⅱ) 的低生成速度是非均相Fenton反应的限速步骤。 因此,近年来大量研究集中在直接将富电子材料与非均相Fenton催化剂结合,这些材料中的电子可以加速Fe(Ⅱ) 的生成,从而产生较高的非均相Fenton反应活性。催化剂载体可能的局限性包括,载体的稳定性以及载体可能会消耗自由基,导致活性有所下降。
2.1 无机材料
无机材料主要有沸石、碳材料、氧化铝、分子筛等。由于这些材料比铁材料更廉价易得、拥有较高的比表面积及较多的活性位点,反应后易于回收等优点。最近,Diao等[19]成功制备的FeS2/SiO2微球与FeS2活化的H2O2系统相比具有更好的CIP降解性能和固体铁催化剂的高可重复使用性,CIP降解性能的提高主要归因于吸附和氧化过程之间的协同作用,如图4所示。

图4 (a)不同系统对CIP的降解反应条件 [CIP]0=1×10-4 mol/L, [H2O2]0=3×10-3 mol/L, [catalyst]0=1.25 g/L, pH=3.0; (b)FeS2 / SiO2微球催化降解CIP的机理[19]
姜艳丽等[20]采用电沉积法在钛网表面沉积了Fe3O4/FeS2固定化膜层。苯酚初始浓度 35 mg/L、反应温度30 ℃的条件下降解60 min,可将98%的苯酚去除。研究发现:较大的比表面积提供更多的活性位点参与苯酚降解;硫元素的引入可促进Fe3+/Fe2+的氧化还原循环,同时提供合适的酸性微环境,最终显著改善该催化剂在近中性条件下的催化活性。
2.2 有机材料
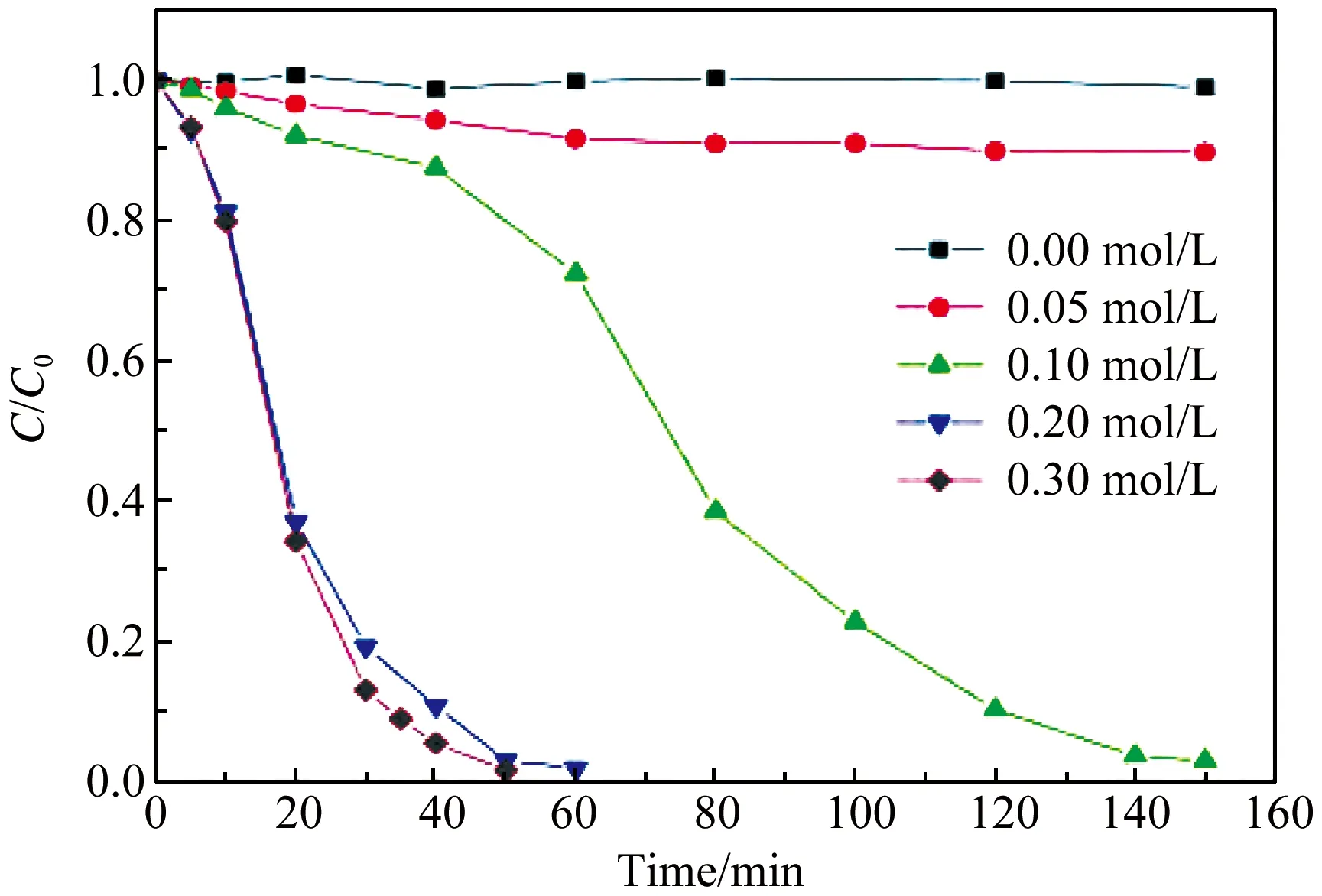
图5 不同硫源浓度下制备的Fe3O4/FeS2降解苯酚曲线[20]
有机材料指的是成分为有机化合物的材料,最基本的组成要素是都含碳元素,日常见的比较多的棉、麻、化纤、塑料、橡胶等都属于此类。这些材料价格便宜、拥有较高的比表面积及较多的官能团活性位点,同时也易于回收的。加稳定的含碳有机材料具有以下优势和特点:(1) 高结晶性; (2) 多孔性和大比表面积; (3) 具有规律的孔道结构; (4) 具有较高的热稳定性和化学稳定性。因此含碳有机材料在光催化和非均相Fenton等多个领域均有广泛研究[21-23]。
Diao等[24]以膨润土负载的nZVI(B-nZVI) 为催化剂,在FeS2存在下活化H2O2降解阿特拉津 (ATZ),如图6所示。结果表明,引入FeS2能显著促进B-nZVI/H2O2工艺对ATZ的降解,在最佳条件下,B-nZVI/FeS2/H2O2工艺在60 min内可降解约98%的ATZ。B-nZVI/FeS2/H2O2工艺的降解率远高于B-nZVI和FeS2/H2O2工艺的总和。实验证明联合有机膨润土修饰nZVI吸附还原技术与非均相Fenton氧化技术去除ATZ具有很大的潜力。
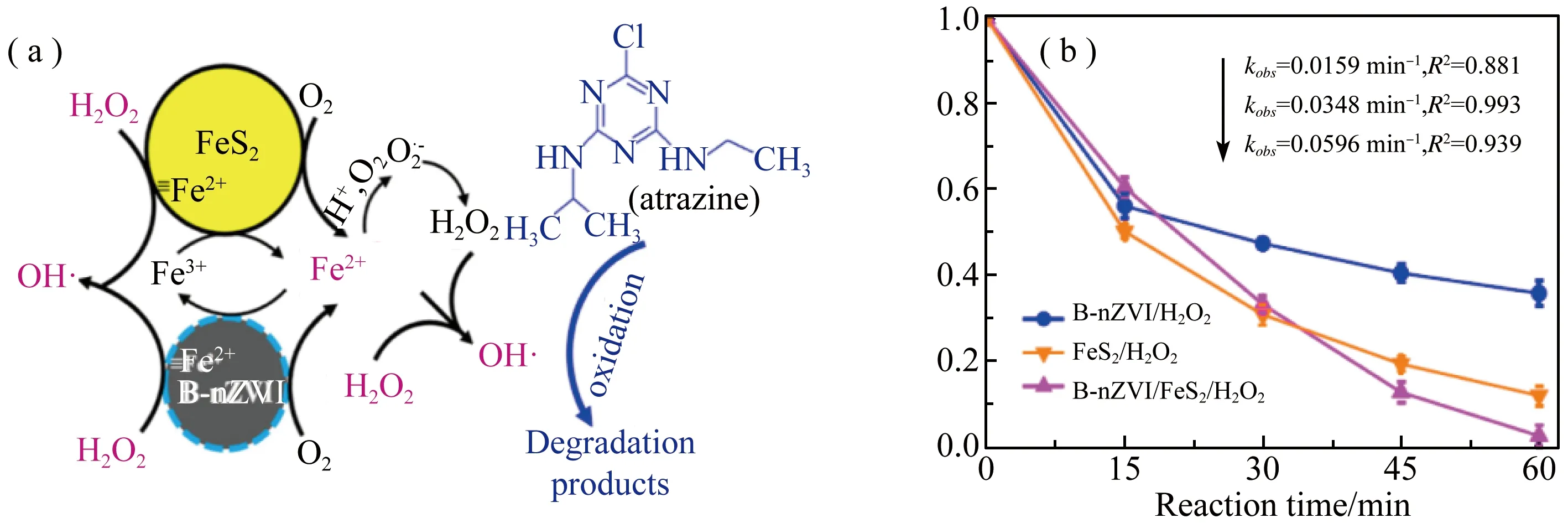
图6 (a) B-nZVI/FeS2/H2O2工艺降解阿特拉津的可能反应机理;(b) B-nZVI/H2O2、FeS2/H2O2和B-nZVI/FeS2/H2O2降解ATZ曲线[24]
Wei等[25]通过简单的水热法将FeS2与g-C3N4偶联制备了光合Fenton杂化催化剂,在可见光照射下,RhB可以在60 min内完全降解。研究表明:FeS2和g-C3N4之间的异质结构可以缩短带隙,并加速光激发电荷载流子的分离和运输,促进Fe2+通过催化H2O2生成·OH,增强·O2-向O2的转化,以及生成的光致空穴均有助于提高降解效率(图7)。

图7 Fenton过程中MB降解的合理反应机理[25]
3 非均相Fenton反应过程中引入其他物质
引入掺杂金属或者还原性有机物等,可以显着促进Fenton反应。一些多价金属可以在Fenton反应过程中通过类 Haber-Weiss 机制促进 H2O2的分解,还可以参与 Fe(Ⅲ)/Fe(Ⅱ) 的氧化还原循环,而还原性物质可以有效还原Fe3+成Fe2+促进反应的进行。首先,还原性物质可以将Fe3+还原成Fe2+,生成更多的Fe2+和H2O2反应生成更多的羟基自由基;其次,还原性物质具有一定的吸附作用,效果会更高。但需要注意的是,虽然引入其他物质可以带来不错的效果,但有可能会导致新的污染或者二次污染。
3.1 引入有机物
如图8所示,He等[26]提出了黄铁矿/ H2O2/羟胺 (HA) 体系来处理罗丹明B(RhB),结果表明:在其最佳条件下RhB达到了近乎完全的脱色和52.8%的矿化度。降解反应主要由溶液中Fe2+与H2O2反应生成的中心点·OH控制。HA可通过其强还原性来增强RhB脱色,从而加速Fe(Ⅱ)/Fe(Ⅲ) 循环;在黄铁矿表面,HA可以通过抑制黄铁矿的氧化来改善黄铁矿的连续反应性。

图8 (a)黄铁矿/ H2O2 / HA系统降解RhB的可能反应机理;(b)不同系统的RhB脱色效率[26]
3.2 引入离子
Wu等[27]通过组合Fe3+和FeS2/H2O2的新型系统来增强氯霉素 (CAP) 的降解,研究表明:表观速率常数的增加归因于Fe3+产生的自催化作用。Fe3+从开始反应的5 mg/L在90 min内下降到0.9 mg/L以下,而Fe2+浓度上升至4.5 mg/L。因此,Fe3+的添加极大地提高了FeS2对H2O2分解的催化活性,从而促进亚铁的生成,产生更多的羟基自由基加快CAP氧化。Sun等人的研究发现[28],Cu+可以在催化剂的表面和体相中生成,是生成·OH最活跃的物种。并制备了Cu+占主导地位的催化剂Cu@SiO2-R200表现出最高的降解率,在10 min内去除了超过95% 的RhB(10 ppm)。结合包括原位光谱和密度泛函理论计算在内的多种技术,可以得出结论,Cu+作为主要活性物质,在激活H2O2生成·OH并随后降解污染物方面的效率最高。
一些还原物种,如HA,可以还原许多电子受体,如H2O2、Fe(Ⅲ) 和Cu(Ⅱ)。此外,Chen等人[29]证明,HA由于其高还原性,可以分解H2O2生成不含过渡金属的·OH。考虑到这些还原物种的性质,近年来许多研究人员在非均相Fenton反应中添加了HA、硫代硫酸钠和亚硫酸钠,以加速Fe(Ⅲ)/Fe(Ⅱ) 的氧化还原循环[30-32]。Wu等人[31]添加了不同的还原剂。将HA、硫代硫酸钠、抗坏血酸、抗坏血酸钠和亚硫酸钠添加到过硫酸盐/Fe(Ⅱ) 系统中,以加速Fe(Ⅱ) 的再生,发现HA是三氯乙烯降解中最有效的物种。Hou等人[32]利用HA、针铁矿和H2O2(α-FeOOH-HA/H2O2) 构建了一个表面Fenton系统来降解各种污染物,他们发现HA可以加速Fe(Ⅲ)/Fe(Ⅱ) 氧化还原循环,极大地促进了H2O2在α-FeOOH表面上的分解,从而在Fenton反应过程中产生·OH,而不会释放任何可检测到的铁离子。
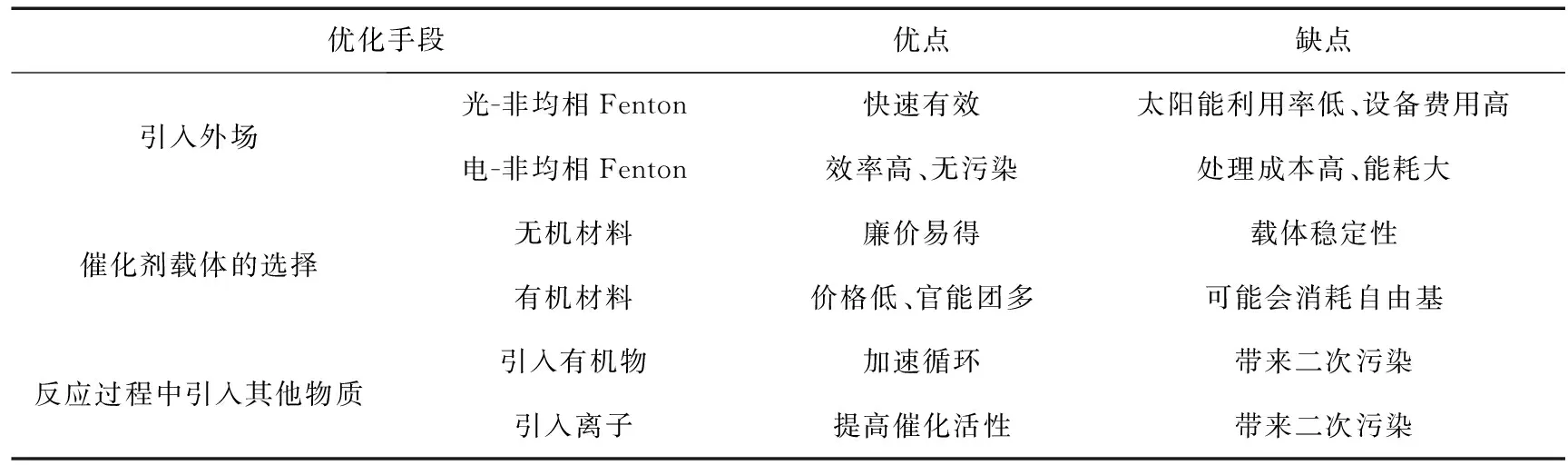
表1 Fenton优化技术手段对比总结
4 FeS2非均相Fenton机理进展
众所周知氧气 (O2) 和三价铁 (Fe3+) 是自然环境中黄铁矿的常见氧化剂。因此,有必要总结黄铁矿在H2O2氧化生成·OH的机理。
FeS2+7.5H2O2→Fe3++2SO42-+H++7H2O,
(1)
FeS2+14Fe3++8H2O→15Fe2++2SO42-+16H+,
(2)
Fe2++H2O2→Fe3++OH-+·OH,
(3)
Fe3++H2O2→Fe2++H++·O2H,
(4)
≡Fe(Ⅲ)+H2O2→≡Fe(Ⅱ)+H++·O2H ,
(5)
≡Fe(Ⅱ)+H2O2→≡Fe(Ⅲ)+OH-+·OH。
(6)
多相催化剂和H2O2之间有两条主要的反应路线:(ⅰ) 不可避免地从催化剂中浸出的铁与H2O2的反应(式(3)、式(4)),和(ⅱ) 表面铁的反应 (≡含H2O2的Fe(Ⅲ)(式(5)、式(6))。H2O2与Fe2+水溶液通过Fenton反应(式4.3)主要产生·OH[33],在高氧化还原电位下,·OH可以以非选择性方式强力降解大多数有机污染物[34]。在酸性条件下[35],黄铁矿首先被H2O2氧化 (式(1)) 生成Fe3+和硫酸盐 (SO42-)。Fe3+在黄铁矿的作用下 (式(2)) 将其还原为Fe2+,然后Fe2+与H2O2反应生成·OH[36,37]。当暴露于空气中时,O2氧化黄铁矿可能会生成Fe2+,而Fe2+的循环再生则是产生更多·OH的关键步骤[38]。例如,Wu等[39]指出由于黄铁矿还原Fe3+会增加Fe2+的生成,因此添加Fe3+会增强氯霉素的氧化作用。除黄铁矿的氧化溶解外[40],非氧化溶解还会产生Fe2+,这很可能有助于·OH的产生。尽管黄铁矿催化H2O2氧化生成·OH的机理很早就发现了,关于氧气的影响机理还有待探究,张礼知课题组等[10]研究了水热合成的FeS2(syn-FeS2) 与商品化黄铁矿 (com-FeS2) 的活性区别及详细机理 (图9)。实验发现syn-FeS2表面吸附态Fe2+更多,单电子活化分子氧生成·O2-与催化剂表面吸附态Fe2+浓度较高有很大关系。·O2-会将Fe3+还原成Fe2+有助于表面Fe(Ⅲ)/Fe(Ⅱ)的循环,因此会让Fenton反应更多·OH来降解和矿化甲草胺。同时研究还显示,当反应pH在3.2~9.2之间,pH变化对污染物降解速率几乎没有影响。
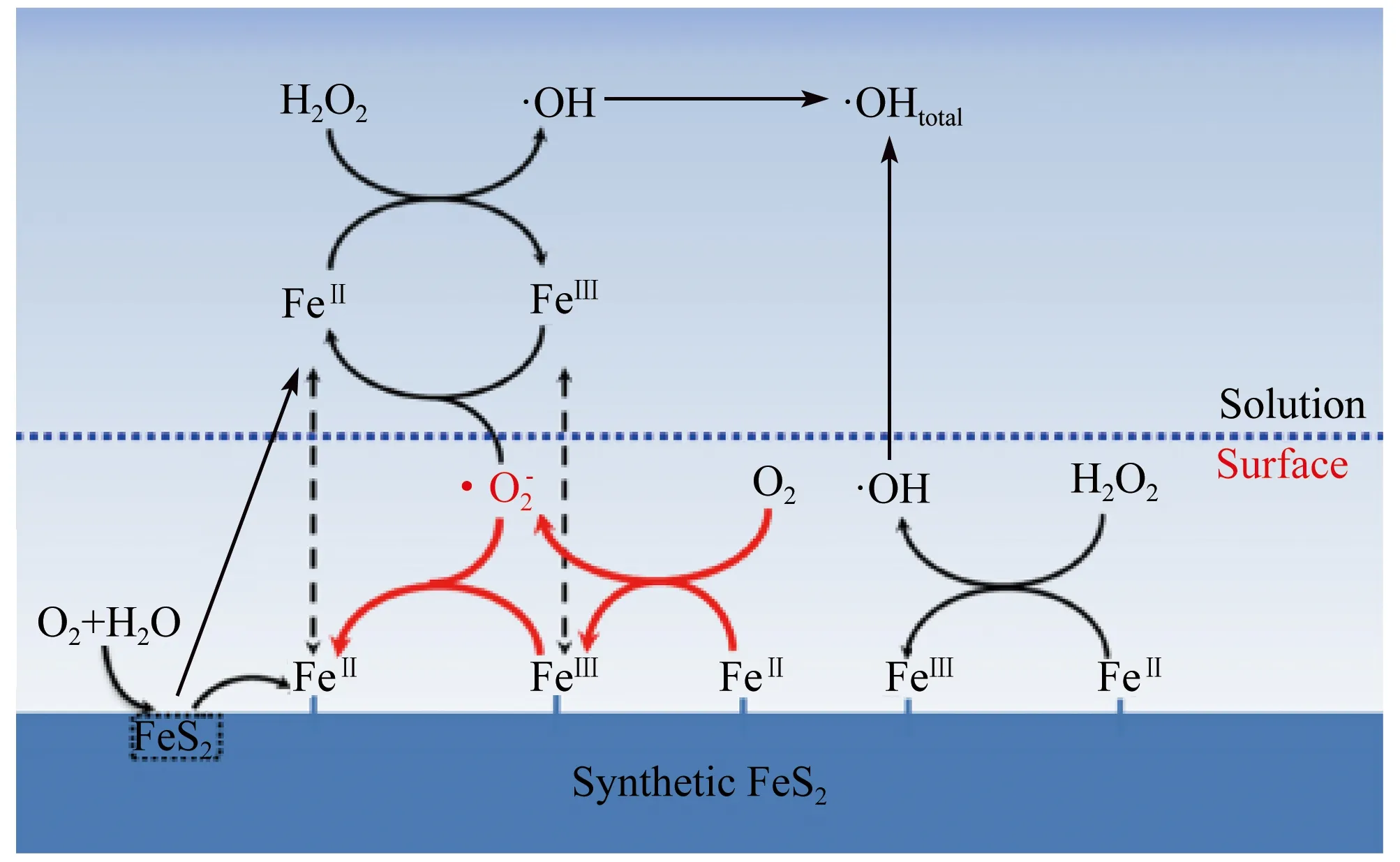
图9 syn-FeS2 / H2O2系统中的非均相Fenton机理[10]
5 改性FeS2非均相Fenton的应用
以FeS2为代表的铁系硫化物都是高效的非均相类Fenton催化剂,具有易分离回收、可重复使用等突出优点。据报道,黄铁矿FeS2作为多相催化剂之一,可以有效地降解一些有机污染物。FeS2微晶可以高效吸附或光催化降解一些有机染料[41]。FeS2/Fe2O3复合材料可以是活化H2O2的更好的催化剂,用于有机物污染物的氧化[42]。此外,FeS2/SiO2微球可以通过控制Fe2+从FeS2中的释放来促进环丙沙星的降解,使Fe2+和H2O2水溶液的反应顺利进行,从而提高了H2O2的利用率[19]。Guo等[43]利用模拟太阳光和天然有机酸原位生成H2O2,在不调节pH的条件下,构建了硫铁矿基绿光Fenton体系处理卡马西平 (CBZ)。酒石酸 (TA)、柠檬酸 (CA)、抗坏血酸 (AA) 等有机酸的加入可与黄铁矿中的铁形成络合物,促进Fe(Ⅱ) 溶解。辐照后,黄铁矿可被激发产生光电子,通过有机酸辅助的两步反应,使氧气还原生成H2O2,如图10所示。模拟的阳光和有机酸促进了H2O2和Fe(Ⅱ) 物种的原位生成,维持了高效的Fenton反应。
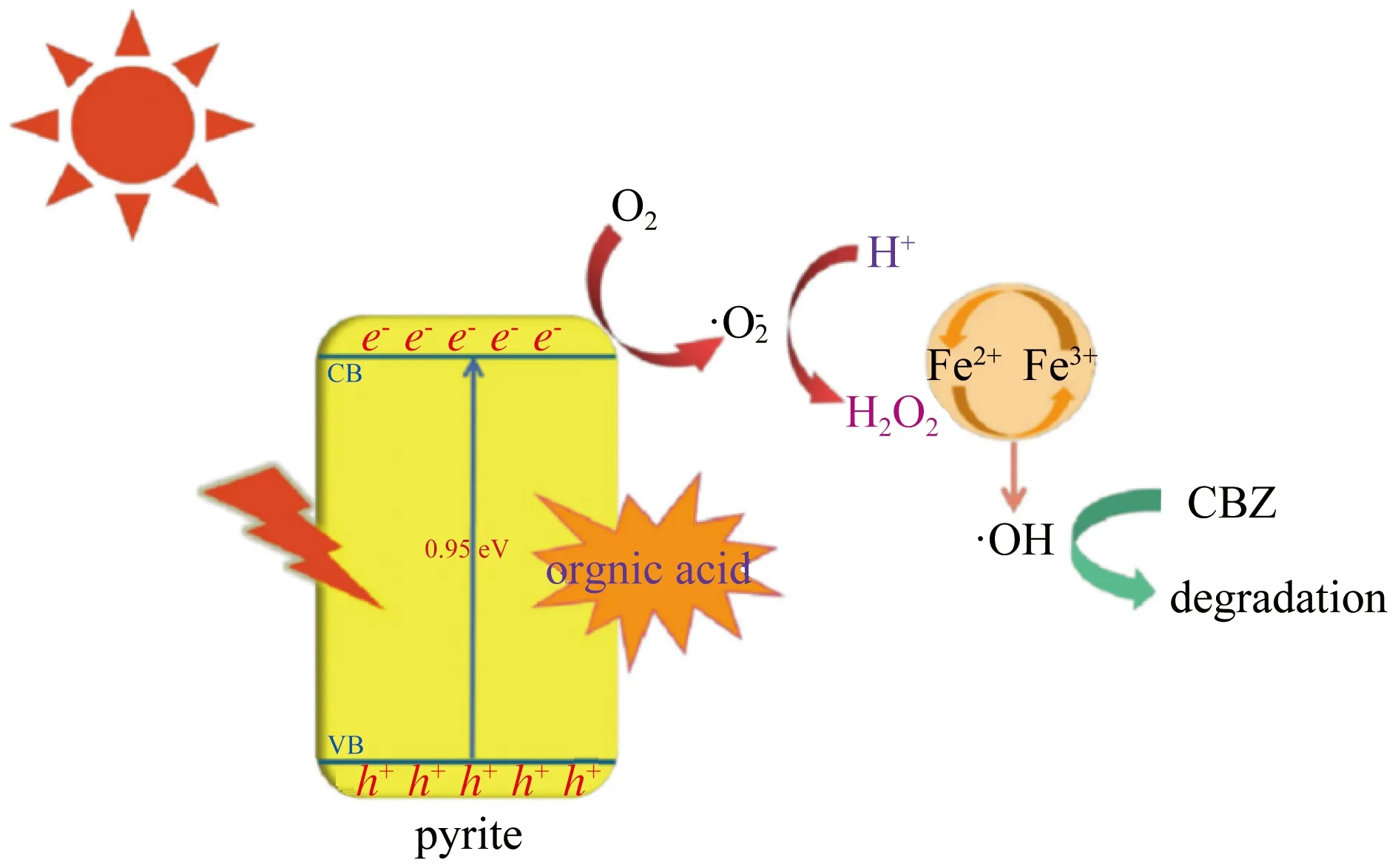
图10 硫铁矿基绿光Fenton体系机理[43]
如图11所示,Khataee等[44]利用氩等离子体从天然黄铁矿 (NP) 中制备出等离子体处理的黄铁矿 (PTP) 纳米结构,异相声Fenton法处理活性红84 (RR84)时,PTP的处理效果比NP提高约30%。主要操作参数的最佳用量为PTP 4 g/L,染料初始浓度10 mg/L,pH 5,反应时间120 min后超声功率300 W。
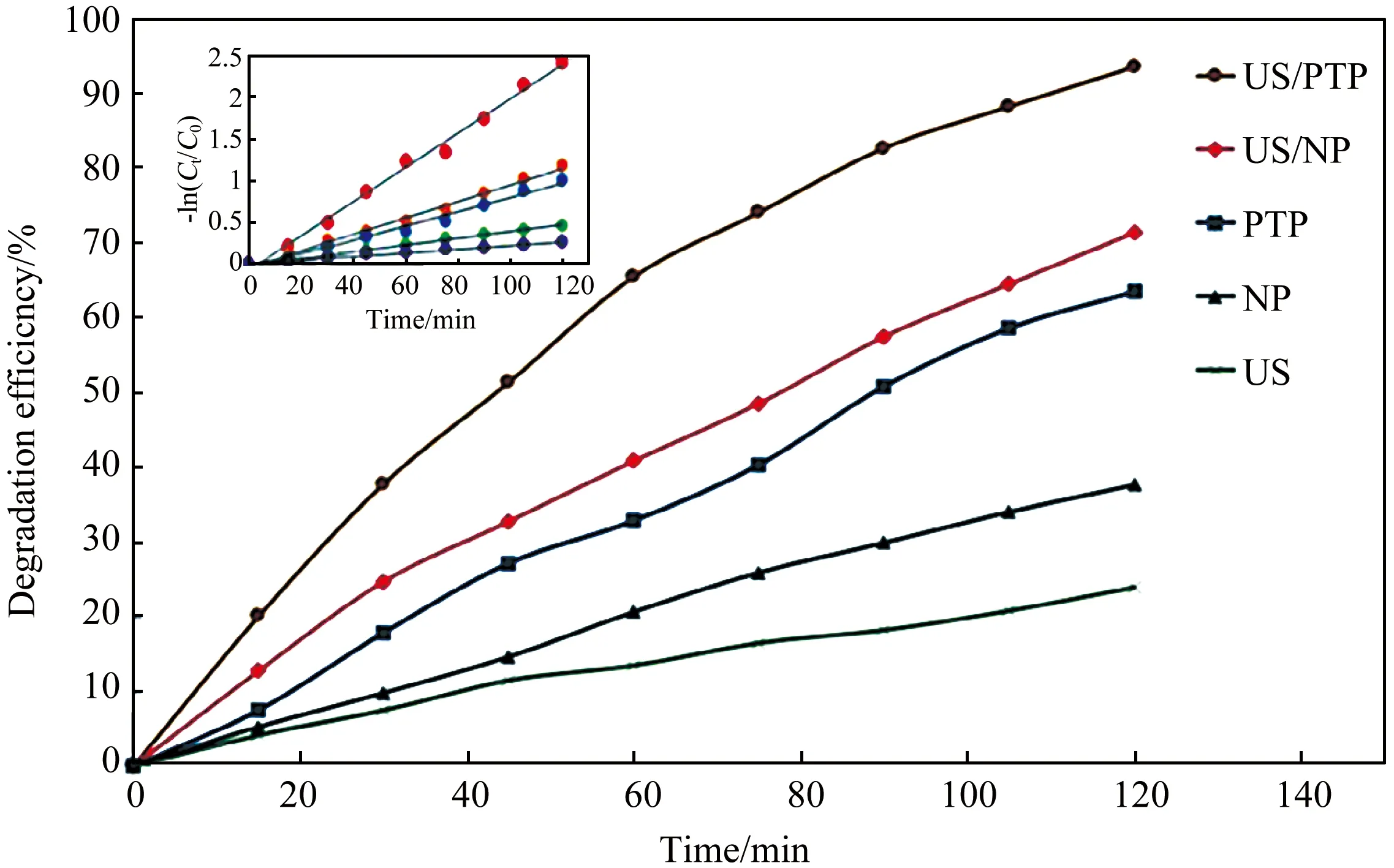
图11 不同工艺对RR84去除效率的比较;[RR84]0 = 10 mg/L,[PTP] = 4 g/L,超声波功率 = 300 W,pH = 5。插图显示提到的过程遵循伪一级动力学[44]
6 结论与展望
基于FeS2非均相Fenton反应可以将很多有机化合物如羧酸、醇、酚类氧化物化为无机态,反应具有去除难降解有机污染物的能力,在许多难降解工业废水处理方面有广泛应用。传统均相Fenton反应,将Fe2+作为催化剂,此时H2O2的利用率较低,且pH值需控制在2~5之间,低pH状态难以维持,操作困难,Fe2+的价格也较高,而在基于FeS2非均相类Fenton反应过程中几乎无需调整pH值,且替代合成FeS2的铁矿石价格较为低廉。所以现在很多研究将焦点集中在基于FeS2的非均相Fenton反应上,通过引入外场、改变催化剂载体、非均相Fenton反应过程中引入其他物质等方式。除了以上方式,在对FeS2的改性过程中,对FeS2本身的反应活性位点的探究,增大反应活性面积,寻求更多加快改善Fe(Ⅱ)/Fe(Ⅲ)循环方式,提高产生超氧自由基等方法可进一步提高H2O2的反应效率,使非均相类Fenton反应在处理难降解、成分复杂的工业废水处理得到进一步应用和推广。
此外,近年来在非均相类Fenton反应方面的一些新进展,包括构建双反应中心和合成单原子催化,可以显著提高非均相类Fenton反应活性。具有原子分布活性金属中心的单原子催化剂是近年来在各种催化反应中为获得最大原子效率而出现的一个新的研究前沿;但是,很少有研究涉及Fenton或类Fenton反应。一些过渡金属,如Fe、Co、Cu等,可以作为非均相Fenton或类Fenton催化剂,因为它们可以激发H2O2生成·OH。因此,含有这些具有均相活性金属中心的过渡金属的单原子催化剂可能是用于废水处理的新型且有效的非均相Fenton或类Fenton催化剂。
