模拟急进高原环境对糖尿病大鼠心肌损伤的影响
2022-11-18王潇永
高 燕,钟 萍,王潇永
(1.解放军联勤保障部队第九六○医院全科医学科,山东 济南 250031;2.解放军联勤保障部队第九六○医院卫勤部住培办,山东 济南 250031;3.山东中医药大学第一临床医学院,山东 济南 250014)
高原地区具有低氧、低气压、高寒等特殊生态环境特征,急性高原暴露时人体会产生高原反应[1-2]。急性高原病是在进入高原后的前几天出现头痛、头晕、恶心呕吐等临床表现,严重者会出现急性肺水肿、急性脑水肿甚至急性右心衰竭等危及生命的重症,而目前其关键发病机制存在争议,黄岚教授团队首次提出了高原“心”学说,揭示了急性高原病的发生机制,指出心血管系统在急进高原人群中是首先及首要响应的系统,提出“心血管响应异常学说”是急性高原病发生的核心机制[3]。2015~2017年我国18岁及以上人群糖尿病患病率为11.2%,糖尿病患者因高血糖、胰岛素抵抗、氧化应激、自噬、肾血管紧张素-醛固酮系统的激活等机制诱发心肌损伤[4]。而关于糖尿病患者急进高原环境时心肌损伤的机制尚不明确。鉴于我国庞大的糖尿病人群,进一步探讨糖尿病患者高原缺氧性心肌损伤的机制具有重要意义。本研究拟探讨糖尿病大鼠在模拟急进高原环境下的心肌损伤机制,以期为临床糖尿病患者急进高原环境下心血管风险的预防提供依据。
1 材料与方法
1.1 实验动物
8周龄SPF级雄性Wistar大鼠50只,体质量180~220 g,购自山东大学医学院实验动物中心,动物许可证号:SCXK(鲁)2019-0003,动物合格证号:370726210100677087。于动物实验室适应性喂养1周,自由饮水、进食。动物实验经解放军第九六○医院伦理委员会批准(2022年科研伦理审第28号)。
1.2 模型制备
采用随机数字表法将大鼠分为正常组(n=30)和糖尿病组(n=20)。正常组喂以基础饲料,糖尿病组喂以含有10%猪油、20%蔗糖的高脂高糖饲料,喂养6周后,糖尿病组大鼠腹腔注射链脲佐菌素30 mg/kg(用0.1 mol/L的枸橼酸缓冲液配制),正常组大鼠注射等剂量缓冲液。再喂养1周,禁食6 h,尾静脉采血检测空腹血糖(fasting blood-glucose,FBG),持续性FBG>11.1 mmol/L且伴有多食、多饮、多尿症状为2型糖尿病大鼠建模成功[5]。
1.3 分组
按照急进不同海拔高原环境分组:空白对照组(C组),10只正常大鼠,模拟海拔100 m、气压101.1 kPa、氧分压21.0 kPa的平原环境;3 700 m正常组(C37组),10只正常大鼠,模拟海拔3 700 m、气压64.1 kPa、氧分压13.4 kPa的高原环境;3 700 m糖尿病组(D37组),10只糖尿病大鼠,模拟环境同C37组;5 000 m正常组(C50组),10只正常大鼠,模拟海拔5 000 m、气压54.1 kPa、氧分压10.84 kPa的高原环境;5 000 m糖尿病组(D50组),10只糖尿病大鼠,模拟环境同C50组。模拟高原环境DY-2型小动物低压舱海拔上升速度为10 m/s[6],于各组入舱前及进入模拟环境6 h时测量心电图。
1.4 观察指标及方法
1.4.1 血液学指标检测 大鼠出舱后腹腔麻醉,开腹后经腹主动脉抽取动脉血2 mL行血气分析检测,包括pH值、二氧化碳分压(arterial carbon dioxide pressure,PaCO2)、动脉血氧分压(arterial partial pressure of oxygen,PaO2)、血氧饱和度(oxygen saturation,SpO2)等项目。
1.4.2 心肌损伤标志物检测 大鼠出舱后腹腔麻醉,开腹后经下腔静脉抽取静脉血2 mL,于-4 ℃、离心半径12 cm、2 500 r/min条件下离心10 min,取不溶血血清样品于-70 ℃冰箱保存,采用ELISA法检测血清心肌肌钙蛋白I(cardiac troponin I,cTnI)、肌酸激酶(creatine kinase,CK)及肌酸激酶同工酶MB(creatine kinase-MB,CK-MB)水平。
1.4.3 心肌组织形态学观察 麻醉处死大鼠,摘取心肌组织,0.9%氯化钠溶液清洗多余血液,于4%多聚甲醛溶液中固定,梯度乙醇脱水,二甲苯透明30 min,熔融石蜡包埋,自然凝固后制成石蜡切片。脱蜡、水洗后进行苏木素-伊红(hematoxylin and eosin,HE)染色、碘酸雪夫氏(periodic acid-Schiff,PAS)染色,光镜下观察各组心肌组织的病理改变。另取部分于4%多聚甲醛溶液中固定的心肌组织,参照TUNEL凋亡试剂盒说明书操作步骤,检测心肌组织中的凋亡心肌细胞,于免疫荧光显微镜下拍照观察各组心肌组织中心肌细胞凋亡情况,心肌凋亡细胞呈绿色荧光。
1.5 心肌lncRNA芯片分析
将上述大鼠新鲜心肌组织洗净残血后用滤纸吸干,随后各取0.5 g制备10%组织匀浆。剩余组织用生理盐水冲洗干净,放液氮或-80 ℃冰箱保存待检。使用Arraystar大鼠lncRNA芯片v2.0进行检测。从总RNA中提取mRNA,使用随机引物方法放大样品并转录成带荧光的cRNA。用RNA提取纯化试剂盒(美国Qiagen公司)纯化标记的cRNAs,并用Nano Drop ND-1000检测RNA量和质量,通过标准变性凝胶电泳评估RNA完整性,随后进行芯片杂交、洗脱、固定。采用DNA微阵列扫描仪(型号:G2505C,美国Agilent公司)扫描芯片获得原始数据图像,通过Agilent Feature Extraction软件采集芯片探针信号值,在Agilent Gene Spring GX软件中进行数据分析。经过标准化处理后,得出各组标记的信号差异比值(fold change,FC),筛选符合FC≥2.0、P<0.05条件的差异表达lncRNAs和mRNAs,将筛选出来的差异表达mRNAs进行基因功能注释,并进行KEGG富集分析。
1.6 统计学方法
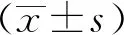
2 结果
2.1 各组大鼠进入模拟环境6 h后心电图比较
C组、C37组及C50组大鼠在各海拔环境下心电图变化不大,ST-T未见明显异常;D37组大鼠出现频发室性早搏,但ST-T无明显变化,D50组大鼠出现ST段压低,T波双向,R波波幅较前增高,提示有心肌缺血(图1)。
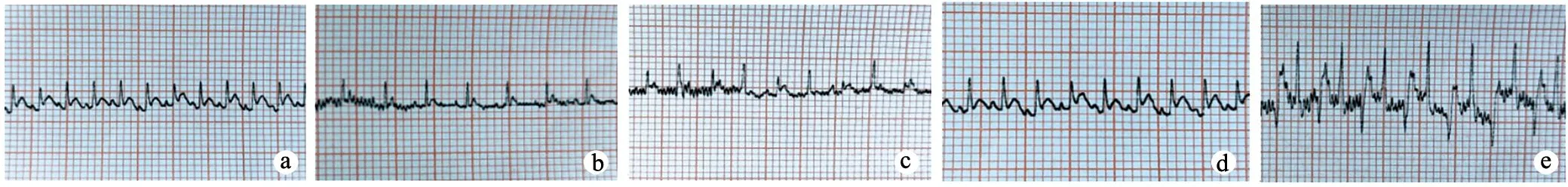
a:C组;b:C37组;c:D37组;d:C50组;e:D50组
2.2 各组大鼠进入模拟环境6 h后血气分析结果比较
与C组、C37组及C50组大鼠相比,D37组及D50组大鼠的pH值均显著下降,差异有统计学意义(P<0.05);C37组大鼠的PaCO2水平较C组升高,差异有统计学意义(P<0.05),C50组大鼠的PaCO2水平接近C组,2组比较差异无统计学意义(P>0.05),而D37组和D50组大鼠的PaCO2水平低于C组、C37组及C50组,差异均有统计学意义(P<0.05);D37和D50组大鼠PaO2水平低于C组、C37组及C50组,差异有统计学意义(P<0.05);各组间SpO2比较,差异均无统计学意义(P>0.05),见表1。

表1 各组大鼠进入模拟环境6 h后血气分析结果
2.3 各组大鼠进入模拟环境6 h后心肌酶谱比较
心肌酶谱测定结果显示,与C组相比,C37组、D37组、C50组及D50组大鼠CK、CK-MB与cTnI水平均明显升高,差异有统计学意义(P<0.05);与C37组、D37组及C50组相比,D50组大鼠CK水平显著升高(P<0.05);D37组、D50组大鼠CK-MB水平均较C组、C37组及C50组大鼠显著升高(P<0.05);与C组、C37组及D37组比较,D50组大鼠cTnI水平显著升高(P<0.05);但C50组与D50组cTnI水平比较,差异无统计学意义(P>0.05),见表2。
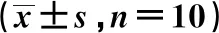
表2 各组大鼠进入模拟环境6 h后心肌酶谱结果
2.4 各组大鼠进入模拟环境6 h后心肌组织形态学变化情况
2.4.1 各组大鼠心肌组织HE染色比较 C组大鼠心肌细胞排列整齐,结构清晰;C37组和C50组大鼠心肌细胞结构较清晰,排列尚规整;D37组大鼠心肌细胞轻度肿胀,结构紊乱;D50组大鼠心肌细胞显著肿胀,结构紊乱,有炎性细胞浸润,见图2。
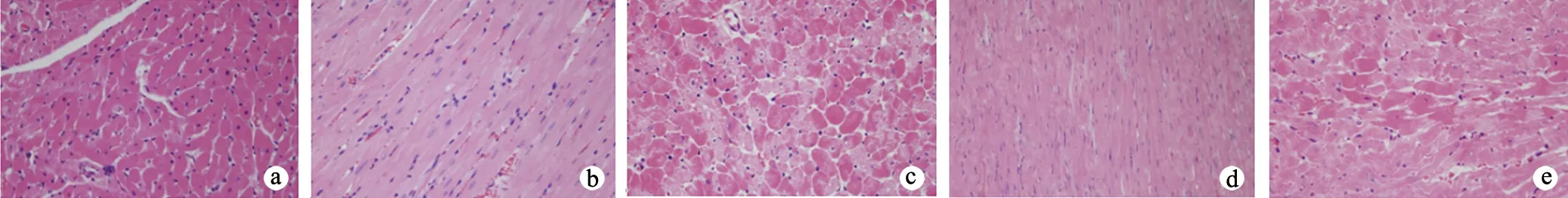
a:C组;b:C37组;c:D37组;d:C50组;e:D50组
2.4.2 各组大鼠心肌组织PAS染色比较 C组大鼠心肌组织红色糖原极少;C37组大鼠心肌组织淡染,红色糖原阳性染色区极少;D37组大鼠心肌组织中可见多处片状紫红色染色区,提示糖原阳性物质沉积较多;C50组大鼠心肌组织淡染,可见少量紫红色染色区,糖原阳性物质沉积较C37组增加,但少于D37组;D50组视野可见大片紫红色染色区,糖原阳性物质沉积较D37组更多,见图3。
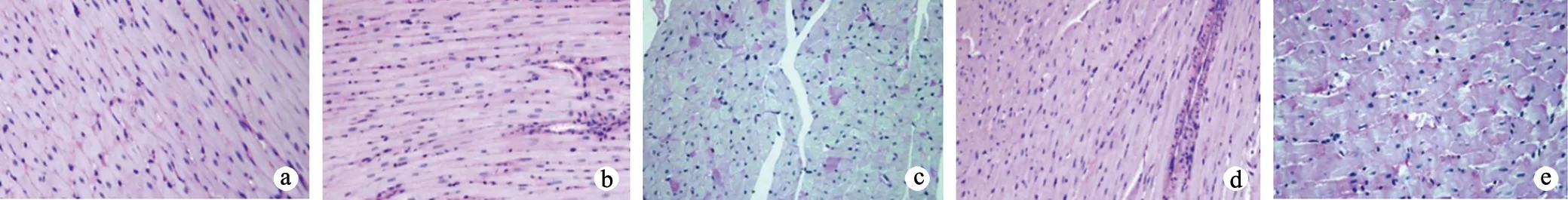
a:C组;b:C37组;c:D37组;d:C50组;e:D50组
2.4.3 各组大鼠心肌组织TUNEL染色比较 TUNEL染色后免疫荧光显微镜下观察,C组、C37组及C50组TUNEL阳性细胞极少;与C组、C37组及C50组比较,D37组TUNEL阳性细胞比例升高,提示出现细胞凋亡;与C组、C37组、C50组及D37组比较,D50组可见大量绿色荧光细胞,TUNEL阳性细胞比例显著升高,细胞凋亡程度最重,见图4。

a:C组;b:C37组;c:D37组;d:C50组;e:D50组;f:各组凋亡率比较 *:与C组比较,P<0.05;#:与C37组比较,P<0.05;△:与D37组比较,P<0.05;▲:与C50组比较,P<0.05
2.5 心肌lncRNA芯片分析
2.5.1 差异表达的lncRNA 心肌lncRNA芯片分析显示,D37组与C37组差异表达的lncRNA有62条上调基因(包括Zbtb20、Sorbs2、Ksr1、Cacna2d1等基因)和38条下调基因(包括Myo19、Mir1b、Itga9等基因),这些基因参与调控细胞对葡萄糖刺激的反应,作用于Notch信号通路的上游或内部,调控线粒体和肌动蛋白的活动;D50组与C50组差异表达的lncRNA有53条上调基因(包括Myh7、Adra1b、Cacna2d1等基因)和47条下调基因(包括Mybph、Synpo2、Prex2等基因),这些基因共同调控α1-肾上腺素受体、肌动蛋白活性、压力诱导的心肌肥大等。
2.5.2 mRNA差异表达基因的KEGG富集分析 与C50组相比,D50组大鼠中差异表达的mRNA基因主要涉及肥厚性心肌病、扩张性心肌病、心肌收缩、心肌肥大相关的肾上腺素能信号通路等,这些信号通路主要涉及Myh6、Myh7、Actc1、Atp2a2和Cacng2等基因(表3)。

表3 D50组和C50组mRNA差异表达基因的KEGG分析
3 讨论
高原地区由于低温、低氧和低气压的特殊地理环境,可引起机体心肌组织产生氧化应激反应、体内活性氧堆积和超氧化物岐化酶产生不足,同时,缺氧会导致心肌组织的Na泵障碍和炎性细胞浸润,进而导致心肌损伤[7-9]。既往研究表明,糖尿病大鼠在病程4~12周时会出现心功能改变,在8~12周时会出现心肌超微结构改变,病程超过12周会出现心脏结构和功能损伤[10]。而糖尿病大鼠在模拟急进高原环境时心肌损伤的机制仍不明确。本研究发现糖尿病大鼠在模拟3 700 m和5 000 m两种海拔高度的环境下,心肌组织细胞凋亡和炎性细胞浸润显著增加,同时激活了诱导心肌细胞肥大的相关基因,较正常大鼠更容易出现心肌损伤。
血气分析可快速反映机体缺氧程度和酸中毒情况。本研究结果显示,在模拟急进高原环境后,D37组和D50组大鼠PaO2水平低于C组、C37组和C50组;C37组大鼠PaCO2水平较C组高,而C50组大鼠PaCO2水平与C组接近,造成这种差异的原因尚需进一步研究明确。D37组和D50组大鼠PaCO2水平较其他组显著下降,考虑与糖尿病大鼠对环境变化的耐受性更差有关,各项指标于海拔3 700 m时即开始出现异常,海拔5 000 m时变化最大,pH值和PaO2水平均显著下降,这也是糖尿病大鼠更容易出现心肌损伤的原因。但因为氧离曲线在PaO2>60 mmHg时趋于平坦,SpO2变化不大,所以各组间SpO2比较差异无统计学意义。
CK-MB和cTnI是评价急性心肌损伤的敏感指标[11-12]。本研究结果显示,正常大鼠和糖尿病大鼠在海拔3 700 m与5 000 m时CK、cTnI和CK-MB水平均显著升高,提示发生了心肌损伤。D37组、D50组大鼠CK-MB水平较C组、C37组及C50组大鼠均显著升高;与C组、C37组及D37组比较,D50组大鼠cTnI显著升高,但C50组与D50组cTnI水平比较,差异无统计学意义,提示糖尿病大鼠在急进高原环境时心肌损伤较正常大鼠更为严重,与文献报道一致[13]。
本研究观察了大鼠心肌组织病理形态学改变,结果显示,与其他组相比,D50组心肌组织HE染色可见心肌细胞肥大、排列紊乱,有炎性细胞浸润;PAS染色可见心肌组织内大量糖原阳性物质沉积;TUNEL染色在免疫荧光显微镜下观察到的凋亡细胞比例更高,证明随着模拟海拔的升高,糖尿病大鼠发生心肌损伤的概率也增加。
lncRNA作为具有多种生物学功能的重要调控因子,可灵敏地反映生物体内的早期病理改变。本研究结果显示,与正常大鼠相比,D37组和D50组糖尿病大鼠的Zbtb20、Sorbs2、Ksr1、Cacna2d1、Myh7和Adra1b等lncRNA会随着海拔升高而上调。而Myo19、Mir1b、Itga9、Mybph、Synpo2和Prex2等基因下调提示调控α1-肾上腺素受体、肌动蛋白活性、压力诱导的心肌肥大等是糖尿病大鼠急进高原状态下心肌损伤发生的主要靶点。通过KEGG富集分析发现,差异表达的mRNA主要涉及肥厚性心肌病、扩张性心肌病、心肌收缩等信号通路。在这些通路中,以Myh6、Myh7、Actc1、Atp2a2、Cacng2等基因富集度最高。Myh6是肌肉肌球蛋白复合物的一部分,与心脏传导疾病和固有心肌病相关[14];Myh7是一个重要的心肌肥大的标志[15];Actc1与肌球蛋白结合活性相关,参与心肌收缩[16];Atp2a2参与心肌细胞膜电位的P型钙转运蛋白活性以及心肌收缩的调节[17];Cacng2可以增加Caspase3的表达,促进心肌细胞凋亡[18]。这些基因表达的变化表明急进高原状态会诱导糖尿病大鼠心肌肥大相关基因的激活,促发心肌细胞肥大、心室重构的启动,进而增加心衰、心律失常等的发生。
本研究探讨了模拟急进高原环境对糖尿病大鼠心肌损伤的影响,并探讨了诱发心肌损伤的可能机制,提出Myh6、Myh7和Actc1等基因参与了心肌损伤的启动,但这些基因诱导心肌损伤的作用机制尚需进一步研究探讨。提示临床糖尿病患者应接受更严密的健康监测,避免过快进入高原地区,同时,需进一步开展针对糖尿病患者急进高原环境的预防策略研究。