超高效液相色谱-串联质谱法同时测定血液和尿液中10种2C系列苯乙胺类衍生物
2022-11-18李锦昌何洪源张云峰王瑞花
李锦昌,何洪源,张云峰,王瑞花*
(1.中国人民公安大学 侦查学院,北京 100038;2.公安部物证鉴定中心,北京 100038)
苯乙胺类衍生物是一类重要的精神活性物质,是在苯乙胺的结构基础上设计出的具有致幻或致幻和兴奋双重作用的物质,根据结构特点可分为两大类。其中一类是2C系列苯乙胺类衍生物(即二甲氧基苯乙胺衍生物),又称2C系列化合物,最早在20世纪70年代由Alexander Shulgin合成,其苯乙胺苯环的2和5位有2个甲氧基取代,4位有1个取代基[1]。术语“2C”,表示所合成的致幻剂苯乙胺类衍生物的苯环和胺基之间的2个碳原子[2]。最早出现的2C系列衍生物为2C-B,之后出现了2C-C、2C-I和2C-T-2、2C-T-7等,2010年出现了称为NBOMe的新型2C系列化合物[3]。2C系列化合物能产生与麦角二乙酰胺类似的强致幻效果,已有多种2C系列化合物被多个国家管制,在我国目前被管制的有13种[4]。
国外有关2C系列苯乙胺类衍生物的相关文献较多,包括检验方法及体内外代谢研究,常用的前处理技术主要有液-液萃取(LLE)[5-6]和固相萃取(SPE)[7-8],分析方法以气相色谱-质谱法(GC-MS)[9-10]和液相色谱-串联质谱法(LC-MS/MS)[11-13]为主。体外代谢以肝微粒体[14-16]和人肝细胞[17-18]进行研究,体内代谢多在小鼠和大鼠体内进行[15,19-20],通过体内外的研究并结合实际案件检材进行确证[21]。随着2C系列化合物的更新换代,近年来报道的多为NBOMe化合物[12-13,22-23]。国内的相关研究很少,主要集中在体外样品[24],或单个2C类物质的检测方法[25]。本文以我国管制的10种2C系列化合物为研究对象,建立了一种超高效液相色谱-串联质谱(UPLC-MS/MS)方法,用于检测血液和尿液中常见的10种2C系列化 合 物,包 括2C-H、2C-D、2C-P、2C-T-2、2C-T-4、2C-T-7、25D-NBOMe、25CNBOMe、25B-NBOMe和25I-NBOMe(结构式见图1)。该方法简便、快速,结果准确、可靠,灵敏度高,重复性好,能快速检测血液和尿液中的2C系列化合物,满足目前的案件检验需求。

图1 10种2C系列化合物的化学结构Fig.1 Chemical structures of 10 2C-series phenethylamines
1 实验部分
1.1 仪器与试剂
超高效液相色谱-串联质谱仪(Acquity UPLC Xevo TQ MS,美国Waters公司),Masslynx工作站(美国Waters公司),Milli-Q纯水系统(美国Millipore公司),BP210s电子天平(德国Sartorius公司),Thermo PRIMO R型高速离心机(上海创萌生物科技有限公司),Vortex Genie-2涡旋混合器(美国Scientific Industries公司),HGC-12型氮吹仪(美国PerkinElmer公司),Oasis®PRiME HLB固相萃取柱(150 mg/3 mL,美国Waters公司)。
10种2C系列化合物标准品(质量浓度:100 μg/mL,天津阿尔塔科技有限公司),甲醇、乙腈和甲酸铵(色谱纯,国药集团化学试剂北京有限公司)。实验用水为去离子水,其余试剂均为分析纯。空白血液、尿液来自健康的志愿者。
1.2 标准溶液配制
将10种2C系列化合物标准品分别置于棕色样品瓶中。分别取10种标准品100 μL,用甲醇定容至1 mL,得到质量浓度为10 μg/mL的单标储备液;将10种单标储备液分别用甲醇稀释并配制成1 μg/mL、100 ng/mL的混合标准储备液,冷冻保存。实验过程中根据需要用甲醇逐级稀释。
1.3 样品前处理
取0.5 mL空白血液或尿液于15 mL塑料离心管中,加入2 mL甲醇,涡旋混匀30 s,振荡10 min,以8 000 r/min离心10 min后取1 mL上清液,过0.22 μm有机膜后,待分析。
1.4 实验条件
1.4.1 色谱条件ACQUITY UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相:A为甲醇,B为水(0.1%甲酸),流速:0.4 mL/min;柱温:35℃;进样量:2 μL。梯度洗脱程序:0~0.2 min,10%A;0.2~5.0 min,10%~90%A;5.0~6.1 min,90%A;6.1~6.5 min,90%~10%A。总运行时间为6.5 min。
1.4.2 质谱条件采用电喷雾电离正离子扫描模式(ESI+),多反应监测模式(MRM)检测,毛细管电压为1.5 kV,脱溶剂气温度为400℃,脱溶剂气流速为900 L/h,锥孔气流速为50 L/h。10种化合物的定性离子、定量离子、锥孔电压、碰撞能量见表1。

表1 10种2C系列化合物的保留时间及质谱参数Table 1 Retention times and MS spectrum parameters for 10 2C-series phenethylamines
1.5 数据处理
图谱的采集及定性分析采用MassLynx V4.1软件,实验数据采用Excel 2019和Origin 2021软件进行处理。
2 结果与讨论
2.1 质谱条件的优化
根据10种2C系列化合物的结构特点,选择电喷雾正离子电离模式(ESI+)进行检测。按照“1.2”方法分别配制100 ng/mL的10种化合物单标溶液,分别注入质谱仪中。开启自动调谐功能,采用仪器自动优化得到10种2C系列化合物的锥孔电压、碰撞电压、驻留时间等参数,结果见表1。
2.2 色谱条件的优化
考察了ACQUITY UPLC®HSS T3(100 mm×2.1 mm,1.8 μm)、ACQUITY UPLC®BEH C18(100 mm×2.1 mm,1.7 μm)、ACQUITY UPLC®BEH HILIC(100 mm×2.1 mm,1.7 μm)3种色谱柱的分离效果。结果表明,ACQUITY UPLC®BEH C18柱和ACQUITY UPLC®HSS T3柱均能够分离10种2C系列化合物,但C18柱对目标物的分离效果更好,响应值和灵敏度更高,因此选用ACQUITY UPLC®BEH C18柱。实验考察了乙腈-水(0.1%甲酸)、甲醇-水(0.1%甲酸)、乙腈-水(0.1%甲酸,2 mmol/L甲酸铵)、甲醇-水(0.1%甲酸,2 mmol/L甲酸铵)分别为流动相时10种化合物的分离情况。结果显示,以甲醇-水(0.1%甲酸)和甲醇-水(0.1%甲酸,2 mmol/L甲酸铵)作为流动相均可较好地改善大部分目标物的分离效果与色谱峰形,以后者作为流动相时各化合物的保留时间相对靠后。因此,实验最终选择ACQUITY UPLC®BEH C18柱,流动相为甲醇-水(0.1%甲酸)。在优化的色谱条件下,10种2C系列化合物的提取离子流图(XIC)见图2。

图2 10种2C系列化合物的提取离子流图(100 ng/mL)Fig.2 Extracted ion chromatograms of 10 2C-series phenethylamines(100 ng/mL)
2.3 前处理条件的优化
以回收率和基质效应为指标,比较了沉淀蛋白法(PPT)、液-液萃取法、固相萃取法对血液、尿液中质量浓度为100 ng/mL的10种2C系列化合物混合标准溶液的提取效果。
沉淀蛋白法:甲醇沉淀蛋白见“1.3”方法;乙腈沉淀蛋白法:取0.5 mL空白血液、尿液,加入2 mL乙腈于15 mL塑料离心管中,涡旋混匀30 s,振荡10 min,以12 000 r/min离心10 min后取1 mL上清液,过0.22 μm有机滤膜后待分析。
液-液萃取法:取0.5 mL空白血液、尿液,加入2 mL乙酸乙酯于15 mL塑料离心管中,涡旋混匀30 s,振荡10 min,以8 000 r/min离心10 min,将上清液转移至10 mL尖底玻璃管中,空气流下吹干,用0.5 mL甲醇定容,过0.22 μm有机滤膜后待分析。
固相萃取法:取0.5 mL空白血液、尿液,加入2 mL水稀释,并置于15 mL塑料离心管中,涡旋混匀30 s,振荡10 min,以8 000 r/min离心10 min。Oasis®PRiME HLB固相萃取柱依次经3 mL甲醇和3 mL水活化。取离心后的上清液过HLB柱,用1.5 mL 10%甲醇水溶液淋洗,1.5 mL乙腈-甲醇(9∶1,体积比)混合溶剂洗脱。收集洗脱液,空气流下挥干,用0.5 mL甲醇定容,过0.22 μm有机滤膜后待分析。
不同前处理方法下的基质效应和回收率如图3所示。结果显示,LLE和SPE的回收率较低,基质效应严重。而沉淀蛋白法操作简单快速,基质干扰小,且回收率高。本实验还比较了甲醇和乙腈分别作为沉淀蛋白法的有机溶剂对于血液、尿液中2C系列化合物的萃取效果,发现甲醇沉淀蛋白法对目标物的回收率优于乙腈沉淀蛋白法。故选择甲醇沉淀蛋白法进行前处理。

图3 空白血液中10种2C系列化合物在不同前处理条件下的基质效应(A)和回收率(B)Fig.3 Matrix effects(A)and recoveries(B)of 10 2C-series phenethylamines in blank blood under different preparation conditions
2.4 方法学验证
2.4.1 基质效应基质效应(ME)是指基质中干扰物会影响目标化合物的离子化效率,使目标化合物在分析仪器上的响应受到增强或抑制作用。实验对目标分析物在不同基质中的基质效应进行评价,分别测定了低(1 ng/mL)、中(5 ng/mL)、高(20 ng/mL)浓度下混合标准溶液的色谱峰面积(S1),以及空白血液或空白尿液按“1.3”方法前处理后的上清液中分别添加低、中、高浓度混合标准溶液所得的色谱峰面积(S2),通过其比值(S2/S1)评估基质效应。结果表明,不同质量浓度的2C系列化合物质控样本的基质效应为71.9%~112%,基质效应在可接受的范围内,满足检测要求。
2.4.2 线性关系、检出限与定量下限在空白血液、空白尿液中添加不同浓度的混合标准溶液,配制成质量浓度范围为0.005~50 ng/mL的加标样品,采用“1.3”方法进行前处理后上机检测,并以定量离子对的峰面积(y)和目标分析物的添加浓度(x,ng/mL)绘制线性曲线。结果显示,血液、尿液中10种2C系列化合物在0.005~50 ng/mL范围内线性关系良好,相关系数(r2)为0.995 8~0.999 9。将空白样品添加低浓度的混合标准溶液按照“1.3”方法进行样品前处理后上机检测,以定量离子对3倍信噪比(S/N)时的响应值对应的样品质量浓度作为检出限(LOD),以10倍S/N的响应值对应的样品质量浓度作为定量下限(LOQ)。10种化合物在血液和尿液中的LOD分别为0.01~2 ng/mL和0.002~5 ng/mL,LOQ分别为0.02~5 ng/mL和0.005~10 ng/mL(见表2)。

表2 不同基质中10种2C系列化合物的线性方程、相关系数、检出限和定量下限Table 2 Linear equations,correlation coefficients,LODs and LOQs for 10 2C-series phenethylamines in different matrixs
2.4.3准确度与精密度取空白血液和空白尿液,添加适量的混合标准溶液,配制成质量浓度分别为1、5、20 ng/mL的待测样品,每个浓度水平配制3个平行样。提取回收率通过测定空白血液或空白尿液在前处理之前添加对应浓度混合标准样品的峰面积(S3)与其在前处理之后添加对应浓度混合标准样品的峰面积(S4)的比值(S3/S4)进行计算。日内精密度由一天内不同时间下重复实验6次进样检测,日间精密度由连续3天重复进样检测,以相对标准偏差(RSD)表示日内、日间精密度。结果显示:在1、5、20 ng/mL加标水平下,血液中10种化合物的提取回收率为78.8%~94.7%,RSD为0.55%~15%;尿液中的提取回收率为79.8%~99.3%,RSD为0.44%~15%。表明本方法具有较高的准确度和精密度。尿液中10种2C系列化合物的回收率和RSD见表3。
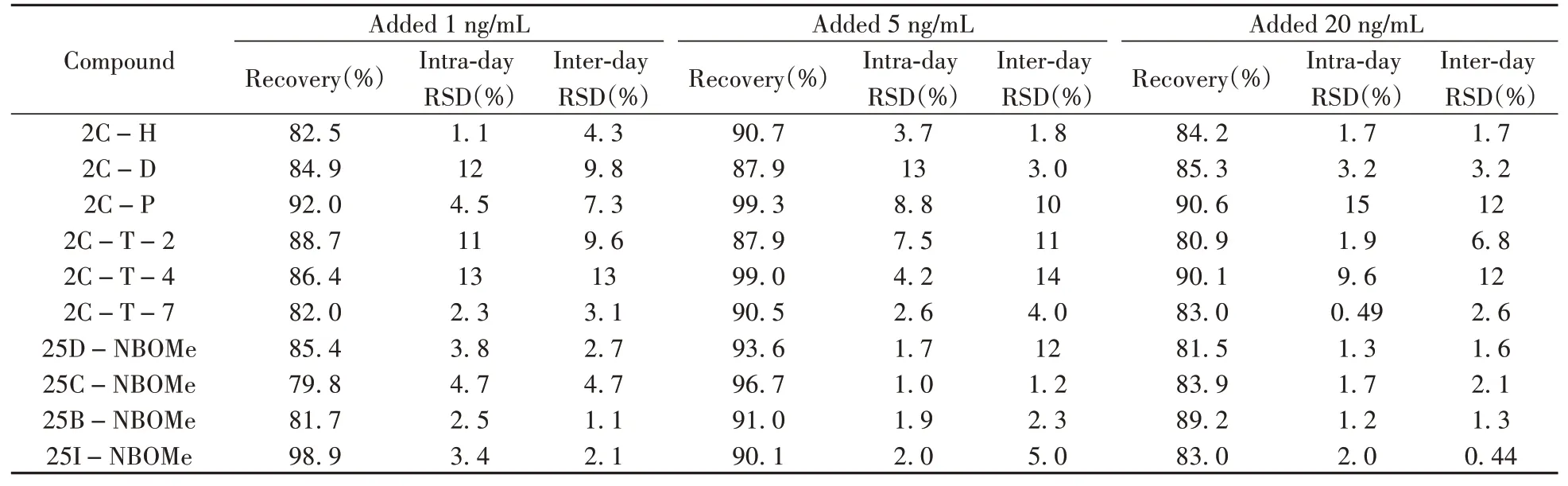
表3 尿液中10种2C系列化合物的回收率和日内、日间精密度(n=3)Table 3 Recoveries,intra-day and inter-day precisions of 10 2C-series phenethylamines in urine(n=3)
2.5 方法应用
为验证本方法的实用性,选取两只雄性小鼠a、b,体重(200±20)g。在控制温度(22±2)℃和湿度30%~70%的情况下,向小鼠a投喂含0.2 mg/kg 10种目标化合物的食物,小鼠b作为空白对照。2 h后,分别取两只小鼠血液各0.5 mL、尿液各0.5 mL,按照本方法进行检测。小鼠a的血液中检出2C-H、2C-D、2C-P、2C-T-2、2C-T-4、2C-T-7、25D-NBOMe、25C-NBOMe、25BNBOMe、25I-NBOMe,质 量 浓 度 分 别 为5.7、3.2、0.4、5.9、3.3、9.9、14.3、10.4、13.9、12.3 ng/mL;尿液中检出上述化合物的质量浓度分别为3.2、3.4、1.3、2.1、3.8、9.7、11.5、8.2、11.6、13.2 ng/mL;小鼠b的血液和尿液中未检出10种目标化合物。结果表明,该方法可以满足血液、尿液检材中10种目标化合物的同时检测要求。
3 结论
本研究针对法医毒理学鉴定中常规的生物样品血液和尿液,建立了基于超高效液相色谱-串联质谱检测生物样品中10种2C系列化合物的分析方法。实验通过对3种前处理方法的比较,确定采用甲醇沉淀蛋白作为前处理方法,通过对液相色谱与质谱检测条件的优化,得到了较低的检出限和定量下限。经方法学验证,该方法操作简便,取样量少,灵敏度高,适用于血液、尿液中10种2C系列化合物的同时快速检测。
