维布妥昔单抗及靶向CD30 的嵌合抗原受体T 细胞在淋巴瘤治疗中的研究进展
2022-11-18叶茗雨于洁尘杨建民
叶茗雨,王 桃,于洁尘,杨建民
海军军医大学(第二军医大学)第一附属医院血液内科,上海 200433
CD30 是一种受激活诱导的细胞表面抗原,属于TNF 受体超家族。CD30 在正常活化的淋巴细胞表面低表达,但在某些血液系统恶性肿瘤如经典型霍奇金淋巴瘤(classical Hodgkin lymphoma,cHL)、间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)等细胞表面高表达,因此成为治疗淋巴瘤的靶抗原之一[1]。Slack 等[2]和Sabattini 等[3]研究了CD30 在淋巴瘤中的表达情况,发现所有的cHL 和ALCL 细胞表面均可见CD30 表达,外周T 细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)非特指型、蕈样霉菌病、血管免疫母细胞性T 细胞淋巴瘤、弥漫大B 细胞淋巴瘤中CD30 表达的阳性率分别为64%、59%、43%和25%。
CD30 单克隆抗体与CD30 结合后迅速内化,形成内涵体进入肿瘤细胞而诱导细胞凋亡。将小分子细胞毒药物与CD30 抗体偶联后,小分子细胞毒药物也能转移到肿瘤细胞内部。因此,CD30 介导的内化作用为靶向CD30 的抗体偶联药物治疗淋巴瘤奠定了理论基础[1]。
维布妥昔单抗(brentuximab vedotin,BV)是由人源靶向CD30 单克隆抗体、小分子细胞毒药物单甲基澳瑞他汀E(monomethyl auristatin E,MMAE)和连接两者的二肽(瓜氨酸-缬氨酸)接头组成的新型抗肿瘤药物。该二肽接头在血浆中可稳定存在,但经受体介导的内化作用进入细胞后可被溶酶体蛋白酶水解从而释放出MMAE。MMAE通过阻止微管蛋白聚合抑制细胞分裂,导致细胞生长停滞、诱导细胞凋亡[4]。BV 将单克隆抗体的高特异性与小分子细胞毒药物的高活性相结合,具有减毒、增效的特点,其疗效及安全性已在CD30 阳性淋巴瘤治疗中获得验证[5]。
1 BV 治疗淋巴瘤的研究进展
1.1 复发或难治性cHL 随着化学治疗方案的不断改进,晚期cHL 的治疗取得了显著进展,但治疗有效率的提高也会增加相应的毒性[5]。来自不同中心的化学治疗方案见表1[6-10],其中Straus 等[10]的ECHELON-1(NCT01712490)研究可能是突破这种模式的第1 个进展。
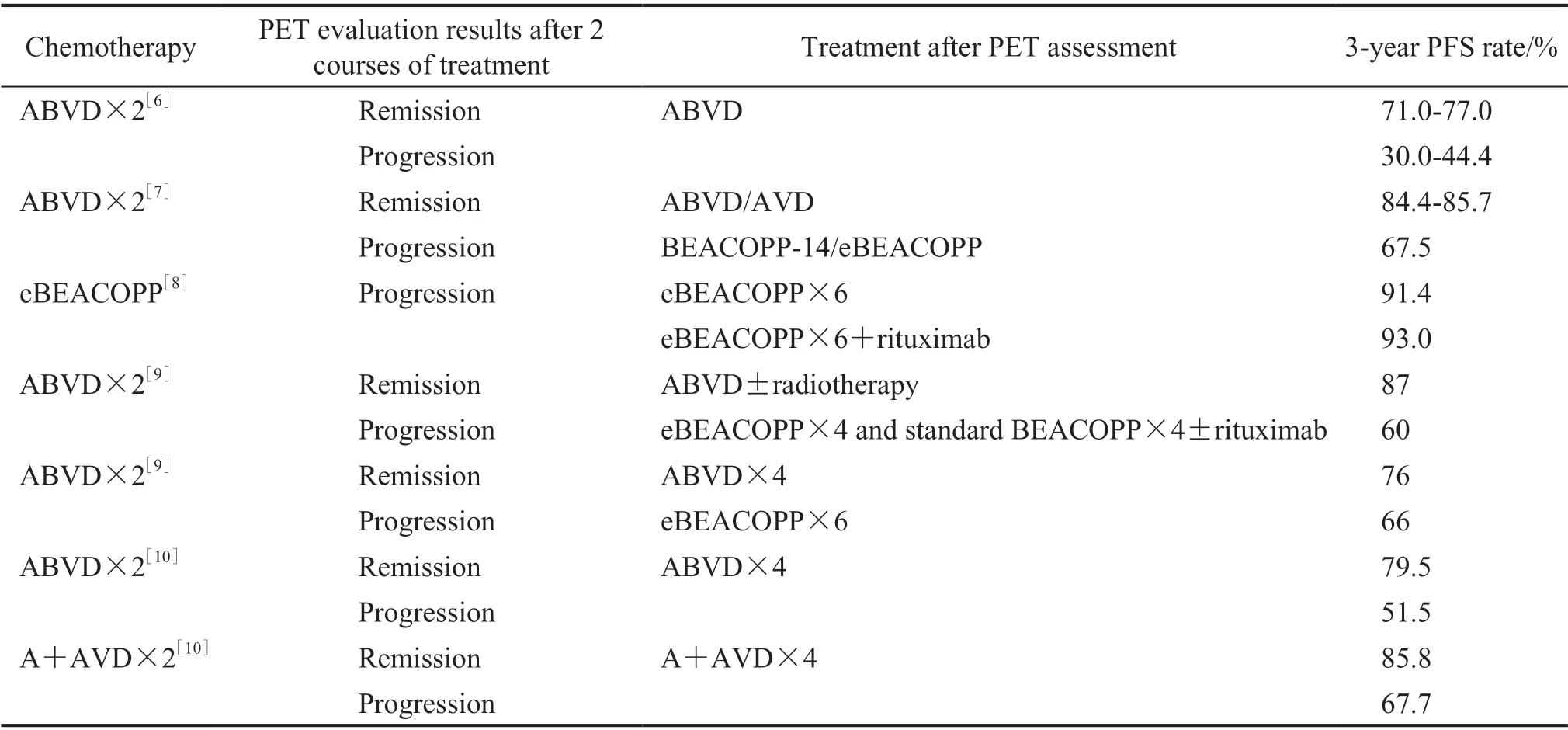
表1 复发/难治性经典型霍奇金淋巴瘤治疗方案比较Tab 1 Comparison of treatment regimens for relapsed/refractory classical Hodgkin lymphoma
在ECHELON-1 研究中,将晚期cHL 患者随机分为ABVD(多柔比星+博来霉素+长春碱+达卡巴嗪)和A+AVD(BV+多柔比星+长春碱+达卡巴嗪)两组。2 个疗程后影像学评估结果无论为肿瘤进展还是缓解,A+AVD 组的5 年无进展生存(progress free survival,PFS)率高于ABVD 组(82.2% vs 75.3%,P=0.001 7);在2 个疗程后影像学评估结果为肿瘤进展的患者中,A+AVD 组的PFS 率达到ABVD 组2 个疗程后改用eBEACOPP的患者水平[11]。
ECHELON-1 研究表明,用BV 替换博来霉素降低了后者的肺毒性反应。A+AVD 组与ABVD组3 级及以上毒性反应发生率分别为中性粒细胞减少症54%、39%,周围神经病变4%、1%,腹痛3%、1%,感染性死亡1.1%、0,肺毒性死亡0、1.7%。其中A+AVD 组所有感染性死亡均发生在中性粒细胞减少之前未接受生长因子治疗的患者中。在为期3 年的随访中,A+AVD 组周围神经病变和1 级、2 级、3 级及以上残留毒性反应的发生率分别为25.6%、14.2%、7.8%、2.7%,ABVD 组分别为11.5%、7.3%、3.6%、<1%。这些结果表明如果用生长因子控制感染并发症,A+AVD 方案的毒性反应增加程度较小,且疗效较高[10-11]。
1.2 ALCL PTCL 隶属于成熟T/自然杀伤细胞的非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),在西方国家其占NHL 的5%~10%,在亚洲和南美洲的占比较高(15%~20%)[12-13]。ALCL 约占全部PTCL 的12%[14],由德国病理学家Stein 等 于1985 年 应 用Ki-1(CD30)抗 体 识别出来,因细胞呈间变性特征而命名为ALCL。ALCL 只包括T 细胞表型和Null(非B 细胞、非T细胞)表型。目前尚未对T 细胞淋巴瘤的最佳一线治疗方案达成共识,由环磷酰胺、多柔比星、长春新碱和泼尼松构成的CHOP 方案被广泛采用,但疗效并不理想。一项meta 分析显示,PTCL 患者中使用CHOP 或类似CHOP 方案者5 年总生存率仅为38.5%[15]。在CHOP 方案基础上添加其他化学治疗药物构成的增强方案因毒性反应较大而在临床上使用有限[16-17]。
在一项Ⅱ期临床研究中,将BV 作为单一药物治疗复发或难治性系统性ALCL 患者疗效显著,客观缓解率(objective response rate,ORR)为86%,完全缓解率(complete remission rate,CRR)为57%[18]。随后Fanale 等[19]进行的一项Ⅰ期临床试验表明,BV 与环磷酰胺、多柔比星和泼尼松构成的联合治疗方案(A+CHP 方案)能改善治疗效果,26 例CD30 阳性PTCL 患者的ORR为100%,CRR 为88%,1 年PFS 率为71%。
ECHELON-2 研究比较了CHOP 方案和A+CHP方案治疗初始期CD30 阳性PTCL 患者(系统性ALCL 亚型占70%)的疗效。A+CHP 组和CHOP组的5 年PFS 率分别为51.4%和43%。此外,A+CHP 组的自体干细胞移植巩固率很低(22%),但仍获得了长期缓解,A+CHP 组在改善疗效的同时并未发现毒性反应增加[20-21]。
1.3 皮肤T 细胞淋巴瘤(cutaneous T-cell lymphoma,CTCL) CTCL 是一种预后较差的慢性肿瘤,最常见的亚型是蕈样霉菌病、塞扎里综合征和CD30 阳性淋巴组织增生性疾病,其中淋巴组织增生性疾病又分为原发性皮肤ALCL 和淋巴瘤样丘疹病[22]。对于CTCL,目前没有任何全身疗法比标准疗法更有效。
针对BV 进行的2 项研究发现其具有抗CTCL活性[23-24],其中一项多中心国际随机Ⅲ期临床研究(ALCANZA 研究)[24]将BV 和氨甲蝶呤、贝沙罗汀这2 种常规用于治疗CD30 阳性蕈样霉菌病和原发性皮肤ALCL 的药物进行比较,结果表明BV 能改善CD30 阳性CTCL 患者的治疗反应率。BV 组持续至少4 个月总体缓解率为56.3%,而氨甲蝶呤/贝沙罗汀组为12.5%;BV 组中位PFS 期为16.7 个月,氨甲蝶呤/贝沙罗汀组为3.5 个月;无论CD30 基线表达水平如何,BV 均保持了优越的PFS 率。此外,该研究还观察到BV 减轻了疾病引起的皮肤瘙痒和感染,改善了患者生活质量。
上述临床研究结果表明BV 治疗CD30 阳性淋巴瘤的效果较好,但Chen 等[25]报道这些反应并不持久,将BV 作为复发或难治性cHL 维持治疗手段患者5 年PFS 率只有22%。在BV 治疗后应用靶向CD30 的嵌合抗原受体T 细胞(chimeric antigen receptor-modified T cell,CAR-T)可一定程度提高患者的PFS 率和总生存率[26]。
2 CAR-T 治疗淋巴瘤的研究进展
CAR-T 疗法是治疗包括淋巴瘤在内的复发或难治性血液系统恶性肿瘤的一种很有前景的新疗法。靶向CD19 的CAR-T 在治疗B 细胞来源肿瘤方面获得良好的反应,甚至持久缓解。然而,对于其他类型缺乏CD19 表达的淋巴瘤或当靶向CD19 CAR-T治疗后B 淋巴细胞衰竭时,需要找到合适的替代靶点。CD30的基因表达分布特点及BV 治疗的反应性和患者耐受性为解决这一问题带来了希望[27]。
在靶向CD30 CAR-T 的临床前研究中,抗CD30 的CAR-T 在体内外环境中均表现出强大的肿瘤杀伤作用[28]。因为CD30 在造血干/祖细胞和淋巴细胞活化过程中也有表达,所以CAR-T 的安全性研究十分关键。与淋巴瘤细胞相比,造血干/祖细胞和活化淋巴细胞的CD30 表达水平均较低,但具有高水平的颗粒酶B 灭活丝氨酸蛋白酶抑制物6/9 可以保护自身免受CAR-T 攻击,所以当造血干/祖细胞与抗CD30 的CAR-T 共同培养时可形成正常的髓系集落,并且在小鼠模型中使用CD30 导向的自体CAR-T 不会损害外周T 和B 淋巴细胞[29],说明抗CD30 的CAR-T 的骨髓毒性反应很低。
2020 年,Ramos 等[30]报道了一项以 CD30 为靶点的CAR-T 治疗复发或难治性霍奇金淋巴瘤的临床试验,41 例患者(90%接受过BV 治疗,84%在BV 治疗后出现进展)接受了靶向CD30 CAR-T输注治疗。41 例患者输注CAR-T 后细胞因子释放综合征(CAR-T 输注后免疫细胞被激活释放大量细胞因子而引发的全身炎症反应综合征[31])的发生率为24%,且均为1 级,未给予类固醇激素和托珠单抗的情况下可自行消退;有4 例患者出现3~4级中性粒细胞减少症,10 例患者出现3~4 级血小板减少症,治疗后仅1 例患者存在持续性1 级血小板减少症并且可能与之前多线治疗导致造血储备受限有关。CAR-T 输注后1 年PFS 率为36%,总生存率为94%。此外,根据输注前接受淋巴结清除方式的不同分为苯达莫司汀组和氟达拉滨组,氟达拉滨组(CRR 达59%,总缓解率达72%)患者输注后检测出更高水平的IL-7 和IL-15(均为促稳态细胞因子)及CAR-T 持久性。该研究结果表明,以氟达拉滨为基础的淋巴细胞清除治疗后接受靶向CD30 CAR-T 治疗的复发或难治性cHL 患者具有很高的持久反应率和安全性,证明将CAR-T 疗法的应用扩展到经典型B 细胞恶性肿瘤之外的可行性。
CAR-T 治疗达到完全缓解后部分患者出现疾病复发,这可能是由于抗原逃逸和/或肿瘤微环境对CAR-T 的 抑 制 作 用。Ramos 等[30]对CAR-T 治疗后复发患者进行肿瘤组织活检发现CD30 仍有表达,说明复发主要是由于霍奇金淋巴瘤的高度免疫抑制性肿瘤微环境;此外该研究发现部分复发患者对免疫检查点抑制剂(immune inhibitor of checkpoint,CPI)治疗有反应。未来可以进一步研究靶向CD30 的CAR-T 和CPI 组合能否延长完全缓解的持续时间。
3 小 结
化学治疗、放射治疗、自体造血干细胞移植、利妥昔单抗、靶向CD19 的CAR-T 疗法使得淋巴瘤的治疗取得很好的疗效。然而,部分淋巴瘤因缺乏CD19/CD20 靶点、较低的化学治疗敏感率和较高的复发率等原因,整体预后较差,对于这部分肿瘤CD30 是一个替代治疗靶点。与标准化学治疗方案相比,BV 联合化学治疗已经在CD30 阳性淋巴瘤的治疗上表现出优势。但是从靶向CD30 的抗体偶联药物发展到BV 仍然有很多问题需要解决,如BV 的耐药机制、不良反应及BV 治疗后肿瘤复发。靶向CD30 的CAR-T 疗法部分延长了BV治疗后患者的PFS 期和总生存期,但为进一步提高复发或难治性淋巴瘤患者的PFS 率和总生存率,仍需要不断地探索新靶点和解决当前CD30 靶向治疗存在的问题。
