冷藏保存时间对人少突胶质前体细胞的影响
2022-11-17汪兆艳杨印祥屈素清门倩倩
汪兆艳,王 倩,杨印祥,屈素清,杨 辉,叶 豆,门倩倩,刘 畅,栾 佐
在中枢神经系统,少突胶质前体细胞(oligo‐dendrocyte precursor cells,OPC)分化为少突胶质细胞(oligodendrocytes,OL),用于修复受损的髓鞘。目前OPC主要应用于脑白质损伤[1]、脊髓损伤[2]、神经退行性病变[3]、缺血性脑卒中[4]、脑出血[5]、多发性硬化[6]等疾病,临床应用前景值得期待[7]。OPC虽然已经应用于临床前研究与疾病治疗,但治疗效果却存在差异[8],主要因为OPC制备过程存在一些影响细胞生物学特性的因素,进而影响临床治疗效果。有研究表明,细胞来源[9-11]、不同的处理方式[11]、移植细胞数量[12-13]、移植时间窗[14]、移植路径[15]及受试者个体差异[16]都会对治疗效果产生影响。在以上因素中,移植前细胞质量对临床治疗效果影响最为直接,而细胞保存介质、保存时间、保存温度等因素直接影响移植前细胞质量。然而,关于OPC在冷藏保存介质中保存不同时间是否会影响细胞生物学特性及冷藏保存后的OPC移植到体内是否会分化为产髓鞘碱性蛋白(myelin basic protein,MBP)的OL却鲜有报道。本研究以人神经干细胞来源的OPC为研究对象,评价不同冷藏保存时间对OPC生物学特性的影响,为OPC的进一步临床转化提供可能的参数指导。
1 材料与方法
1.1 主要仪器和试剂二氧化碳培养箱购自日本SANYO公司;生物安全柜购自新加坡ESCO公司;倒置显微镜购自日本Olympus公司;流式细胞仪购自美国BD公司;低温低速离心机购自美国贝克曼库尔特公司;冷藏运输箱购自上海元廷生物公司;人血白蛋白购自安徽大安生物公司;PDGFR-α-BV421及同型对照IgG均购自美国BD公司;A2B5-PE及同型对照IgM流式抗体均购自德国Miltenyi Biotec公司;Olig2、Galc免疫荧光染色抗体购自德国Miltenyi Biotec公司;山羊抗兔荧光二抗购自美国Jackson Immunoresearch公司;迁移小室Transwell购自美国康宁公司;CCK8(Cell Counting Kit-8)检测试剂盒购自日本同仁化学公司;OPC完全培养基由本实验室自配。
1.2 实验方法
1.2.1 OPC培养与传代NSC-9神经干细胞系从12周人胎脑皮质分离获得,在含有表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、白血病抑制因子(leukemia inhibitory factor,LIF)的DMEM/F12培养基中扩增为神经球,每10天用Accutase消化传代一次。取P10代神经球消化成单细胞并重悬于OPC完全培养基,按照2×104/cm2的密度接种于5 μg/mL层粘连蛋白(laminin,LN)处理的六孔板中,间隔3~4 d半量换液,每5天Accutase消化传代一次,第三代细胞用于冷藏实验研究。
1.2.2 OPC冷藏保存第三代OPC,Accutase消化,台盼兰染色计数后重悬于含有10 g/L HSA的50 g/L葡萄糖保存介质中,然后将细胞悬液转移至0.5 mL eppendorf管,细胞终浓度为4×106/100 mL。根据冷藏保存时间的不同,实验分为4组,每组三支细胞悬液。1组:冷藏保存0 h;2组:冷藏保存24 h;3组:冷藏保存48 h;4组:冷藏保存72 h。将准备好的细胞置于2~8℃冷藏运输箱内保存。为了确保冷藏运输箱内温度稳定,在细胞冷藏保存前对冷藏箱内温度进行校验。
1.2.3 细胞活率检测冷藏保存不同时间的OPC,重悬于适量体积冷藏保存介质中,充分混匀后吸取细胞悬液10 mL与台盼兰10 mL混合,取10 mL细胞悬液充入计数池计数,每组细胞取样3次计数并取平均值。活细胞不着色并保持正常形态,死亡细胞蓝染,细胞活率计算公式为:细胞活率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。
1.2.4 细胞表型检测冷藏保存不同时间的OPC,计数后均分至流式管中,每管5×105个细胞。流式标记方法为:PBS洗涤细胞,400×g离心5 min,弃上清并混匀细胞,每管加Fc阻断剂5 mL,室温放置10 min,根据说明书每管分别加荧光标记的鼠抗人PDGFR-α、A2B5抗体及对应的及同型抗体,4℃孵育30min,PBS洗涤后重悬细胞;Olig2为兔抗人抗体,一抗室温孵育2 h,二抗室温孵育1 h,PBS洗涤并重悬细胞,流式细胞仪检测。
1.2.5 细胞增殖能力检测冷藏保存不同时间的OPC,重悬于OPC完全培养基中,按照每孔6.0×103密度接种于LN包被的96孔板中,每组5孔。根据CCK-8试剂使用说明书,每天同一时间每孔加10 mL CCK8溶液于培养箱内孵育4 h,酶标仪测定450 nm处吸光度(optical density,OD)。连续检测7 d,以时间为横坐标,OD值为纵坐标绘制生长曲线。
1.2.6 细胞迁移能力检测冷藏保存不同时间的OPC,通过Transwell小室检测细胞迁移能力,具体操作方法为:8 mm孔径的Transwell小室,小室上室和下室分别加0.1 mL和0.5 mL包被液置于培养箱中孵育45 min。吸弃包被液,下室内加入OPC完全培养基0.5 mL,上室内接种重悬于OPC完全培养基的细胞2×104个,37℃、5%CO2培养箱内培养18 h,取出小室,彻底吸弃上室内的液体,用润湿的无菌棉签轻柔擦拭上室底面,擦去未迁移的细胞,将小室浸入4%多聚甲醛,室温固定10 min,PBS洗3次,DAPI复染5 min。荧光显微镜拍照整个视野,用Image J软件计算DAPI阳性细胞数量。
1.2.7 细胞体外分化能力检测冷藏保存不同时间的OPC,重悬于自配OPC分化培养基中,按照1×104/cm2密度接种于多聚L-鸟氨酸氢溴酸盐(poly-l-orni‐thine hydrobromide,PLO)和LN包被的24孔板,每隔3天半量换液,分化3周,4%多聚甲醛固定细胞,室温固定10 min,PBS清洗细胞,0.3%Triton X-100室温破膜10 min,PBS清洗细胞,3%BSA室温封闭1 h,吸弃封闭液加Galc抗体(1:100)4℃冰箱过夜,彻底吸弃一抗,PBS清洗细胞后加荧光标记的驴抗兔IgG(1:250),室温孵育2 h,PBS清洗细胞,DAPI复染5 min,荧光显微镜下拍照,计算阳性细胞比例。
1.2.8 细胞体内成髓鞘检测清洁级Sprague-Dawley(SD)孕鼠购自北京维通利华实验动物有限公司,动物实验伦理号为:SCXK-2012-0001。出生后第3天的SD大鼠,结扎右侧颈总动脉,6%氧气缺氧90 min,建立早产儿脑白质损伤(white matter injury,WMI)模型。造模后第7天,每只鼠通过立体定位仪经侧脑室移植冷藏24 h的OPCs 3×105个(n=10),移植后12周通过MBP和Stem121免疫荧光双染色法观察移植细胞体内成髓鞘能力。
1.2.9 统计学处理采用SPSS 17.0统计软件进行数据分析,符合正态分布的计量资料均数±标准差()表示,实验数据符合方差齐性检验时,多组之间进行比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞活率比较冷藏保存不同时间OPC,台盼蓝染色计数结果显示,与冷藏保存0 h比较,冷藏保存24 h、48 h细胞活率没有显著性差异,冷藏保存72 h的OPC虽然细胞活率超过85%,但与冷藏保存0h组比较,细胞活率显著下降(图1,P<0.01)。
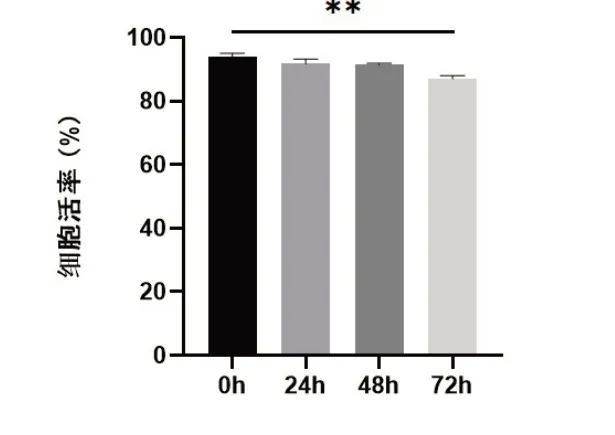
图1 冷藏保存不同时间OPC活率比较**P<0.01.
2.2 冷藏保存不同时间细胞增殖能力比较CCK8法检测各组细胞增殖能力,结果显示,与冷藏保存0h比较,冷藏保存24h、48h,细胞增殖能力没有明显变化,冷藏保存72h,OPC增殖能力呈明显下降趋势(图2)。
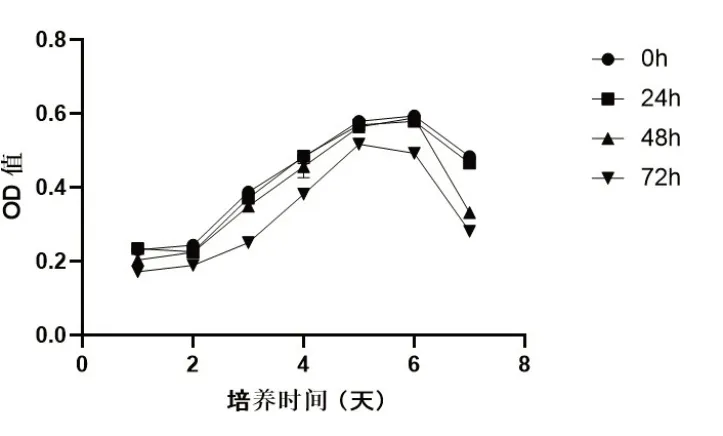
图2 冷藏保存不同时间OPC增殖能力比较
2.3 冷藏保存不同时间OPC表型比较流式检测结果显示,冷藏保存不同时间OPC特异性标志物PDGF、Olig2、A2B5无明显变化,各组之间进行比较差异没有统计学意义(P>0.05)。
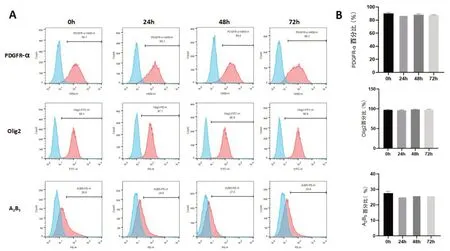
图3 冷藏保存不同时间OPC表型的鉴定A:冷藏保存不同时间OPC表型流式检测结果;B:冷藏保存不同时间OPC表型统计分析结果
2.4 冷藏保存不同时间OPC迁移能力比较Transwell法检测细胞迁移能力,结果显示,与冷藏保存0 h比较,冷藏保存24 h OPC迁移能力没有显著变化,冷藏保存48 h和冷藏保存72 h,细胞迁移率下降,差异具有统计学意义(图4,P<0.05)。
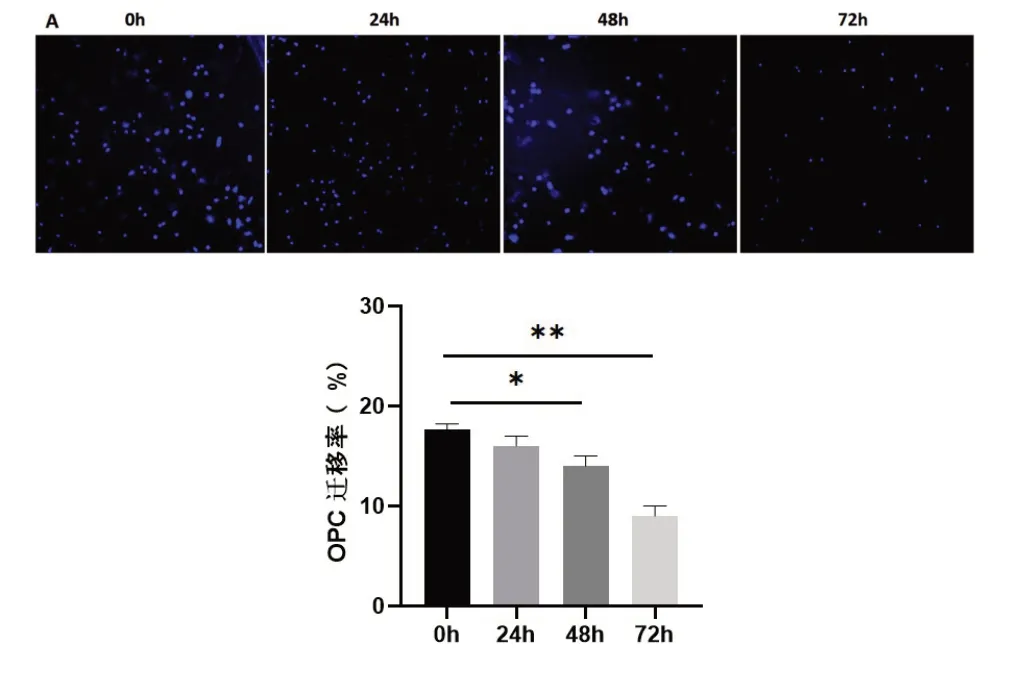
图4 冷藏保存不同时间OPC迁移能力比较A:冷藏保存不同时间OPC迁移结果(DAPI染色,×100);B:OPC迁移率定量分析(*P<0.05**P<0.01)
2.5 冷藏保存不同时间OPC分化能力冷藏保存不同时间的OPC均可分化为少突胶质细胞,少突胶质细胞特异性标志物Galc免疫荧光染色结果显示,与冷藏保存0 h比较,冷藏保存24 h Galc阳性率没有显著差异(P>0.05),随着冷藏保存时间的延长,冷藏保存48 h和冷藏保存72 h OPC分化为少突胶质细胞比例下降,而冷藏保存72 h OPC分化为Galc阳性少突胶质细胞的比例下降更为明显(图5,P<0.05)。
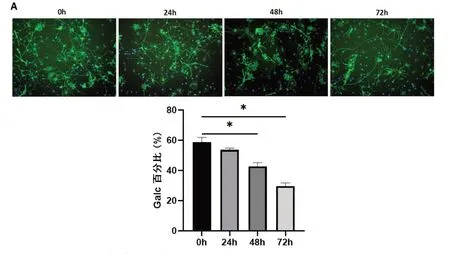
图5 冷藏保存不同时间OPC分化能力的比较A:冷藏保存不同时间OPC Galc免疫荧光染色结果(免疫荧光细胞化学染色,X200);B:冷藏保存不同时间OPC Galc免疫荧光染色百分比,*P<0.05.
2.6 冷藏保存24h OPC体内成髓鞘能力将冷藏保存24 h的OPC移植到WMI大鼠侧脑室,细胞移植后3个月,MBP和Stem121免疫荧光染色结果显示,移植细胞在损伤的白质中能够分化为MBP阳性的少突胶质细胞,证明冷藏保存24 h的OPC在体内具有良好的活性和迁移能力并且分化为产MBP的少突胶质细胞。
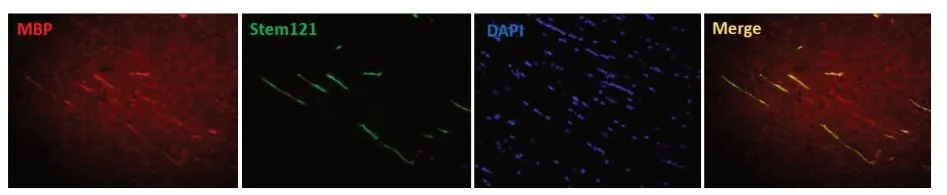
图6 冷藏保存24h OPC MBP和Stem121染色(免疫荧光染色,×200)
3 讨论
干细胞制剂进行临床移植前,必须保存于经美国食品药品管理局(Food and Trug Administration,FDA)批准可直接输注于人体的保存介质中进行移植。在实验研究过程中,干细胞制剂制备后很快移植到动物体内,但在临床转化过程中很难实现即刻移植,这是因为细胞制备需要在GMP(Good Man‐ufacturing Practice,GMP)实验室完成,而细胞移植需要在经国家批准的医院内进行,因此,干细胞制剂需要在冷藏介质中保存一定时间才能输注给患者。虽然目前干细胞冻存技术较为成熟[17-18],但由于细胞复苏活率低、细胞复苏后需要恢复一定时间才能发挥免疫调节作用[19-20]、冷冻保护剂对人体有害[21]、复苏细胞对实验室环境要求高,因此并不适用于干细胞短期保存。
目前尚无关于OPCs保存条件的相关研究或指南,不同研究采用的冷藏保存介质不尽相同[22],Wang等[23]采用PBS,Zhang等[24]采用培养基作为细胞制剂冷藏保存介质,但这些保存介质只适用于实验研究,不适合临床转化。5%葡萄糖注射液是经典的药物溶剂。有研究指出,高糖环境会影响干细胞的活性和增殖能力[25],但也有研究[26]认为,5%葡萄糖注射液在短期内可维持干细胞的活性。在冷藏保存液中加入一定浓度的人血白蛋白对细胞存活具有保护作用,然而,保存液中人血白蛋白浓度并不是越高越好,chen等[27]在间充质干细胞冷藏保存实验研究中发现,高浓度的人白蛋白并不利于提高细胞存活。因此我们在临床常用的药物溶媒5%葡萄糖注射液中加入1%人血白蛋白,评价OPC在此种冷藏保存介质中保存不同时间对细胞生物学特性的影响。
我们在研究过程中发现,冷藏保存24 h和冷藏保存0 h的OPC比较,细胞活率和增殖能力虽然没有显著差异,但随着保存时间的增加,细胞活率和增殖能力整体呈下降趋势。除了细胞活率和增殖能力,细胞迁移能力是实现临床有效治疗非常重要的指标[28]。有研究发现,人神经干细胞移植治疗脱髓鞘小鼠,仅在注射部位形成髓鞘,髓鞘形成不良的原因主要是移植细胞迁移能力不足[29]。有文献报道,OPCs的迁移和趋化因子受体表达有关。中枢神经系统正常发育的OPCs依赖于CXCR4信号迁移到白质中形成髓鞘[30],然而目前尚无关于冷藏保存对OPC迁移能力影响的文献报道。本研究通过Transwell迁移实验发现,与冷藏保存0 h OPC比较,冷藏保存48 h的OPC迁移能力降低,而保存72 h的OPC迁移能力降低更为显著。有研究表明细胞迁移能力随着保存时间的延长而下降的原因可能与冷藏过程中细胞氧化应激水平升高引起的细胞损伤有关[31]。
细胞分化能力是反映OPCs冷藏保存效果较为客观的指标。我们在研究中发现,冷藏保存48h和72h的OPC分化为少突胶质细胞的比例较冷藏保存0h有显著差异。然而,移植到体内的OPC只有分化为少突胶质细胞包绕神经元轴突才能修复受损的髓鞘[32,33],发挥其生物学功能。为了验证冷藏保存后的OPCs在体内是否能够形成髓鞘,我们择优选择冷藏保存24h的OPCs移植到脑白质损伤大鼠脑内,免疫荧光染色结果显示冷藏保存24h的OPCs具有良好的迁移能力并分化为产MBP的少突胶质细胞。
尽管OPC冷藏保存不同时间细胞特异性标记没有发生变化,并且冷藏保存48h和72h仍能达到FDA对细胞移植活率不低于70%的要求,但随着保存时间的增加,细胞体外迁移和分化能力呈下降趋势。因此,建议OPC制剂在含1%人血白蛋白的5%葡糖糖注射液中冷藏保存24 h内使用。
总之,我们在体外实验初步探索了人少突胶质前体细胞冷藏保存不同时间对细胞生物学特性的影响,体内进一步证实冷藏保存24 h的OPCs移植到体内能够形成髓鞘,发挥生物学功能。但在实际临床转化过程中,干细胞产品不可避免需要更长距离的运输,因此冷藏保存48 h和72 h的OPCs在体内是否具有成髓鞘能力还有待验证。在未来研究中,我们将继续探索在保存介质中添加具有细胞保护作用或能为细胞提供营养的成分,如复合氨基酸、维生素等,以此提高细胞活性,延长保存时间,为临床转化提供质量合格、安全有效的干细胞产品。
