杂交鲟(达氏鳇♀×施氏鲟♂)和施氏鲟的人工繁殖及其胚胎发育比较
2022-11-17肖鑫鑫骆小年符先飞姜旭段友健李姣刘英林
肖鑫鑫,骆小年*,符先飞,姜旭,段友健,李姣,刘英林
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023;2.大连七水渔业发展有限公司,辽宁 大连116211)
达氏鳇Husodauricus隶属于鲟形目Acipenseriformes鲟科Acipenseridae鳇属Huso,是鲟科鱼类中个体最大的鱼类,寿命长,素有“淡水鱼王”之称。施氏鲟Acipenserschrenckii隶属于鲟形目Acipenseriformes鲟科Acipenseridae鲟属Acipenser,俗称“七粒浮子”,具有生长速度快、抗病力强和寿命长等优点,是中国最早开发利用的鲟类之一。
鲟形目鱼类种间甚至属间的杂交现象极为普遍,国外有欧洲鳇H.huso♀×小体鲟A.ruthenus♂、西伯利亚鲟A.baeri♀×小体鲟A.ruthenus♂、俄罗斯鲟A.gueldenstaedtii♀×小体鲟A.ruthenus♂和俄罗斯鲟A.gueldenstaedtii×欧洲鳇H.huso正反交等。国内养殖的鲟杂交种以西伯利亚鲟A.baeri♀×施氏鲟A.schrenckii♂和达氏鳇H.dauricus♀×施氏鲟A.schrenckii♂为主[1]。通过鲟的属间或种间杂交获得的杂交种,在生长和繁殖上往往表现出杂交优势,如欧洲鳇H.huso♀×小体鲟A.ruthenus♂[2]、施氏鲟A.schrenckii♀×西伯利亚鲟A.baeri♂[3]和达氏鳇H.dauricus♀×西伯利亚鲟A.baeri♂[4]等。
杂交鲟(达氏鳇♀×施氏鲟♂),俗称黑龙江杂交鲟、大杂和小鲟鳇,其过氧化氢酶(CAT)活性和丙二醛(MDA)含量均接近或高于两亲本中较髙的一方[5],同时其生长较父本快,具有较强的生长性能[6],其性成熟系数(GSI)和平均绝对繁殖力显著高于其父母本[1],性成熟年龄较母本提前,具有明显的杂交优势。近年来,达氏鳇♀×施氏鲟♂已成为中国重要的淡水养殖鲟类,其苗种价格为其他鲟苗的两倍以上,市场前景广阔。然而,在生产上杂交鲟繁殖效率依然不高,究其原因,是对其繁殖特性的研究不够透彻。本研究中,对杂交鲟及施氏鲟全人工繁殖过程中的胚胎发育进行了观察,比较了杂交鲟与其父母本胚胎发育的特点,以期为生产中进一步提高鲟鱼繁殖效率提供技术参考。
1 材料与方法
1.1 材料
试验用亲鱼来自大连七水渔业发展有限公司。2021年3—5月,催产5批10组杂交鲟,达氏鳇母本18尾,15~17冬龄,体质量为(69.0±5.0)kg;施氏鲟父本10尾,9~11冬龄,体质量为(25.0±3.0)kg;催产1批2组施氏鲟,施氏鲟母本4尾,15~17冬龄,体质量为(29.0±2.0)kg,施氏鲟父本2尾,9~11冬龄,体质量为(25.0±3.0)kg。
1.2 方法
1.2.1 人工繁殖
1)亲鱼的选择与成熟度鉴定。挑选体质健壮、身体无伤的亲鱼,成熟良好的雌鱼生殖孔红肿外翻,腹部膨大且富有弹性,腹壁薄,体表黏液较多。用手术刀在鱼体侧面性腺的后中部扎一小口,将挖卵器从小口插入,在体内旋转一圈后抽出,取出少量卵细胞镜检以观察卵母细胞发育状况。成熟的卵细胞呈棕黄色或灰黄色,有光泽和弹性,镜检可见动物极分化明显,可见明显的深色色素环和白色极斑(图1)。雄鱼的成熟度较难通过外表鉴别,需用挖卵器采精鉴别,取样步骤和雌鱼相同,若能取出乳白色块状物,则说明成熟度较好。
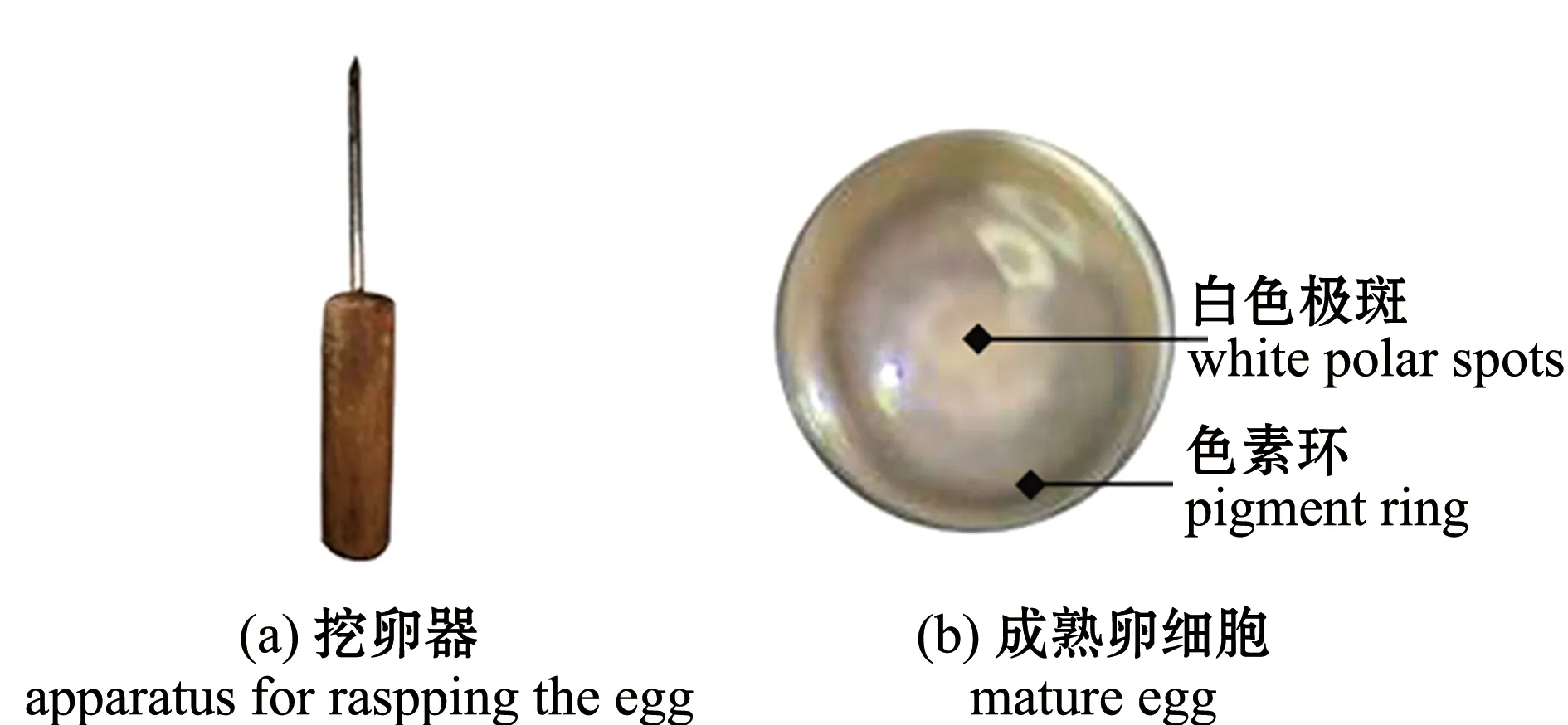
图1 雌鱼成熟度检查Fig.1 Maturity inspection of female fish
2)人工催情。参照骆小年等[7]的催产药物选择和亲鱼注射方法。采用胸鳍基部注射,雌性亲鱼分两次注射,施氏鲟注射促黄体素释放激素类似物2号(LHRH-A2) 4~10 μg/kg+地欧酮DOM 1~5 mg/kg,达氏鳇注射LHRH-A25~10 μg/kg+DOM 1~5 mg/kg,第1次注射全部剂量的10%~20%,第2次注射剩余剂量;雄性亲鱼采用1次注射法,在雌鱼注射第一针时同时注射,注射剂量为雌鱼的一半。依照雌性亲鱼成熟度差异,施氏鲟两次注射间隔8~11 h,达氏鳇两次注射间隔为15~18 h。
3)成熟精液的采集和储备。采卵前应首先准备好充足的精液,将雄鱼置于专用的采精平台上,腹部朝上,用手轻压雄鱼腹部使精液流出,用干燥的采精盒收集精液。在滴有清水的载玻片上滴一滴精液,镜检精子活力,如观察到大多数精子呈直线迅速游动,快速游动时间可达4 min,表明精子活力较强。将采集的精液在2~4 ℃条件下冷藏保存备用。
4)成熟卵子的采集。轻压雌鱼腹部,生殖孔有少量卵粒流出时,即可进行采卵。采用手术方法采卵,将雌鱼置于采卵床,腹部朝上。先以生殖孔为中心,按照由尾至生殖孔和由头至生殖孔的方向推压鱼腹,使游离在输卵管里的卵排出体外。再用乙醇棉球擦拭鱼体腹部生殖孔前5~10 cm的区域,用消毒手术刀在生殖孔前开一个2~3 cm的小口,同时以切口为中心,按照由头至切口的方向推压鱼腹,使腹腔中的大部分卵排出后,再按照由尾至切口的方向推压腹部,使后腹腔中遗留的卵排出。然后用质量分数为0.9%的生理盐水重复清洗腹腔2次,使腹腔中剩余的卵粒排出。雌鱼若在手术过程中出现应激反应,可向其口中塞入乙醇棉球用于短暂麻醉。卵子采集完成后,用酒精棉擦拭伤口,用医用缝合针和医用可吸收缝线缝合切口,同时保持亲鱼微流水,消毒处理后用医用胶涂抹切口,用吹风机吹干后将亲鱼放入恢复池中。
5)人工授精。采用干法授精,取成熟的卵粒直接倒入精液,按照1 kg卵粒加入5 mL精液的比例,不断搅拌均匀,然后加入清水,搅动均匀后静置3~5 min,滤掉污水,再重复漂洗几次,去除卵中混有的黏液。再向鱼卵中慢慢加入质量分数为15%~20%的滑石粉悬浊液,然后倒入特制的脱黏装置中脱黏,不断向脱黏装置中通入氧气,以搅动受精卵,避免其缺氧。持续脱黏1 h后即可将鱼卵移入孵化器中孵化。经过脱黏的鱼卵仍具有黏性,为防止其相互粘连或粘在孵化器底部而造成出苗率下降,人工授精后需经常搅动,并根据受精卵的黏性变化,每次搅动间隔时间随孵化时间的延长而相应延长。
6)人工孵化。采用鲟1号孵化器孵化,一个规格为43 cm×35 cm×21 cm的孵化筛可容纳鱼卵5~6万粒,水温为16~17 ℃,溶解氧质量浓度为6.0 mg/L以上,水流从孵化筛上方进入,同时定期搅动鱼卵,以防止其缺氧。放入孵化器的第1天受精卵黏性较大,需每隔10~20 min人工搅动1次;第2~3天鱼卵黏性减小,每隔20~40 min人工搅动1次;第4~5天黏性基本消失,每隔1~2 h人工搅动1次;第6~7天开始有仔鱼孵出时不再搅卵。孵化过程中受精卵出现水霉时,应及时漂洗鱼卵。孵出的仔鱼从孵化筛中游出,顺着水流进入侧面的圆形玻璃钢水池中。
1.2.2 胚胎发育观察 在体式显微镜(奥林帕斯MOTIC ST-36)下观察鲟受精卵孵化期的形态特征变化。鲟受精卵为沉性黏性卵,将脱黏后的卵放在显微镜下观察,可见卵外有一层很厚的胶膜,胶膜上黏附残留的滑石粉,不易观察卵的形态特点。用于本研究的卵未经过滑石粉脱黏,受精卵表面相对透明,易于观察。第1次卵裂前,每隔10~30 min观察1次并拍照,从第1次卵裂开始到原肠胚期,每隔1~2 h观察1次并拍照,从原肠胚期开始到仔鱼孵出时,每隔2.5~5.0 h观察1次并拍照,每次取样20粒以上,当有50%以上的卵出现新特征时记为鱼卵发育至新时期的起始时间。
1.2.3 繁殖效率评价指标
催产率=产卵鱼数/催情鱼总数×100%,
受精率=原肠中期活卵数/产卵总数×100%,
孵化率=水花鱼苗/受精卵总数×100%。
2 结果与分析
2.1 繁殖结果
2021年3—5月共催产了5批杂交鲟和1批施氏鲟,杂交鲟和施氏鲟的催产率分别为100%、75%。杂交鲟繁殖共获卵379万粒,平均受精率为82.9%,获苗217.6万尾;施氏鲟繁殖共获卵87万粒,平均受精率为82.2%,共获苗54.2万尾。其中,4月17日催产的第一批杂交鲟受精率和孵化率最高,分别达到了97.8%和89.8%,4月28日催产的第三批杂交鲟的受精率最低(75.9%),4月17日催产的施氏鲟孵化率较低(63.2%)(表1)。
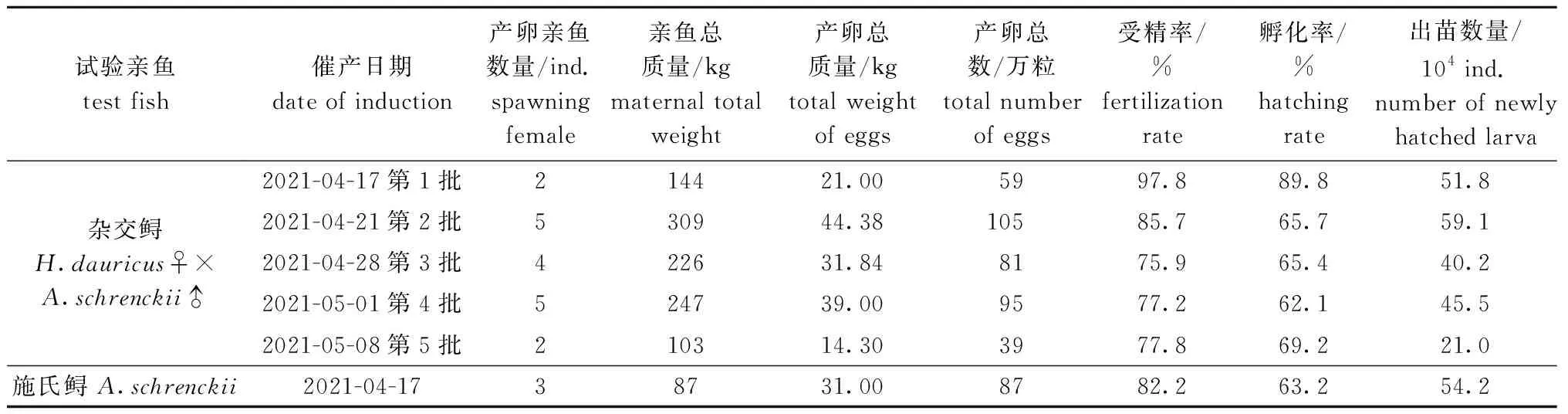
表1 2021年试验杂交鲟和施氏鲟催产情况Tab.1 Propagation of hybrid sturgeon Huso dauricus♀× Acipenser schrenckii♂ and Amur sturgeon A.schrenckii in 2021
2.2 杂交鲟胚胎发育
在16~17 ℃水温下,杂交鲟胚胎发育历经123~155 h孵化出膜,总积温为2 102~2 445 ℃·h。根据杂交鲟胚胎发育顺序及形态特点,并参照刘洪柏等[8]的方法,将杂交鲟胚胎发育过程分成受精卵、卵裂期、囊胚期、原肠胚期、卵黄栓期、神经胚期、器官形成期、心脏形成搏动期和孵出期共9个阶段,根据每个阶段形态学特征和发生顺序,又细分为32个时期,各时期发育的主要特征和所需时间见图2。杂交鲟胚胎发育分期描述如下:
受精卵:卵受精后,卵膜吸水膨胀,动物极中央逐渐形成一极性暗斑,颜色呈中央深边缘浅,暗斑周围有一环状较宽的明亮带。30 min后,受精卵转动到动物极,动物极始终朝上,植物极始终在下(图2A)。
卵裂期:受精后3.5 h进入卵裂期,受精卵第1次卵裂为经裂,动物极率先开始分裂,出现一条由边缘向中央不断加深的凹陷,随着凹陷的加深形成分裂沟,动物极分裂为2个大小相等的分裂球,称为2细胞期(图2B)。受精后4.4 h开始第2次卵裂,仍为经裂,2个分裂球分别分裂1次,形成4个大小相等的分裂球,此时纵横动物极的两条分裂沟相互垂直,称为4细胞期(图2C)。受精后5.2 h,胚胎进入8细胞期,第3次卵裂仍为经裂,每个分裂球再次一分为二,分裂成8个大小不等的分裂球,同时第1次分裂沟在植物极闭合(图2D)。受精后6.2 h,胚胎进入16细胞期,第4次分裂出现横向分裂沟,为纬裂,胚胎被分成16个大小不等的分裂球,同时第2次分裂沟在植物极闭合(图2E)。受精后7.3 h,胚胎进入32细胞期,胚胎被分成32个分裂球,同时第3次分裂沟在植物极闭合(图2F)。受精后8.5 h,胚胎进入多细胞期,动物极被分裂成很多不规则的细胞,动物极开始出现色素(图2G)。
囊胚期:受精后9.5 h,胚胎进入囊胚期,动物极分裂球变小,细胞界限清晰可见,植物极分裂球较大,称为囊胚初期(图2H)。受精后14.3 h,动物极分裂球变得更小,细胞核分裂不同步,分裂球之间有明显间隙,称为囊胚中期(图2I)。受精后15.0 h,动物极细胞进一步分裂变小,细胞界限模糊不清,下延到赤道处,称为囊胚晚期(图2J)。
原肠胚期:受精后22.0 h,胚胎进入原肠胚期,此时外胚层开始下包,在赤道处出现一条狭窄的暗色条带,称为原肠胚初期(图2K)。受精后24.4 h,暗色条带继续下延,逐渐超过赤道处,并形成了一个狭缝状胚孔,称为原肠胚中期(图2L)。受精后29.0 h,形成侧唇和腹唇,外胚层细胞继续下包,动物极覆盖胚胎表面的3/4,称为原肠胚晚期(图2M)。
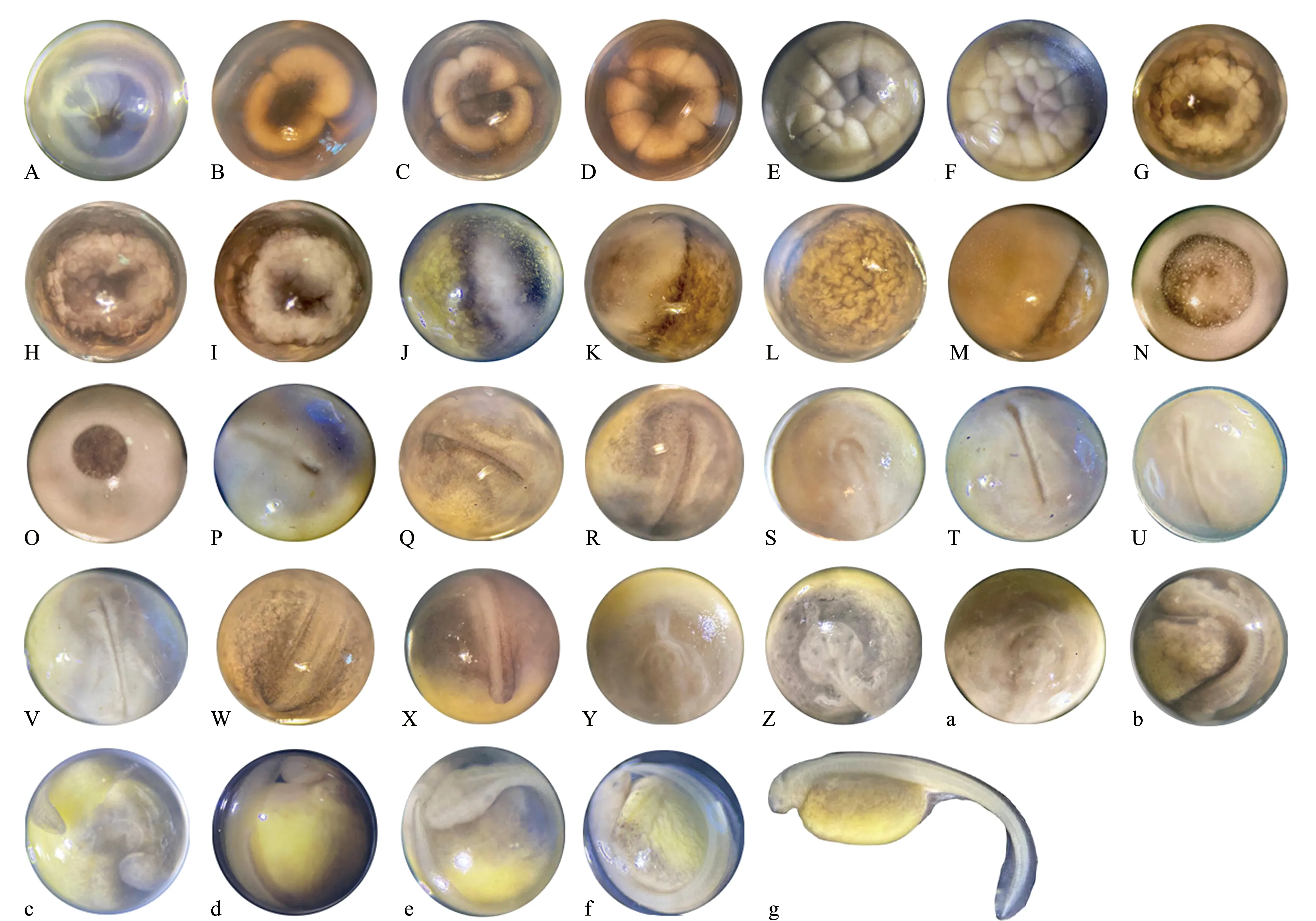
A—受精卵(0 h);B—2细胞期(3.5 h);C—4细胞期(4.4 h);D—8细胞期(5.2 h);E—16细胞期(6.2 h);F—32细胞期(7.3 h);G—多细胞期(8.5 h);H—囊胚初期(9.5 h);I—囊胚中期(14.3 h);J—囊胚晚期(15.0 h);K—原肠胚初期(22.0 h);L—原肠胚中期(24.4 h);M—原肠胚晚期(29.0 h);N—大卵黄栓期(31.0 h);O—小卵黄栓期(34.0 h);P—隙状胚孔期(38.5 h);Q—神经胚早期(44.0 h);R—宽神经板期(46.9 h);S—神经褶靠拢期(48.0 h);T—神经胚晚期(49.5 h);U—神经管闭合期(50.5 h);V—视泡形成期(53.0 h);W—尾芽形成期(59.1 h);X—尾芽分离期(64.5 h);Y—短心管期(70.1 h);Z—长心管期(75.5 h);a—心脏变形期(83.0 h);b—肌肉效应期(88.5 h);c—心跳期(95.5 h);d—尾达头部期(106.0 h);e—出膜前期(119.5 h);f、g—出膜期(123~155 h)。A—fertilized egg(0 h); B—2-cell stage(3.5 h); C—4-cell stage(4.4 h); D—8-cell stage(5.2 h); E—16-cell stage(6.2 h); F—32-cell stage(7.3 h); G—morula stage(8.5 h); H—early blastula stage(9.5 h); I—mid-blastula stage(14.3 h); J—late blastula stage(15.0 h); K—early gastrula stage(22.0 h); L—mid-gastrula stage(24.4 h); M—late gastrula stage(29.0 h); N—big yolk plug stage(31.0 h); O—small yolk plug stage(34.0 h); P—lyriform blastopore formation(38.5 h); Q—early neurula stage(44.0 h); R—wide neural plate formation(46.9 h); S—neural fold closing stage(48.0 h); T—late neurula stage(49.5 h); U—neural tube closing stage(50.5 h); V—eye vesicle formation(53.0 h); W—tail bud appearance(59.1 h); X—tail bud separating stage(64.5 h); Y—short-tubular heart formation(70.1 h); Z—long-tubular heart formation(75.5 h); a—stage of heart metamorphosing(83.0 h); b—stage of muscular effect(88.5 h); c—stage of heart beating(95.5 h); d—the tail touches the head(106.0 h); e—prehatching stage(119.5 h); f,g—hatching(123-155 h).图2 杂交鲟胚胎发育图Fig.2 Embryonic development of hybrid sturgeon Huso dauricus♀× Acipenser schrenckii♂
卵黄栓期:受精后31.0 h,动物极色素较浅,植物极色素较深,两极界限明显,较大的卵黄栓像一个大塞子嵌在胚环内,称为大卵黄栓期(图2N)。受精后34.0 h,植物极仅有一个很小的卵黄栓,其余部分均被明亮的动物极所覆盖,称为小卵黄栓期(图2O)。
神经胚期:受精后38.5 h,卵黄栓逐渐消失,胚孔的边缘越来越靠近,只留下狭窄的缝隙,称为隙状胚孔期(图2P)。受精后44.0 h,胚胎从背部隙状胚孔处开始形成神经沟,并逐渐膨大形成脑部,脑部周围出现神经褶,称为神经胚早期(图2Q)。受精后46.9 h,胚胎背部形成增厚的神经板,似“马蹄”形,神经板向下增长,并分为内外两部分,称为宽神经板期(图2R)。受精后48.0 h,脑部的神经褶中部下陷,边缘升高,并逐渐靠拢,神经板下陷、变窄,在躯干部两侧出现排泄原基,称为神经褶靠拢期(图2S)。受精后49.5 h,脑部的神经褶继续靠拢,神经板最后闭合成神经管,称为神经胚晚期(图2T)。受精后50.5 h,神经褶闭合成神经管,逐渐膨大加长,头部分化出3个脑泡,胚胎躯体小、尾部大,在躯体上可见直线肌节,称为神经管闭合期(图2U)。
器官形成期:受精后53.0 h,胚胎头部继续分化,脑容积增大,可分为前、中、后3个脑泡,在前脑形成两个眼凸,即眼原基,称为视泡形成期(图2V)。受精后59.1 h,脑部稍隆起,尾芽形成,呈扁平状,称为尾芽形成期(图2W)。受精后64.5 h,胚体继续隆起,高出球面,排泄系统原基从身体中部一直延到尾端,尾芽突出,呈棒状,开始与球体分离,称为尾芽分离期(图2X)。
心脏形成搏动期:受精后70.1 h,心脏原基在头部前下方发育成短管状,称为短心管期(图2Y)。受精后75.5 h,心脏原基呈长管状,头部抬高,视泡明显,称为长心管期(图2Z)。受精后83.0 h,头部明显抬高,心脏变形呈“C”状,有微弱搏动,称为心脏变形期(图2a)。受精后88.5 h,胚胎尾部向腹面弯曲加长,尾的末端靠近心脏,肌肉开始颤动,称为肌肉效应期(图2b)。受精后95.5 h,心脏呈大“C”状,心脏有明显搏动,尾末端到达心脏,称为心跳期(图2c)。
孵出期:受精后106.0 h,尾部末端继续伸长并接触头部,胚胎在卵内转动,卵黄囊上血管明显,称为尾达头部期(图2d)。受精后119.5 h,尾部末端略过头部,尾部鳍褶变宽,尾牙游离,心脏搏动加快,胚体在膜内自由扭动,称为出膜前期(图2e)。受精后123 h,仔鱼开始从膜中孵出,受精后128 h仔鱼大量孵出,进入出膜期,至155 h仔鱼基本全部孵出。初孵仔鱼在水中做垂直运动,躯体呈透明色,头部略向尾部弯曲,眼中有色素斑点(图2f、g)。
2.3 施氏鲟胚胎发育
在水温为16~17 ℃下,施氏鲟发育历时116~138 h,总积温为1 856~2 108 ℃·h。根据施氏鲟胚胎发育特点,并参照刘洪柏等[8]的方法,将施氏鲟的胚胎发育过程分为受精卵、卵裂期、囊胚期、原肠胚期、卵黄栓期、神经胚期、器官形成期、心脏形成搏动期和孵出期9个阶段28个时期。各时期的所需时间和主要特征见图3。施氏鲟胚胎发育分期描述如下:
受精卵:卵受精后吸水膨胀,富有弹性,开始出现黏性。受精后15 min左右大部分受精卵动物极和植物极分化,动物极始终朝上,植物极始终朝下,称为两极转动期(图3A)。受精后30 min动物极逐渐出现暗斑,暗斑周围有一圈明亮带,卵膜膨胀,卵间隙明显,称为卵周隙形成期(图3B)。受精后1 h左右动物极略隆起,称为胚胎隆起期。
卵裂期:受精后3 h开始第1次卵裂,为经裂,首先在动物极出现分裂沟,将受精卵平均分成相等的2个分裂球,称为第1次卵裂期(图3C)。第2次卵裂仍为经裂,分裂沟常与第1次分裂形成的分裂沟相垂直,将受精卵分成4个大小基本相等的分裂球,称为第2次卵裂期(图3D)。第3次卵裂仍为经裂,大部分受精卵的分裂沟呈现“Ж”形,将受精卵分成8个大小不等的分裂球,称为第3次卵裂期(图3E)。第4次卵裂为纬裂,将受精卵分成16个大小不等的分裂球,称为第4次卵裂期(图3F)。第5次卵裂仍为纬裂,将受精卵分成 32个大小不等的分裂球,称为第5次卵裂期(图3G)。每次卵裂间隔大约1 h。受精卵被分成越来越多更小的不规则细胞,称为多裂期(图3H)。
囊胚期:受精后12 h,胚胎进入囊胚期,此时动物极色素变浅,细胞界线不清晰,植物极色素加深,细胞仍较大,细胞界线明显,称为囊胚中期(图3I)。受精后16 h,动物极细胞界线完全模糊不清,并下延到赤道处,动物极稍隆起形成,称为囊胚晚期。
原肠胚期:受精后25 h,胚胎进入原肠胚期,囊胚层不断下包,赤道处可见一条狭窄的深色条纹,称原肠胚早期(图3J)。受精后30 h,随着动物极细胞的下包,动、植物极细胞的界线不断下移,动物极占3/4左右,称原肠胚中期(图3K)。
卵黄栓期:受精后35 h,胚胎进入卵黄栓期,此时动物极细胞呈现亮黄色,植物极色素较深,动、植物极界限清晰。植物极的卵黄栓较大,像个大塞子,此时称为大卵黄栓期(图3L)。受精后39 h,植物极的卵黄栓仅剩很小的一个圆形区域,称为小卵黄栓期(图3M)。
神经胚期:受精后43 h,胚胎进入神经胚期,卵黄栓越来越小,胚孔边缘逐渐靠近,呈缝隙状,称为隙状胚孔期。受精后46 h,隙状胚孔膨大形成神经沟,称为神经胚早期(图3N)。受精后44 h,在胚胎背面形成马蹄形的神经板,称宽神经板期。受精后52 h,神经褶膨大增长,形成神经管,头部分化出3个脑泡,称神经管闭合期(图3O)。
器官形成期:受精后55 h,胚胎进入视泡形成期,头部前方形成2个眼凸(图3P)。受精后59 h,尾芽突出,稍与球体胚胎分离,称尾芽分离期(图3Q)。
心脏形成搏动期:受精后62 h,胚胎进入心脏形成搏动期,起初心管较短,位于头部下方,略超出头部,称短心管期(图3R)。受精后65 h,心管变长并略有弯曲,称为长心管期(图3S)。受精后68 h,心脏进一步弯曲,呈“S”型,并开始微弱的跳动,胚胎可在卵内扭动,称为心脏变形期(图3T)。受精后71 h,心管由头部方向呈波浪状均匀跳动,称为心脏搏动期。受精后 85 h,尾部接近心脏,胚胎在卵内转动,称为肌肉效应期(图3U)。
孵出期:受精后95 h,胚胎进入孵出期,尾部继续伸长并到达头部,胚胎在卵内活动更剧烈,称为尾达头部期。受精后108 h,尾部略超过头部,胚胎转动更为频繁。受精后116 h,胚胎尾部剧烈运动,开始有仔鱼孵出,至138 h仔鱼基本全部孵出,称为出膜期(图3V)。
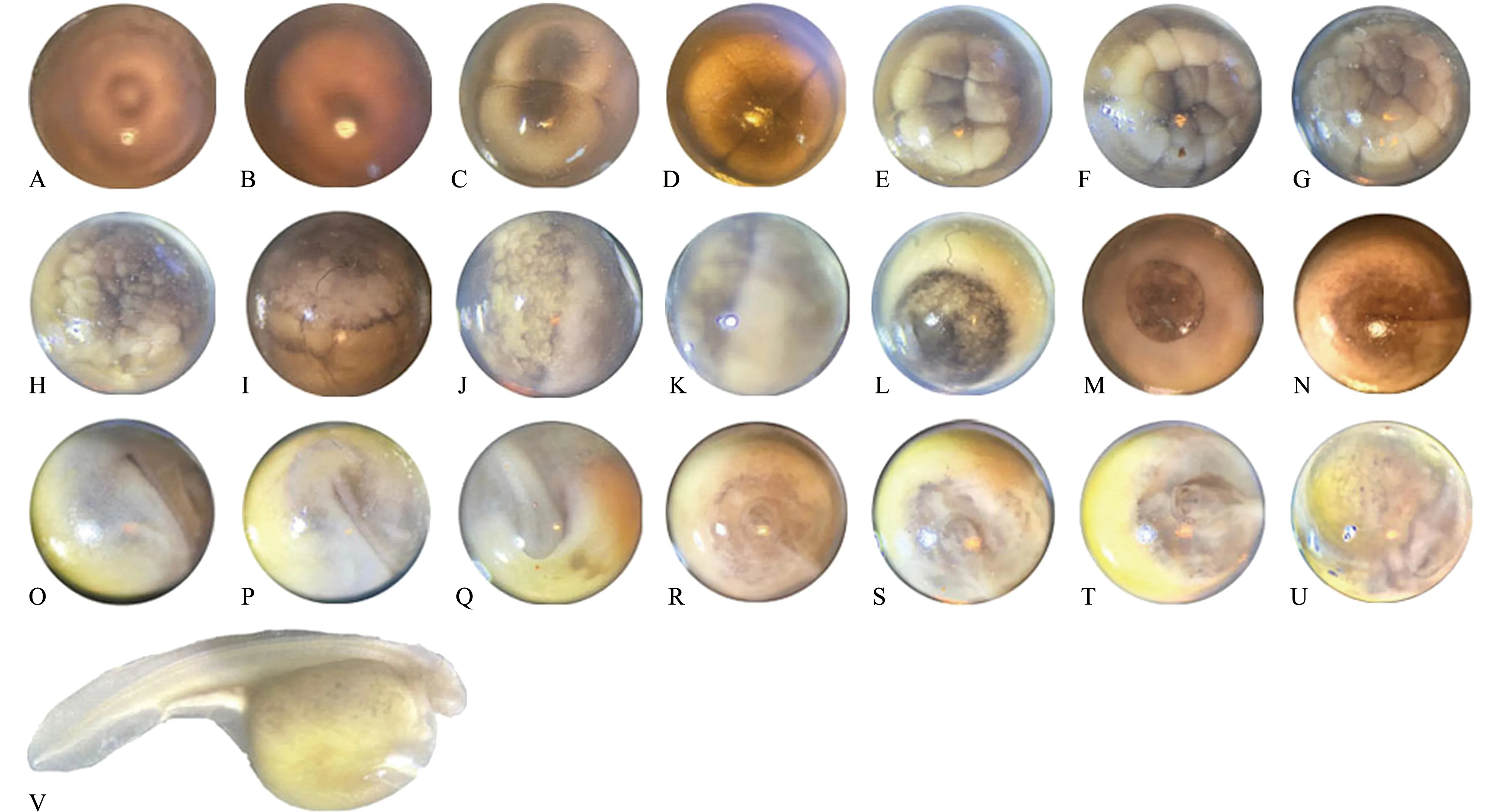
A—两极转动期(0.25 h);B—卵周隙形成期(0.5 h);C—第1次卵裂期(3 h);D—第二卵裂期(4 h);E—第3次卵裂期(5 h);F—第5次卵裂期(6 h);G—第5次卵裂期(7 h);H—多裂期(8 h);I—囊胚中期(12 h);J—原肠早期(25 h);K—原肠中期(30 h);L—大卵黄拴期(35 h);M—小卵黄拴期(39 h);N—神经胚早期(46 h);O—神经管闭合期(52 h);P—视泡形成期(55 h);Q—尾芽分离期(59 h);R—短心管期(62 h);S—长心管期(65 h);T—心脏变形期(68 h);U—肌肉效应期(85 h);V—出膜期(116~138 h)。A—pole conversion period(0.25 h); B—perivitelline space formation(0.5 h); C—2-cell stage(3 h); D—4-cell stage(4 h); E—8-cell stage(5 h); F—16-cell stage(6 h); G—32-cell stage(7 h); H—morula stage(8 h); I—mid-blastula stage(12 h); J—early gastrula stage(25 h); K—mid-gastrula stage(30 h); L—big yolk plug stage(35 h); M—small yolk plug stage(39 h); N—early neurula stage(46 h); O—neural tube closing stage(52 h); P—eye vesicle formation(55 h); Q—tail bud separating stage(59 h); R—short-tubular heart formation(62 h); S—long-tubular heart formation(65 h); T—stage of heart metamorphosing(68 h); U—stage of muscular effect(85 h); V—hatching(116-138 h).图3 施氏鲟胚胎发育图Fig.3 Embryonic development of Amur sturgeon Acipenser schrenckii
2.4 杂交鲟、施氏鲟胚胎发育时序比较
从表2可见,杂交鲟的胚胎发育分9个阶段32个时期,而施氏鲟胚胎发育分9个阶段28个时期。与杂交鲟胚胎发育相比,施氏鲟的受精卵阶段从两极转动到卵周隙形成再到胚胎隆起,具有明显的特征,故分别划分为两级转动期、卵周隙形成期和胚胎隆起期3个时期,然而,施氏鲟在囊胚初期、原肠胚晚期、神经褶靠拢期、神经胚晚期、尾芽形成期和出膜前期的胚胎发育特征不明显,故未做出应有时期的划分。
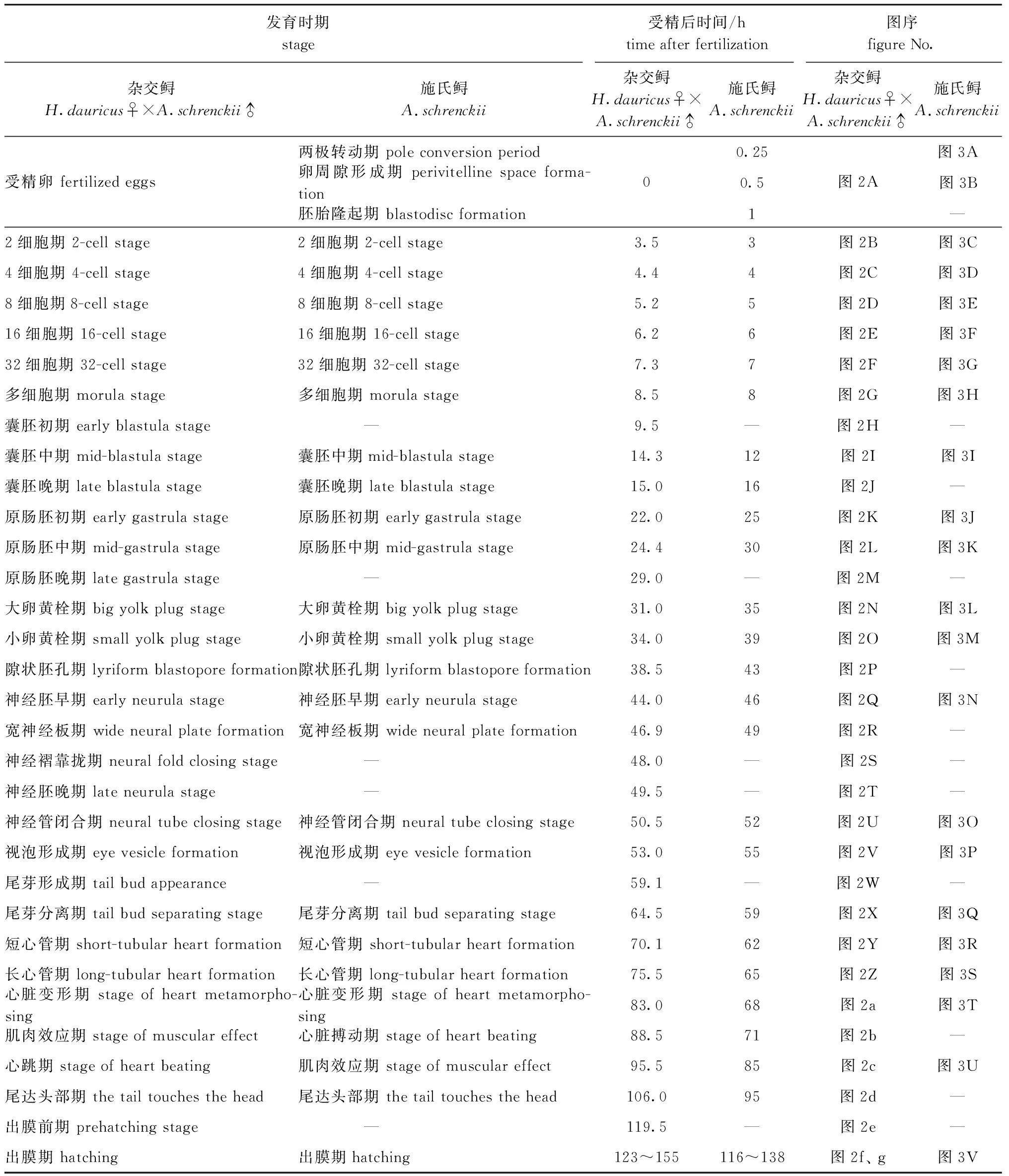
表2 杂交鲟、施氏鲟胚胎发育时序的比较
3 讨论
3.1 杂交鲟与父本施氏鲟人工繁殖及胚胎发育的异同
本试验中,人工催产杂交鲟和施氏鲟自交分别获得了催产率为100%和75%的结果,杂交鲟采用的催产方法与朱华等[9]得到的俄罗斯鲟人工催产最佳药物剂量和注射方式基本相同,但在4月17日,杂交鲟的受精率、孵化率均高于施氏鲟,是否是由于达氏鳇母本卵发育得更好,有待进一步研究。同时,本试验中采用的剖腹手术方法取卵适用于两种鲟类,取卵切口仅2~3 cm,相比于郗云强等[10]的手术方法(切口4 cm),此方法切口更小,更有利于亲鱼的恢复。
杂交鲟与父本施氏鲟胚胎发育的相似之处主要表现在:一是,两者的受精卵均为沉黏性卵,受精卵卵膜外有一层较厚的胶膜,对卵起到保护作用[11];二是,两者的胚胎发育时序相似,卵裂方式均为辐射卵裂,前3次卵裂均为经裂,第4次卵裂为纬裂,受精卵的第1次卵裂沟总是跟第2次卵裂沟相互垂直,前2次卵裂是均等卵裂,将动物极细胞分成大小相等的细胞,第2次卵裂之后为不均等卵裂,细胞大小开始出现明显的区别。与大部分冷水硬骨鱼类的盘状卵裂不同[12-13],这种卵裂方式在鲟类中普遍存在[14-16]。
杂交鲟与父本施氏鲟胚胎发育的区别主要表现在:杂交鲟平均卵径比施氏鲟大[4](表3),贮存营养物质较多,条件相同时,杂交鲟胚胎发育所需时间较长,较大的卵黄利于为其提供充足的营养;胚胎发育至心脏形成搏动期时,杂交鲟的心管呈“C”型,而施氏鲟的心管则成“S”型;杂交鲟胚胎心脏开始有规律的搏动时,尾末端已经接近心脏,而施氏鲟胚胎尾末端还未接近心脏时,心脏就已经开始均匀跳动[8];施氏鲟的发育速度快于杂交鲟;胚胎发育至孵出前期时,杂交鲟仔鱼出膜前尾末端超过头部,而施氏鲟仔鱼出膜前尾末端达到头部或略超过头部;刚孵出的杂交鲟比刚孵出的施氏鲟个体略大,这与郭长江等[11]得到的鲟科鱼类出膜前期胚胎尾部末端所到达位置与出膜仔鱼体长成正比的研究结果一致。杂交鲟仔鱼开口时间较晚,胚后发育时间相对较长,反映出杂交鲟仔鱼对环境的适应性及占据生态位的能力较强,具有成为较大个体的潜力。
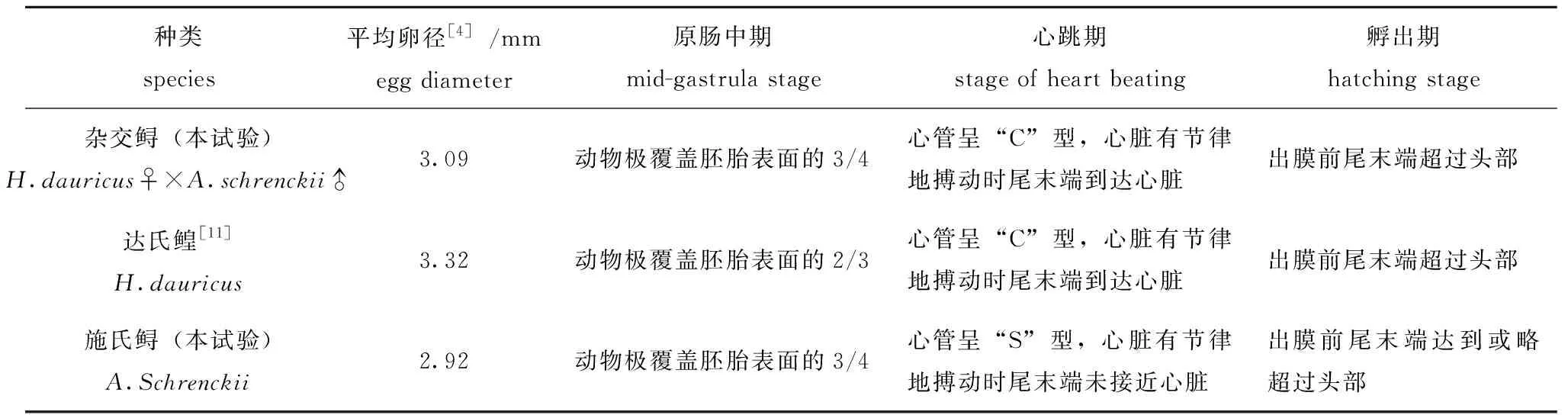
表3 杂交鲟与其父母本胚胎发育异同
3.2 杂交鲟与母本达氏鳇胚胎发育的异同
本试验中未进行母本达氏鳇的人工繁殖和胚胎发育试验,但郭长江等[11]将达氏鳇胚胎发育过程分成受精卵、卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期、心跳期和出膜期8个阶段,根据每个阶段的发生顺序和形态特征,又细分为36个时期,达氏鳇心管呈“C”型,与本试验中杂交鲟心管类型相同;孵出时,本试验中杂交鲟与达氏鳇仔鱼的尾末端均超过头部,整个胚胎发育过程中,杂交鲟与其母本的胚胎发育时序和胚胎发育特征基本相似,呈现偏母遗传特征。两者的差别主要表现在:杂交鲟比达氏鳇发育更快,原肠胚中期时,杂交鲟受精卵的动物极占胚胎表面的3/4左右,而达氏鳇受精卵的动物极约占胚胎表面的2/3(表3);胚胎发育过程中,杂交鲟的总需积温略低于达氏鳇,表现出杂种优势(表4)。
以施氏鲟为母本、西伯利亚鲟为父本的杂交鲟(施氏鲟♀×西伯利亚鲟♂)与其父母本的胚胎发育特点比较发现,虽然在胚胎发育到原肠胚中期时,杂交鲟(施氏鲟♀×西伯利亚鲟♂)动物极覆盖胚胎表面的2/3,与其父本西伯利亚鲟相同(其母本施氏鲟动物极覆盖胚胎表面的3/4),但在心跳期杂交鲟心管呈“S”型,与其母本相同(其父本心管呈“C”型),且杂交鲟胚胎发育时序和形态特征与母本基本相同[8,17-18]。通过比较两种杂交鲟与其父母本的异同可知, 施氏鲟♀×西伯利亚鲟♂[18]与本研究中对达氏鳇♀×施氏鲟♂的研究结果基本一致,均呈现偏母遗传特征。这与鲇Silurusasotus♀×南方鲇S.meridionalis♂[19]、牙鲆Paralichthysolivaceus♀×圆斑星鲽Veraspervariegatus♂[20]杂交种的胚胎发育具有偏母遗传的结果相同。
3.3 杂交鲟胚胎发育时间和积温
探索杂交鲟胚胎发育所需积温,对杂交鲟规模化苗种培育的影响及确定合理的培养温度等具有一定的指导意义。鲟类正常发育水温一般为14~20 ℃[21],不同鲟发育积温略有不同(表4)。在16~17 ℃流水中孵化,施氏鲟116 h开始有仔鱼孵出,138 h全部孵出,胚胎发育所需总积温为1 856~2 108 ℃·h,相比野生施氏鲟子代胚胎发育[8]所需积温略高。本试验中,杂交鲟123 h开始孵出仔鱼,155 h基本全部孵出,整个过程所需总积温为2 102~2 445 ℃·h,低于西伯利亚鲟[10]和匙吻鲟Polyodonspathula[22],高于施氏鲟(本试验)、杂交鲟A.schrenckii♀×A.baeri♂[15]、中华鲟A.sinensis[23]、达氏鲟A.dabryanus[24]、闪光鲟A.stellatus[25]和小体鲟A.ruthenus[26],与母本达氏鳇[16](2 148~2 592 ℃·h)相近,再次表明杂交鲟呈现偏母遗传特征。
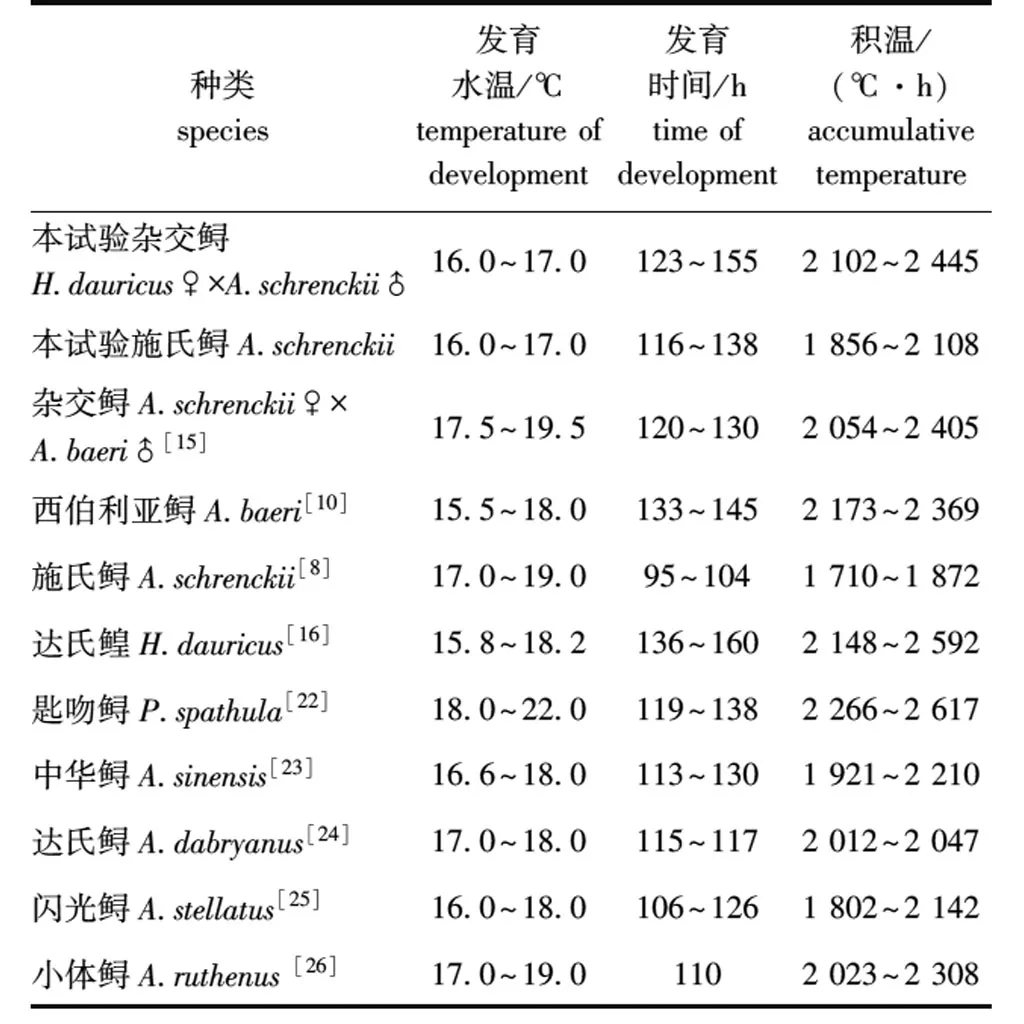
表4 几种鲟类及杂交种胚胎发育比较
除鲟科鱼类外,许多杂交鱼类也具这种特性,如杂交鳟(虹鳟Oncorhynchusmykiss♀×山女鳟O.masou♂)[27]及翘嘴鳜Sinipercachuatsi与斑鳜S.schezeri[28]正反交杂交子代胚胎发育积温也与母本相当,说明卵细胞对胚胎发育所需积温也具有决定性影响。
4 结论
1)本试验条件下,杂交鲟卵平均受精率为82.9%,平均孵化率为70.44%,施氏鲟卵平均受精率为82.2%,平均孵化率为63.20%。这说明杂交鲟达氏鳇♀×施氏鲟♂繁殖效率较父本高效。
2)水温16~17 ℃条件下,杂交鲟经123~155 h孵化出膜,总积温需2 102~2 445 ℃·h,同等条件下,施氏鲟经116~138 h孵化出膜,总积温需1 856~2 108 ℃·h。这说明杂交鲟胚胎发育积温较其父本长,与母本接近。
3)杂交鲟的胚胎发育分9个阶段32个时期,而施氏鲟胚胎发育分9个阶段28个时期。杂交鲟和施氏鲟典型的区别是胚胎发育至心脏形成搏动期时,杂交鲟的心管呈“C”型,而施氏鲟的心管则成“S”型;二者的差异还表现在心脏开始规律搏动时,杂交鲟胚胎尾末端已接近心脏,而施氏鲟还未接近心脏,出膜前期杂交鲟仔鱼尾末端超过头部,而施氏鲟刚达到或略超过头部。这说明杂交鲟与其父本胚胎发育既有相似之处又有不同点。杂交鲟胚胎发育所需积温介于父本施氏鲟和母本达氏鳇之间,但更接近于母本达氏鳇,在胚胎发育和积温等方面,杂交鲟呈现偏母遗传特征。
