曲妥珠单抗联合FLOT方案围手术期治疗可手术HER-2阳性进展期胃癌的疗效和安全性
2022-11-17候玉龙
候玉龙
(佳木斯市中心医院肿瘤外一科,黑龙江 佳木斯 154002)
胃癌是发生率、死亡率均较高的一种恶性肿瘤[1]。近年来随着临床治疗手段的不断增加,有效提高了疾病治愈率,但是进展期胃癌的预后较差。在进展期胃癌患者根治性治疗中,手术是重要手段,但术后的转移、复发风险较高,远期生存率并不高[2]。围手术期化疗对于人表皮生长因子受体-2(HER-2)阳性进展期胃癌患者预后的改善具有重要作用,但不同化疗方案所取得疗效存在差异[3],另外化疗药物联合靶向药物能够进一步提升疗效,故本文就FLOT方案联合曲妥珠单抗应用在可手术HER-2阳性进展期胃癌患者围手术期中的效果进行分析,以SOX方案为对照,旨在为临床选择更加理想的治疗方案提供参考。
1 资料与方法
1.1一般资料:选取2018年6月~2021年6月本院收治可手术HER-2阳性进展期胃癌患者92例为研究对象,随机分为对照组与观察组各46例。对照组:男30例,女16例;年龄42~70岁,平均(56.54±4.71)岁。肿瘤原发部位:胃窦26例,胃底7例,胃体9例,全胃4例。病理鉴别:高分化12例,中度分化15例,分化差或未分化19例。临床分期:Ⅱ期11例,Ⅲa期10例,Ⅲb期22例,Ⅲc期3例。HER-2状态:免疫组化(2+)和荧光原位杂交技术检测(+)10例,免疫组化(3+)36例。观察组:男28例,女18例;年龄44~71岁,平均(56.65±4.80)岁。肿瘤原发部位:胃窦25例,胃底8例,胃体8例,全胃5例。病理鉴别:高分化11例,中度分化14例,分化差或未分化21例。临床分期:Ⅱ期10例,Ⅲa期11例,Ⅲb期21例,Ⅲc期4例。HER-2状态:免疫组化(2+)和荧光原位杂交技术检测(+)9例,免疫组化(3+)37例。两组一般资料比较,差异无统计学意义(P>0.05)。具有可比性。
纳入标准:①经胃镜病理学检查确诊为胃腺癌,经免疫组化、荧光原位杂交技术检测显示HER-2阳性;②影像学检查证实为进展期,未发现远处转移,且病灶可测量;③预计生存期超过3个月者;④入组前未接受过放化疗者;⑤无手术禁忌证者。
排除标准:①血常规异常或肝、肾等脏器功能障碍者;②既往存在心肌梗死、充血性心力衰竭病史者;③存在消化道大出血、胃肠梗阻或穿孔等严重并发症者;④左心室射血分数低于50%者;⑤因严重不良反应而退出此次研究者。
1.2方法:对照组:采用SOX方案。第1天,将奥沙利铂注射液130 mg/m2溶入浓度为5%的葡萄糖溶液500 ml中,在3 h内完成静脉滴注,1次/d。第1~14天,替吉奥胶囊2片/次,口服,2次/d。一个周期为21 d,在术前、术后各治疗3个周期。
观察组:采用曲妥珠单抗联合FLOT方案。第1天,多西他赛注射液50 mg/m2、奥沙利铂注射液85 mg/m2、注射用亚叶酸钙200 mg/m2、5-氟尿嘧啶注射液2 600 mg/m2持续泵入,1次/d,静脉滴注2 h/次,第2周重复用药,2 w为1个周期,术前、术后均治疗4个周期。第1天,首次静脉滴注曲妥珠单抗8 mg/kg,1次/d,后续给药剂量为6 mg/kg,3 w为1个周期,术前、术后各治疗3个周期。
两组在治疗期间若经影像学检查显示肿瘤增大,可进行手术治疗,围术期3 w进行化疗。根据肿瘤部位选择近远端或全胃切除术联合D2清扫术。按照病理结果选择后续治疗方案,如疗效为完全缓解、部分缓解或稳定患者,采用原方案治疗,若是疾病进展,则采用mFOLFOX6方案治疗3个月,结合患者耐受情况调整化疗药物剂量。
1.3评价指标及判定标准:①抽取两组患者治疗前、治疗后的空腹静脉血10 ml。其中5 ml血液样本进行离心处理,速率为3 000 r/min,离心时间为10 min,取上层血清,应用全自动生化分析仪、电化学发光法测定血清癌胚抗原(CEA)、糖类抗原199(CA199);应用酶联免疫吸附法测定单核细胞趋化因子-1(MCP-1)、血管内皮生长因子(VEGF)、趋化因子受体-4(CXCR4)、基质衍生因子-1(SDF-1)、骨髓相关蛋白-14(MRP-14)、纤维母细胞特异性蛋白-1(FSP-1)。另外5 ml血液样本应用流式细胞仪对T淋巴细胞进行测定。②根据实体瘤的疗效评价标准(RECIST 1.0)评估两组的近期疗效,具体标准:病灶消失且持续4 w以上为完全缓解;病灶最长径之和减少超过30%为部分缓解;病灶最长径之和变化≤20%即为疾病稳定;病灶最长径之和增加超过20%,出现新病灶,即为疾病进展。疗效控制率=(完全缓解例数+部分缓解例数+疾病稳定例数)/总例数×100%。③观察两组患者治疗期间的药物不良反应发生情况。④应用PCR-直接测序法测量两组患者治疗前、治疗后外周血中的基因突变情况,计算P53、EGFR表达阳性率。⑤应用癌症患者生活质量评分量表(FACT-G v4.0)评估两组患者治疗前、治疗后的生存质量,共计4个领域27个条目,每个条目分值范围为0~4分,总分为108分,分值越低,则生存质量越差。
1.4统计学处理:采用SPSS25.0统计学软件进行t检验与χ2检验。
2 结果
2.1两组肿瘤标志物水平比较:两组患者治疗前的血清肿瘤标志物水平比较,差异无统计学意义(P>0.05);两组患者组内治疗前后、组间治疗后的血清肿瘤标志物水平比较,差异有统计学意义(P<0.05)。见表1。
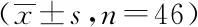
表1 两组肿瘤标志物水平比较
2.2两组T淋巴细胞水平比较:治疗前,两组T淋巴细胞水平比较,差异无统计学意义(P>0.05);治疗后,观察组T淋巴细胞水平与对照组比较,差异有统计学意义(P<0.05)。见表2。
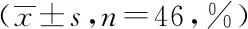
表2 两组T淋巴细胞水平比较
2.3两组近期疗效比较:与对照组比较,观察组的疾病控制率更高,差异有统计学意义(P<0.05)。见表3。

表3 两组近期疗效比较[n(%),n=46]
2.4两组不良反应发生情况比较:两组不良反应分级主要为Ⅰ级~Ⅱ级,观察组的不良反应发生率显著低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 两组不良反应发生情况比较[n(%),n=46]
2.5两组P53、EGFR表达阳性率比较:两组患者治疗前的P53、EGFR表达阳性率比较差异无统计学意义(P>0.05);治疗后,两组患者的P53、EGFR表达阳性率均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05)。见表5。
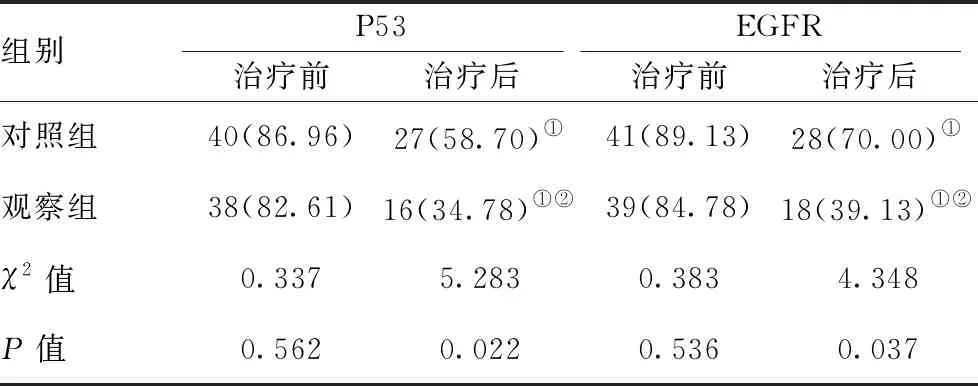
表5 两组P53、EGFR表达阳性率比较[n(%),n=46]
2.6两组生存质量评分比较:治疗前,两组生存质量评分比较,差异无统计学意义(P>0.05);治疗后,两组生存质量评分均较治疗前增高,差异有统计学意义(P<0.05),且观察组更高,差异有统计学意义(P<0.05)。见表6。
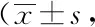
表6 两组生存质量评分比较分,n=46)
3 讨论
进展期胃癌在胃癌患者中占80%左右[4]。手术治疗该疾病的5年生存率为30%左右。HER-2在健康人体内的少量表达,在机体组织出现癌变时会出现异常高表达状态[5],会促使癌细胞增殖过快,增加侵袭性,还会加重肿瘤恶性程度,促使肿瘤细胞对化疗药物的敏感性下降,对疗效、预后产生不利影响[6-7]。
临床在HER-2阳性进展期胃癌患者围术期应用SOX方案虽然能够在一定程度上对癌细胞浸润、生长、转移进行抑制[8-9],但是疾病控制率并不理想。FLOT方案中通过多西他赛、奥沙利铂、亚叶酸钙、5-氟尿嘧啶可起到较好的抗肿瘤作用,但是不良反应较大,部分患者难以耐受,会导致治疗依从性、临床疗效下降。靶向治疗可使肿瘤细胞特异性死亡,不会损伤正常组织细胞,同化疗相比具有特异性抗肿瘤作用、不良反应少等特点[10-11]。
此次研究中,治疗后,观察组的肿瘤标志物水平、T淋巴细胞水平均更优,疾病控制率更高,不良反应少、P53、EGFR表达阳性率更低,生存质量评分更高,充分表明了FLOT方案联合曲妥珠单抗的效果显著。曲妥珠单抗作为一种靶向治疗药物,能对HER-2介导的生物学功能进行拮抗[12],对细胞周期进展以及HER-2的转录、表达进行抑制,阻止血管生成,从而可提升化疗效果。同时曲妥珠单抗能够抑制HER-2、P53、EGFR的异常表达水平,对肿瘤细胞增殖活性进行抑制,减少肿瘤局部新生血管的形成[13-14],促使癌细胞凋亡,有利于增强免疫球蛋白的抗肿瘤活性,因此与FLOT方案联用能够减少对免疫功能影响的同时更好地提升抗肿瘤效果,减轻化疗药物的不良反应,提升患者的生存质量。同时根据血清肿瘤标志物水平的变化可判断该病患者的病程进展、疗效[15],有助于后续治疗方案的调整,以更好地改善预后。
综上所述,曲妥珠单抗与FLOT方案联合应用在可手术HER-2阳性进展期胃癌患者中具有较高的有效性和安全性。
