焙烧-水化络合法脱除镁废渣中钙杂质的研究
2022-11-17曾彦捷徐同飞黄子良陈志鹏刘旭东易美桂
曾彦捷,徐同飞,黄子良,陈志鹏,刘旭东,易美桂
(1.四川大学化学工程学院,四川成都 610065;2.攀钢集团海绵钛分公司;3.成都昌农科技有限公司)
含钙镁废渣是熔盐氯化法钛白工艺副产物,含钙镁废渣经过除钙提纯,可以作为制备高纯镁盐的基础原料,市场前景十分可观[1-2]。
高纯氧化镁(氧化镁质量分数大于99.00%)具有优良的耐高温、耐腐蚀、电绝缘、光透过和保温特性,广泛应用于电子、光学、医疗、冶金、钢铁、国防和航空航天等领域。氧化镁作为重要的无机材料产品,市场需求量巨大[3-10]。中国高纯氧化镁工业制备途径主要为菱镁矿(氧化镁质量分数为47.81%)、白云石(氧化镁质量分数为21.71%)煅烧[11-13],受原料组成和生产技术限制,产品中含有氧化钙或氯化钙等杂质,严重降低了氧化镁的纯度[14-15]。含钙镁废渣主要由碱式碳酸镁和碳酸钙组成,其经1 000℃焙烧至质量恒定,渣中镁质量分数为95.88%,杂质组分单一,是一种优质的二次含镁资源。目前,含钙镁废渣主要提纯方法是在液相中进行除钙。郑莉娜等[16]在碳化过程中加入乙酰丙酮,并控制体系pH,得到改良的液相除钙方法。但是,目前缺少固相除钙制备高纯氧化镁方面的报道。
为此,本文以含钙镁废渣为原料,通过高温焙烧-EDTA络合法脱除其中的钙杂质并制备出纯度大于99.00%的氧化镁,探讨了焙烧温度与时间、EDTA溶液浓度、浸洗温度与水化时间等对钙脱除率的影响。采用固相除钙的方法,为含钙镁废渣的绿色高值利用提供了一条新途径。
1 实验部分
1.1 试剂及仪器
试剂:乙二胺四乙酸二钠(AR)、氧化锌(基准试剂)、氯化铵(AR)、氨水(AR)、氢氧化钠(AR)、去离子水。原料:含钙镁废渣,来自国内某厂,主要成分为CaCO3和4MgCO3·Mg(OH)2·4H2O,经1 000℃焙烧至质量恒定,化学组成为w(MgO)=95.88%、w(CaO)=3.68%、w(NaCl、SiO2、Al2O3等)=0.44%。
仪器:恒温搅拌水浴锅、电子天平、电热鼓风干燥箱、马弗炉、循环水式多用真空泵、AXIS Supra型X射线光电子能谱仪(XPS)、D8 advance X射线衍射仪(XRD)、TGA/DSC2型同步热分析系统。
1.2 实验方法
取10.0 g镁废渣于马弗炉(300~900℃)中焙烧0.5 h,所得产物冷却至室温,将焙烧产物与EDTA溶液(0.01 mol/L)按液固质量比为(20~100)∶1于常温下混合,在搅拌转速为300 r/min条件下恒温浸洗(1~4 h)后过滤,将浸洗渣与100 mL去离子水混合,在搅拌转速为300 r/min条件下洗涤0.25 h后过滤,反复洗涤3遍,烘干(105℃、8.0 h)后待测。
1.3 表征方法
采用AXIS Supra型X射线光电子能谱仪分析样品表面元素组成和价态。采用D8 advance型X射线衍射仪分析样品晶体结构。采用CIC-D160型离子色谱仪测定样品中的钠、钙、镁、硅等元素。采用TGA/DSC2型同步热分析系统对样品进行差热-热重分析。采用EDTA滴定法分析样品中的氧化镁纯度与氧化钙含量。
2 结果与讨论
2.1 原料
图1为含钙镁废渣的XRD、XPS图。由图1a可见,含钙镁废渣中主要存在的物相为4MgCO3·Mg(OH)2·4H2O,另有其他锯齿形不规则小峰,表明还有无晶型或晶型较差的物质存在。由图1b可见,渣中钙元素的2p1/2峰和2p3/2峰分别位于351.0 eV和347.4 eV,与前人测得的CaCO3中的Ca 2p1/2(351.1 eV)、Ca 2p3/2(347.4 eV)相吻合,说明钙是以CaCO3形式存在,但XRD谱图中并未观察到CaCO3特征吸收峰,可能是因为CaCO3以非晶体结构形式存在或原渣中钙含量低且被含镁物相包裹。

图1 含钙镁废渣的XRD谱图(a)、XPS图(b)Fig.1 XRD patterns(a)and XPS spectrum(b)of waste slag containing calcium and magnesium
2.2 焙烧规律
通过焙烧→浸洗→过滤→洗涤制得浸出液和浸洗渣,浸洗液用于分析测试钙脱除率、镁纯度,浸洗渣经烘干(105℃、8.0 h)分析其物相结构与组成。考察焙烧温度影响时,固定焙烧时间为0.5 h,焙烧产物在EDTA浓度为0.01 mol/L、液固质量比为100∶1的溶液中常温浸洗1.5 h。考察焙烧时间影响时,固定焙烧温度为800℃,水化浸洗条件不变。
2.2.1 焙烧温度的影响
图2为不同焙烧温度对浸洗渣氧化镁含量及含钙镁废渣中钙脱除率的影响。由图2可知,固定其他反应条件,随焙烧温度升高,钙脱除率和浸洗渣中氧化镁含量均有明显增加,800℃时二者均达到极值(钙脱除率为98.70%,浸洗渣氧化镁质量分数为98.60%),说明升高温度有利于钙的脱除。焙烧温度高于800℃后,钙脱除率和浸洗渣中氧化镁含量均无明显变化,因此确定焙烧温度为800℃。
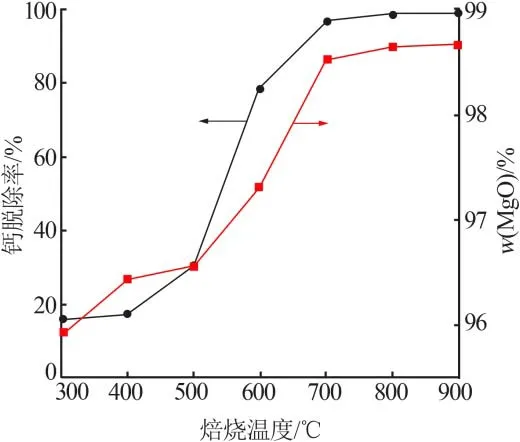
图2钙脱除率及氧化镁含量随焙烧温度的变化Fig.2 Change of calcium removal rate and magnesium oxide content with calcination temperature
图3 为镁废渣差热-热重分析结果。由图3可知,镁废渣热分解过程分为两个阶段:第一阶段的温度范围为150~325℃,DTG最大吸热峰位于245℃,质量损失率约为15%,与碱式碳酸镁失去全部结晶水的理论损失率(15.5%)基本一致,对应化学方程式如式(1)所示。

图3 镁废渣差热-热重分析曲线Fig.3 Differential thermogravimetric analysis curves of magnesium waste residue
第二阶段的温度范围为350~550℃,DTG最大吸热峰位于430℃。此阶段的质量损失速率较快,质量损失率约为39.8%,与碱式碳酸镁失去全部结晶水完全分解为二氧化碳和氧化镁的理论质量损失率(41.6%)基本一致。碱式碳酸镁完全分解,对应化学方程式如式(2)所示。

图4为不同焙烧温度下焙烧渣XRD谱图。由图4可知,300℃时4MgCO3·Mg(OH)2·4H2O特征吸收峰完全消失,出现4MgCO3·Mg(OH)2特征吸收峰;400℃时4MgCO3·Mg(OH)2特征吸收峰完全消失,出现MgO特征吸收峰,说明在此温度范围内4MgCO3·Mg(OH)2·4H2O先受热分解为4MgCO3·Mg(OH)2,后者随温度升高逐渐分解为MgO。同时,随含镁物相逐渐分解,被其包裹的CaCO3裸露出来,因此400℃时出现CaCO3特征吸收峰。700℃时CaCO3特征吸收峰完全消失,说明在此温度下CaCO3受热分解。

图4 不同焙烧温度下焙烧产物的XRD谱图Fig.4 XRD patterns of calcined products at different calcination temperatures
2.2.2 焙烧时间的影响

图5钙脱除率及浸洗渣中氧化镁含量随焙烧时间的变化Fig.5 Change of calcium removal rate and magnesium oxide content in leaching slag with roasting time
图5为不同焙烧时间对钙脱除率和浸洗渣中氧化镁含量的影响。由图5可知,固定其他反应条件,随焙烧时间增加,钙脱除率和浸洗渣中氧化镁含量均呈现先增加后趋于稳定的变化趋势,二者均于0.5 h达到极值(钙脱除率为98.70%,浸洗渣氧化镁质量分数为98.60%),说明增加焙烧时间至0.5 h有利于钙的脱除,因此确定焙烧时间为0.5 h。
2.3 EDTA络合
焙烧渣水化过程中渣中钙、镁组分会进入液相并以离子状态(Ca2+、Mg2+)存在,Ca2+、Mg2+与EDTA络合,涉及的化学反应如式(3)~(15)所示,其平衡常数(K3~K15)见图6。


图6 反应(3)~(15)平衡常数Fig.6 Equilibrium constant of reaction(3)~(15)
根据物料守恒、电荷守恒和相关平衡方程可求出溶液中各组分的平衡浓度,各组分平衡浓度随EDTA溶液浓度的变化见图7。在c([EDTA]4-)=0.005~0.012 mol/L时,溶液中的EDTA以[Ca(EDTA)]2-形式存在,且随EDTA浓度增大[Ca(EDTA)]2-含量增加,[Mg(EDTA)]2-组分平衡浓度均小于1×10-9mol/L。含EDTA组分的平衡浓度由大到小依次为[Ca(EDTA)]2-、[Mg(EDTA)]2-、[CaH(EDTA)]-、[EDTA]4-、[H(EDTA)]3-、[MgH(EDTA)]-、[H2(EDTA)]2-、[H3(EDTA)]-、H4(EDTA)、[H5(EDTA)]+。

图7 EDTA浓度对反应平衡时各离子浓度的影响Fig.7 Effect of EDTA concentration on ion concentration in equilibrium reaction
含钙组分的平衡浓度随温度的变化见图8。图8结果表明,20~90℃下,溶液中的钙以[Ca(EDTA)]2-形式存在,随温度升高[Ca(EDTA)]2-无明显变化,但Ca2+浓度和[Ca(OH)]+浓度明显降低,说明温度升高抑制Ca(OH)2(s)的溶解和电离。

图8 温度对钙组分平衡浓度的影响Fig.8 Effect of temperature on equilibrium concentration of calcium components
2.4 浸洗实验
在温度为800℃、时间为0.5 h条件下,考察了不同EDTA浓度、浸洗温度、时间与液固质量比对钙脱除率及浸洗物氧化镁含量的影响,结果如图9所示。图9表明,提高EDTA浓度、增加液固质量比或延长浸洗时间,钙脱除率和浸洗物中氧化镁含量均呈现先增加后趋于稳定的变化趋势,在c(EDTA)=0.01 mol/L、液固质量比为80∶1或浸洗时间为2.0 h条件下,二者均达到极值(钙脱除率为98.78%,浸洗渣氧化镁含量为99.04%)。相反地,提高浸洗温度,钙脱除率及浸洗物中氧化镁含量均呈现减小趋势(钙脱除率从98.76%降至87.78%,浸洗渣氧化镁含量从99.04%降至98.03%)。由此说明,提高EDTA浓度、增加液固质量比或延长浸洗时间有利于钙的脱除,提高浸洗温度不利于钙的脱除。综合考虑,确定浸洗条件:常温、EDTA浓度为0.01 mol/L、液固质量比为80∶1、水化时间为2.0 h。
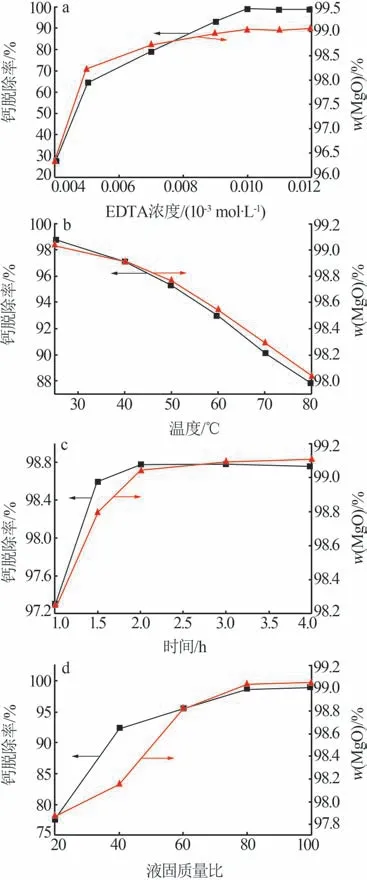
图9 EDTA浓度(a)、浸洗温度(b)、时间(c)和液固质量比(d)对钙去除率及浸洗渣氧化镁含量的影响Fig.9 Effect of EDTA concentration(a),leaching temperature(b),time(c)and liquid-solid mass ratio(d)on calcium removal rate and magnesium oxide content of leaching slag
3 结论
本文研究了高温焙烧-EDTA络合法脱除镁废渣钙杂质的规律。原料中的钙杂质以CaCO3形式存在,焙烧过程使CaCO3逐渐分解,在水化过程中形成Ca(OH)2微溶物,并进一步与EDTA络合进入液相,从而从MgO中脱除。
热力学计算表明,体系中钙、镁离子与EDTA的络合能力存在明显差异,这是水化络合实现钙镁分离的根本原因。水化温度对除钙效果的影响取决于溶解电离与络合过程的综合作用,当EDTA浓度较低时,升高温度不利于水化络合。镁废渣在温度为800℃、时间为0.5 h条件下焙烧,焙烧产物在EDTA浓度为0.01 mol/L下的溶液中常温水化2.0 h,含镁废渣中的钙脱除率高达98.78%,制得了组成为w(MgO)=99.04%,w(CaO)=0.05%,w(NaCl、SiO2、不溶物等)=0.91%的高纯氧化镁产品,符合HG/T 2573—2012《工业轻质氧化镁》中Ⅰ类及Ⅱ类优等品指标(MgO纯度≥95%,CaO质量分数≤0.5%)要求。
