屠宰方式对肉羊血液生化指标、肌肉应激及食用品质的影响
2022-11-17王晓政王莉梅张园园邹志伟邹玉富王德宝
王晓政,王莉梅,张园园,邹志伟,邹玉富,王德宝*
(1.内蒙古农业大学职业技术学院,内蒙古包头 014109;2.内蒙古自治区农牧业科学院农产品加工所,内蒙古呼和浩特 010031;3.内蒙古锡林郭勒盟正镶白旗蒙盛肉业有限公司,内蒙古锡林郭勒盟 013800)
在肉及肉制品加工方面,屠宰方式对动物福利、肉品质、卫生质量及安全性等具有重要的影响。屠宰方式的差异会引起动物疼痛、惊吓等产生的应激程度也出现差异,影响动物宰后胴体新陈代谢及肉品质[1]。动物在宰前经历禁食、温度变化、疲劳、惊吓、颠簸等应激以及屠宰过程遭受疼痛及恐惧等,会导致机体产生系列异常的代谢反应,造成肌肉pH 下降、营养物质损耗,甚至导致PSE 肉产生,最终降低了肉制品食用品质及保水性能[2-4]。
抹脖子屠宰法是动物被通过切断脖颈静动脉、食道和气管进行屠宰,屠宰过程经吊挂、移动、血流等惊吓持续时间较长,给动物造成较大的痛苦和应激[5]。相比抹脖子屠宰方式,掏心式屠宰是指动物在束缚住四肢后经开腹5 cm、握心致心脏停止跳动而致晕死,其对动物造成惊吓较小、全程屠宰动物应激反应较低[6]。电击晕屠宰方式因其高效、方便等优点在屠宰行业得到广泛应用[7]。国内外学者对电击晕方式易导致淤血点、骨折及放血率低等方面保持了一致观点,而对于电击晕影响畜禽肉食用品质的变化存在争议[4]。本文针对抹脖子屠宰、掏心式屠宰及电击晕后屠宰3 种方式,分别从肉羊在屠宰过程血液应激指标、肌肉糖酵解指标、嫩度、熟肉率、脂肪酸及挥发性风味物质组成方面综合评价抹脖子屠宰、掏心式屠宰及电击晕后屠宰方式对肉羊动物福利及食用品质的影响。
1 材料与方法
1.1 试验材料 本试验选取体重(43±2)kg、无疫病的健康的12 月龄蒙古羊18 只(公母各半),平均分为3 组,每组3 只公羊与3 只母羊,用于试验中传统屠宰、掏心式屠宰及电击晕屠宰。
三氯甲烷、甲醇、氢氧化钠、正己醇,分析纯,购于上海国药集团。丙酮酸激酶、己糖激酶活性及乳酸含量测定试剂盒购于北京盒子生工科技有限公司;乳酸脱氢酶与肌酸激酶活性测定试剂盒购于北京盈泽通汇生物科技有限公司;磷酸果糖激酶活性测定试剂盒购于北京佰凯生物科技有限公司;磷酸化腺苷酸活化蛋白激酶活性测定试剂盒购于北京雪杰特科技有限公司;糖原测定试剂盒购于南京邦汇诚生物科技有限公司。
1.2 仪器与设备 Agilent GC7890B789 型气相色谱购自美国安捷伦科技有限公司;DFM-96 10 管放射免疫γ计数器购自合肥众成机电技术开发有限责任公司;C-LM3B 嫩度仪购自北京天翔飞域仪器有限公司;TBA-120FR 全自动生化分析仪购自日本东芝公司;ISQ 7000 GC-MS 气质联用仪购自美国Thermo Fisher Scientific 公司;HH-2 恒温数显式水浴锅购自常州隆和银器制造有限公司。
1.3 样品采集 本试验以常用传统屠宰(抹脖子)为对照,对比掏心式及电击晕方式屠宰对肉羊在屠宰过程造成的应激及宰后肌肉糖酵解、羊肉食用品质影响进行分析。电击晕屠宰方式:使用110 V 点击电击肉羊头部3 s,电击晕后抹脖子屠宰。屠宰后立即采血,并在宰后45 min 进行采样(采样部位:背最长肌),用于测定宰后羊肉糖酵解指标及食用品质指标的肉样被切成方块后用液氮迅速冷冻装于冻存管,保存于-80℃。
1.4 测定指标与方法
1.4.1 血液指标测定 取20 mL 新鲜血液分装于4 个10 mL离心管,于4℃条件下3 000 r/min 离心10 min,取血清置于1.5 mL 离心管后保存于-80℃冰箱,用于血液中各种酶活性及糖原和乳酸含量的测定。采用DFM-96 型 10 管放射免疫γ计数器(GC-1500,安徽中科中佳科学仪器有限公司,安徽)测定促肾上腺素皮质激素(Adrenocorticotrophic Hormone,ACTH)和皮质醇(Cortisol,COR)含量。
乳酸、糖原含量及乳酸脱氢酶(LDH)、肌酸激酶(Creatinekinase,CK)、磷酸化腺苷酸活化蛋白激酶(AMPK)、丙酮酸激酶(PK)、磷酸果糖激酶(Phosphofructokinase,PFK)、己糖激酶(Hexokinase,HK)的测定参照相应试剂盒说明书进行。
1.4.2 肌肉糖酵解指标测定 取0.3 g 冻存管中肉样置于研钵中进行研磨为碎样,加入2.7 mL PBS 缓冲液进行稀释,然后在4℃条件下匀浆60 s。匀浆液于 4℃条件下10 000 r/min 离心5 min,取上清液用磷酸化腺苷酸活化蛋白激酶活性测定试剂盒测定AMPK 活力。

1.4.3 熟肉率及剪切力测定 熟肉率:将修整好、30~40 g背最长肌进行称重,记为m1,装于5 号自封袋并置于80℃水浴锅中进行加热,待中心温度达到75℃后持续20 min,结束后取出于室温条件下自然冷却,冷却后用滤纸沾干背最长肌表面汁液,称重即为m2。
剪切力:熟肉率测定完毕后的肉样用于剪切力测定,首先对肉样进行修整,然后沿纤维方向切取横截面为1 cm×1 cm 的肉条,最后借助嫩度仪进行测定,测定多次后去除最大和最小值,计算平均值。
1.4.4 脂肪酸测定 参照《食品安全国家标准食品中脂肪酸的测定》(GB 5009168-2016)测定肉样中脂肪酸含量[8]。
1.4.5 风味物质测定 在20 mL 样品瓶中加入5 g 切碎,将老化的萃取头插入样品瓶使石英纤维头暴露于样品上部空间,在60℃条件下吸附40 min 后拔出,萃取头在GC 进样口(250℃)下解吸附3 min。
挥发性风味成分的GC-MS 条件:GC 条件:TR-5毛细色谱柱(30 m×0.25 mm×0.25 μm),载气为He,载气流速为 1.0 mL/min,传输线温度 250℃,不分流进样,进样时间 1 min;升温程序:40℃保持3min,以4℃/min升温到150℃,保持1 min,再以5℃/min 升温到200℃,最后以20℃/min 升至230℃,保持5 min。MS 条件:离子源温度250℃,进样口温度 250℃,质量扫描范围30~400(m/z)。质谱数据经与MEANLIB、NISTDEMO和Wiley Library 检索定性,将匹配度大于800 作为鉴定依据。
1.5 统计分析 采用 Excel 及SPSS 19.0 对数据进行统计、方差分析及多重比较,数值以平均值±标准差表示,使用Origin 18.0 进行作图。
2 结果与分析
2.1 屠宰方式对蒙古羊血液生化指标、糖酵解及AMPK活性的影响 由表1 可知,肉羊血液中LDH 活性和COR 浓度表现为抹脖子组>掏心组>电击晕组。电击晕组乳酸含量最高,而掏心式组乳酸含量最低,而血液中血糖与乳酸含量变化趋势相反。掏心组AMPK 活性水平最低,传统抹脖子屠宰组AMPK 活性高于电击晕组。抹脖子组CK 和LDH 活性高于电击晕组和掏心式组(P>0.05)。
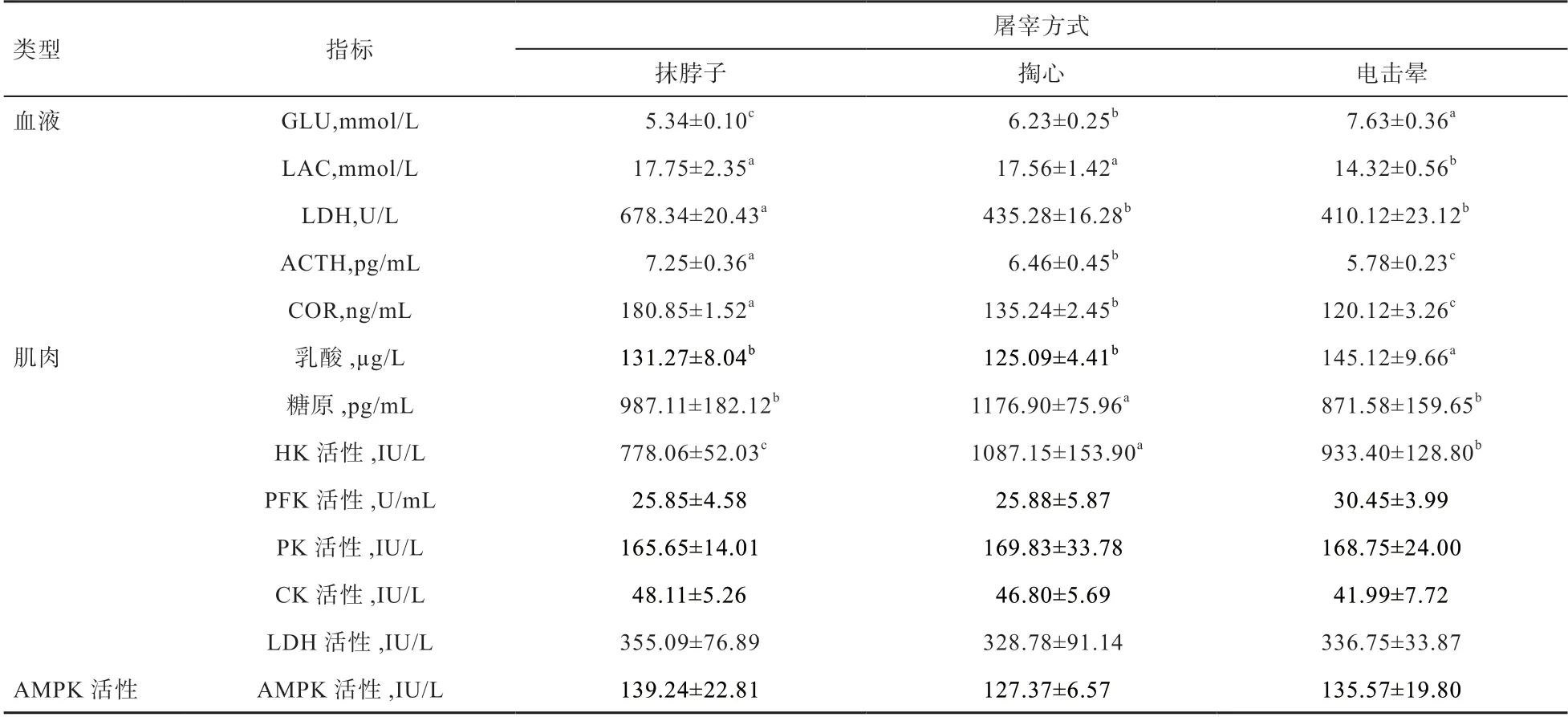
表1 屠宰方式对肉羊血液生化指标、糖酵解及AMPK 活性的影响的影响
2.2 屠宰方式对蒙古羊食用品质的影响 由表2 可知,掏心式屠宰组羊肉熟肉率为60.52%,高于抹脖子组的58.95%和电击晕组的58.50%(P>0.05)。剪切力值大小与肉的嫩度呈现负相关,低的剪切力值则表示肉拥有较好嫩度。3 组羊肉剪切力变化为抹脖子组>电击晕组>掏心式组。

表2 屠宰方式对羊肉嫩度和熟肉率的影响
2.3 屠宰方式对蒙古羊脂肪酸组成的影响 由表3 可知,肌肉中饱和脂肪酸占比较高,单不饱和脂肪酸次之,多不饱和脂肪酸比重较低。棕榈酸和硬脂酸对饱和脂肪酸的变化起到主要贡献作用。电击晕组的棕榈酸和硬脂肪酸相对含量>抹脖子组>掏心式组。单不饱和脂肪酸中油酸含量占比较高,且电击晕组和掏心式组的油酸含量高于传统抹脖子屠宰组(P<0.05)。反式亚油酸对多不饱和脂肪酸组成起到主要贡献作用,α-亚麻酸次之。掏心式组和电击晕组的不饱和脂肪酸含量分别为281.40、274.39 mg/100g,高于传统抹脖子组的251.16 mg/100g。

表3 屠宰方式对宰后羊肉中脂肪酸组成的影响
2.4 屠宰方式对蒙古羊挥发性风味物质组成的影响 由表4 可知,组成蒙古羊的主要挥发性风味物质包括16 种,分别由醛类、醇类、酮类及酸类等组成。羊肉中醛类风味物质相对含量显著高于其他种类挥发性风味物质。羊肉中共检出7 中主要醛类物质,正己醛、壬醛含量相对较高。掏心组的己醛和壬醛相对含量高于传统抹脖子组和电击晕组(P<0.05),抹脖子组与电击晕组无显著差异。3 组的苯甲醛相对含量为掏心组>抹脖子组>电击晕组。醇类物质在羊肉中主要包括8 种,其中对羊肉贡献较大的主要是苯甲醇和1-辛烯-3-醇。2 种风味物质在掏心式屠宰组相对含量最高,电击晕组次之,抹脖子组相对含量显著低于上述两组。酮类物质中3-甲基-2-庚酮均高于0.25×107/g,具有浓郁的水果香味,结果为掏心组>抹脖子组>电击晕组。
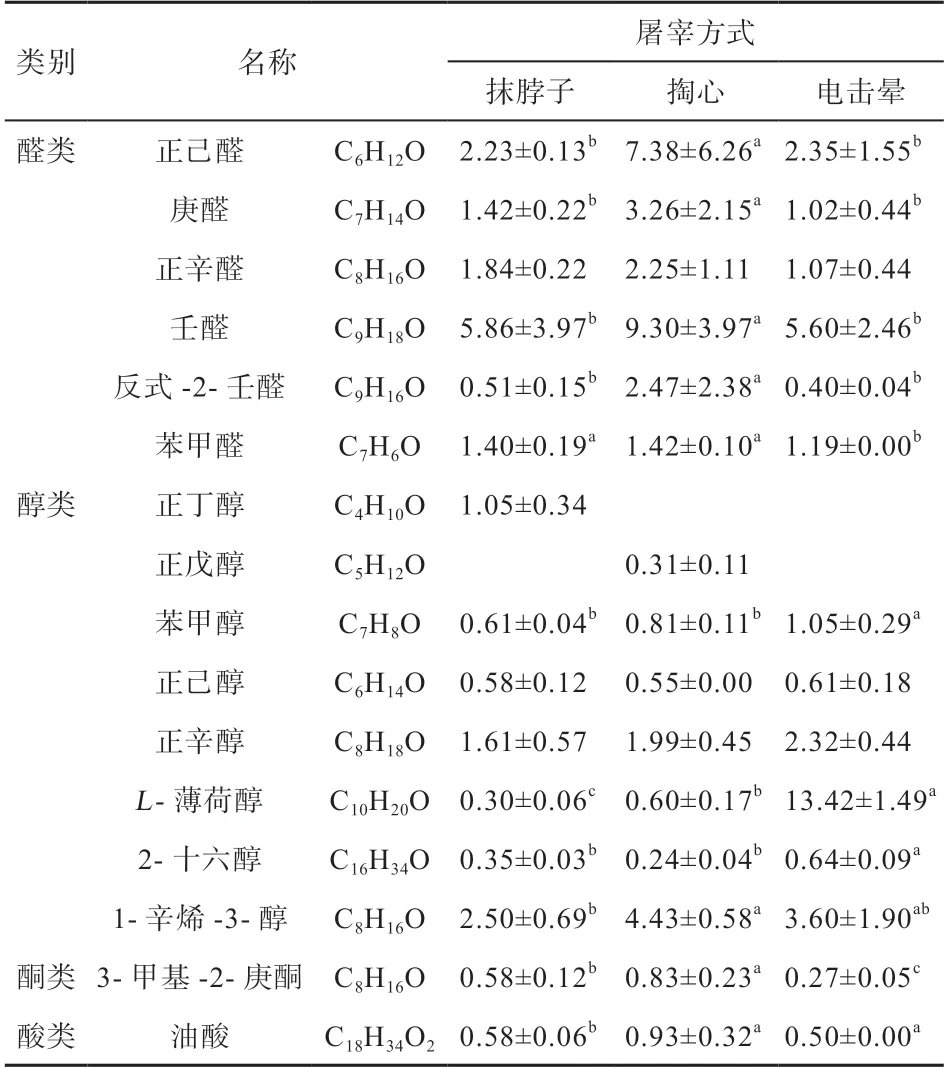
表4 屠宰方式对宰后羊肉风味物质组成的影响(以单位质量峰面积表示107/g)(n=6)
3 讨 论
3.1 屠宰方式对肉羊应激指标的影响 宰前的抓捕、运输、禁食及屠宰方式等均会给肉羊带来不同程度的应激[9-10]。闫祥林等[9]报道,相比于传统屠宰方式,电击晕屠宰有利于减小肉羊在屠宰时引起的应激,改善羊肉的嫩度及食用品质。血液生化指标变化反映畜禽等对外界应激程度的回应。畜禽遭受应激后,机体神经内分泌系统快速应答,血液中LDH 及COR 呈现不同程度增加[7,11],可能是由于屠宰方式不同造成屠宰持续时间和应激强度大小不同所致[13-14]。本试验中,抹脖子组肉羊血液中LDH活性和COR 浓度高于掏心组及电击晕,这可能与屠宰时屠宰方式不同造成屠宰持续时间和应激强度大小不同所致[7,13]。同时掏心式组屠宰组血液中乳酸含量最低,原因可能是屠宰时引起惊吓程度较小、肉中糖原消耗较少。进一步说明传统抹脖子屠宰对肉羊造成惊吓及应激伤害高于电击晕和掏心式屠宰方式。相比可知,掏心式和电击晕屠宰方式可减少肉羊应激反应,有助于改善肉品质。有报道称在肉羊屠宰时采用合理的电击晕方式可以减小其应激强度和改善肉品质[5,9,14]。
AMPK 在调节糖、脂肪、蛋白质三大营养物质代谢过程中发挥重要作用,也被成为细胞的“能量监测器”[15-16]。在糖酵解进程中,AMPK 通过调节葡萄糖摄取进而抑制糖原合成,促使葡萄糖向糖酵解方向进行[17]。并且宰后肌肉中氧气被大量消耗,AMP/ATP 比例升高,进而AMPK 酶活被激活,活化后的AMPK 通过调控HK、PFK、PK 等糖酵解关键酶进而调节糖酵解进程[23]。激活后的AMPK 可通过增加ATP 细胞水平抑制糖原合成和糖异生途径,在维持机体能量需求的平衡过程中起到重要作用[19]。掏心式屠宰和电击晕屠宰快速、灵敏等对肉羊造成应激反应较小,而传统抹脖子屠宰对肉羊屠宰过程持续时间较长、屠宰应激反应较大造成AMPK 活性高于掏心组和电击晕组。高的CK 及LDH 活性进一步说明抹脖子屠宰对肉羊在屠宰过程造成的应激程度高于其他2 组。此外,Li 等[17]研究表明AMPK 活性较低的猪种具有较好的食用品质。肉中肌酸激酶与LDH 活性变化反映了肉羊在宰杀过程中应激和能量代谢的程度。
3.2 屠宰方式对肉羊食用品质的影响 熟肉率和嫩度是羊肉品质重要的评价指标。高的熟肉率有助于改善肉质口感、嫩度,更反映其具有较好的品质特点。掏心式组的熟肉率较高说明这种屠宰方式有助于提高羊肉持水性能。有报道称,电击晕屠宰易导致肌肉纤维蛋白质发生激烈变化、提高肌肉蛋白降解程度[20],这一变化可能降低蛋白质对水分的束缚能力,使得电击晕组熟肉率低于掏心式和抹脖子2 组。剪切力结果说明经掏心式屠宰后肉羊嫩度较好,而抹脖子组嫩度相对最低。闫祥林等[9]研究表明,使用127 V 电击晕处理显著改善了新疆多浪羊肉嫩度。本试验结果表明,使用电击晕处理后蒙古羊羊肉嫩度也好于传统抹脖子屠宰。
3.3 屠宰方式对肉羊脂肪管组成的影响 肌肉中脂肪酸组成主要包括饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸,脂肪酸组成与肉的嫩度、风味及多汁性具有密切关系。摄入适量单不饱和脂肪酸和多不饱和脂肪酸(ω-6 及ω-3)可以有效预防心血管、中风等疾病,对人体具有重要的营养保健价值[20-22]。本试验中,掏心式和电击晕式屠宰有助于提高肌肉中不饱和脂肪酸的相对含量,对改善肉品质起到重要作用。
3.4 屠宰方式对肉羊风味组成的影响 脂质、蛋白质分解分解产物及其组成单位是肉中挥发性风味物质的主要前体[23-29]。风味物质的组成种类、相对含量、阈值对羊肉风味具有重要的影响[25]。正己醛、壬醛含量相对较高,分别呈现草香、果香味,前体物质是亚油酸和亚麻酸,阈值较低、分别为10、1 µg/kg,为羊肉风味的主要贡献者[26-28]。苯甲醛是羊肉中主要芳香醛[29],呈现坚果、肉桂等香味,而掏心组中苯甲醛相对含量最高。在羊肉中主要包括的8 种醇类物质中,苯甲醇和1-辛烯-3-醇对羊肉贡献较大,两者分别具有茉莉香、蘑菇香等特征香味[30],后者源于花生四烯酸和亚油酸的脂质氧化。本试验中,掏心式屠宰后肉羊特征风味物质含量最高,电击晕组的相对含量大于抹脖子组。结合以上应激指标及品质分析,可知掏心式屠宰有助于降低肉羊应激、改善羊肉食用品质及风味感官。
4 结 论
本试验结果显示,相比抹脖子屠宰,掏心式屠宰有利于降低血液及肌肉应激变化、改善肉嫩度、保水率以及提高肉中特征风味物质的相对含量,电击晕屠宰次之。
