原花青素对吐鲁番黑羊精液冷冻保存效果的研究
2022-11-17艾克拜尔艾合麦提宋玉坤阿里木江喀迪尔努尔博依热木拜科热衣拉古丽热依木阿布力孜吾斯曼
艾克拜尔·艾合麦提,宋玉坤,阿里木江·喀迪尔,努尔博·依热木拜科,赵 茜,樊 琛,热衣拉古丽·热依木,阿布力孜·吾斯曼*
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2.新疆农业广播电视学校沙雅县分校,新疆沙雅 842200;3.徽商生态牧业有限公司,新疆吐鲁番 838100)
精液冷冻保存有助于通过人工授精进行遗传改良,消除人工授精应用中的地理障碍,保证濒危品种的保存,从而保护生物的多样性[1]。然而,精液冷冻过程会引起精子的超微结构和生化功能改变,尤其是精子质膜和染色质受损,精子膜通透性增加,产生活性氧(ROS)并发生脂质过氧化反应(LPO),导致精子活力降低、DNA 断裂、细胞凋亡,影响精子的受精能力和早期胚胎的发育[2]。
原花青素(Proanthocyanidin,PC)是一种来自葡萄籽提取物的多酚生物类黄酮,能有效清除多种ROS和自由基,有效地抑制脂质过氧化,使细胞免于氧化损伤[3]。研究表明,PC 通过其抗氧化活性防止小鼠脑细胞中乙醇诱导的DNA 损伤[4],并防止小鼠肝脏细胞(Fao)中H2O2诱导的DNA 损伤,减少氧化应激,并增强硫酸镍诱导的大鼠睾丸中的精子活力[5]。吐鲁番黑羊能够适应吐鲁番盆地恶劣的炎热干旱多风沙气候,且在粗纤维多、木质化强的牧草环境中能快速生长发育,是新疆优良地方绵羊品种之一[6]。开展吐鲁番黑羊精液冷冻保存研究可充分提高其优良种公畜的利用率,并为自主培育优秀种公羊提供丰富的遗传资源。因此,本实验通过在吐鲁番黑羊精液冷冻过程中添加不同浓度的PC,研究其对吐鲁番黑羊冷冻精液的保护作用,通过检测精子的品质来证明添加PC 对吐鲁番黑羊精液冷冻保存技术的影响,为今后绵羊精液冷冻技术在实际生产中的应用提供理论依据。
1 材料与方法
1.1 主要试剂 原花青素购自源叶生物公司;葡萄糖、柠檬酸、Tris 购自Sigma 公司;青霉素钠、硫酸链霉素购自Amresco 公司;过氧化氢酶(CAT)、总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)活性等检测试剂盒均购自南京建成生物工程研究所;姬姆萨染色试剂盒购自生工生物工程(上海)股份有限公司;花生凝集素荧光标记(PNA-FITC)染色试剂盒购自Genmed 公司。
1.2 主要仪器设备 酶标仪iMark 购自美国Bio-Rad 公司;离心机5424 购自德国Eppendorf 公司;计算机辅助精子分析系统(CASA,田园奥瑞,2001532);倒置显微镜IX71 购自Olympus 公司。
1.3 实验方法
1.3.1 稀释液配制 基础稀释液(I 液):Tris 3.04 g、无水葡萄糖1.136 g、无水柠檬酸1.554 g、青霉素1 000 IU/mL、链霉素1 000 IU/mL,去离子水溶解定容至100 mL,调整pH 为7.2,4℃冰箱保存备用。基础稀释液(II 液):Tris 3.0 g 葡萄糖6.0 g、柠檬酸1.7 g、青霉素1000 IU/mL、链霉素1 000 IU/mL,去离子水溶解定容至100 mL,调整pH 为7.2,0.22 μm 滤头过滤后置于4℃冰箱保存备用。对照液III 液为法国卡苏商品化稀释液OPtidyl(REF:020996,500 mL)。I 液和II 液采用一步法稀释。先配制基础液,消毒过滤后再添加20%的卵黄、6%甘油,配制成精液冷冻稀释液。
1.3.2 实验动物 实验羊选取新疆吐鲁番地区托克逊县徽商生态牧业有限责任公司的性欲旺盛且繁殖性能高、体型外貌良好、睾丸大小适中,并经受过人工假阴道采精调教的10 只2~3 岁的纯种吐鲁番黑羊公羊。
1.3.3 精液采集 用假阴道法采集精液,每只公羊每隔1d 采精2 次,采集后20min 内到实验室进行质量评价。选择精液密度为2.5×109个/mL 以上,活率0.75 以上的方可用于试验。将检测合格后至少3 头公羊的精液混合均匀,以消除个体差异,放入灭菌试管中备用。
1.3.4 精液处理 精液常规检查后,在25℃室温环境下用3 种不同稀释液进行6 倍等温稀释。随即将每组平均分成5 份,分别装在15 mL 灭菌离心管中,在3 种冷冻稀释液中分别添加0、5、15、25、35 μg/mL 5 种不同浓度的PC,共15 管。将精液与冷冻稀释液混合均匀后快速用口吸法分装到0.25 mL 细管中、封口粉封口,8 层纱布包裹并放入4℃冰箱进行平衡,3 h 内缓慢降温至4℃。
1.3.5 精液冷冻及解冻 将平衡后的冷冻细管置于冻精码架上,使低温温度计探针与码架相连并保持同一高度,向泡沫盒中倒入液氮,低温温度计显示温度在-80~-120℃,冻精码架与液氮面距离为3.5 cm,在液氮蒸气中熏蒸8 min 后,将冷冻细管投入液氮中,按照组别装到指型管中进行保存。解冻时,将冷冻细管投入37℃水浴孵育30 s。
1.3.6 精子活率及运动速率检测 精子活率及运动参数利用计算机辅助精子分析系统(CASA)进行检测,将红宝石计数板置于精子分析仪37℃恒温载物台上预热,取10 μL 精液滴在计数板中,每个样品观察5 个视野,自动测定精子活率和曲线运动速率(VCL)、直线运动速率(VSL)、线性度(LIN)、平均路径速度(VAP)、头部侧移幅度(ALH)及振动指数(WOB)等运动参数。
1.3.7 精子畸形率检测 采用姬姆萨染色法评价精子畸形率。取10 μL 解冻后精液滴于载玻片一端,均匀抹片,自然风干,中性福尔马林固定液固定15 min 后清水冲去固定液,自然风干。将抹片反扣装有吉姆萨染色的染色槽上,使抹片接触染液,1.5 h 后清水冲去染液,自然风干待检。每个样品制作2 个抹片,每个抹片观察200 个以上精子,并取2 个抹片的平均值。精子畸形一般分为头部异常、颈部异常、尾部异常和顶体异常4 类。
精子畸形率=(畸形精子数/精子总数)×100%
1.3.8 精子质膜完整率检测 采用Hypo-osmotic swelling test(HOST)方法检测精子质膜的完整性。精子尾部发生弯曲形成圆环则为精子质膜完整的精子,而质膜受损的精子则不会形成圆环。将精液样品解冻后600×g、4℃离心3 min,弃上清,PBS 重复清洗4 次,取10 μL 精子加入100 μL HOST 液(0.9 g 果糖和0.49 g 柠檬酸钠溶于100 mL 去离子水)中,37℃混合孵育30 min,取10 μL 滴片,200×相差显微镜下观察统计发生弯尾的精子数,共统计400 个精子。
精子质膜完整性=弯尾的精子数/400×100%。
1.3.9 精子顶体完整率 采用花生凝集素荧光标记(PNA-FITC)检测精子顶体完整性,具体操作参照GMS14015.1.1 说明;400×荧光显微镜下拍照观察并计数约200 个精子,观测到顶体发出绿色荧光的即为顶体完整的精子。
1.3.10 精子抗氧化指标检测 CAT、T-AOC、GSH-Px含量严格按照试剂盒说明测定,随即用酶标仪进行检测。
1.4 统计分析 数据采用WPS 2019 进行整理,用SPSS 23.0 软件对试验所得数据进行单因素方差分析数据显著性分析,结果用平均值± 标准误来表示,P<0.05 为差异显著,P<0.01 为差异极显著,P>0.05 表示差异不显著。
2 结果与分析
2.1 不同释液中添加PC 对吐鲁番黑羊精液冷冻前后活率、畸形率和运动参数的影响 由表1 可知,各组在冷冻前的活率和畸形率差异不显著。冷冻后,I 液15 μg/mL PC 组精子活率最高73.307%,显著高于III 液15 μg/mL组,极显著高于其他13 组。冷冻后,I 液15 μg/mL 组畸形率最低(9.845%),与III 液15 μg/mL 组、III 液25μg/mL 组和I 液5 μg/mL 组、I 液25 μg/mL 组无显著差异,极显著高于其他各组。由表2 可知,冷冻后I 液15 μg/mL组的VCL、VSL、LIN、VAP、ALH、WOB等指标均极显著高于其他组。综合冷冻前后活率、畸形率和运动参数等指标,I 液5 μg/mL 组、I 液15 μg/mL 组、II 液15 μg/mL 组、III 液15 μg/mL 组、III 液25 μg/mL组精液冷冻效果较好,可作进一步检测以确定最佳冷冻配方。

表1 不同稀释液添加PC 对精液冷冻前后活率和畸形率的影响
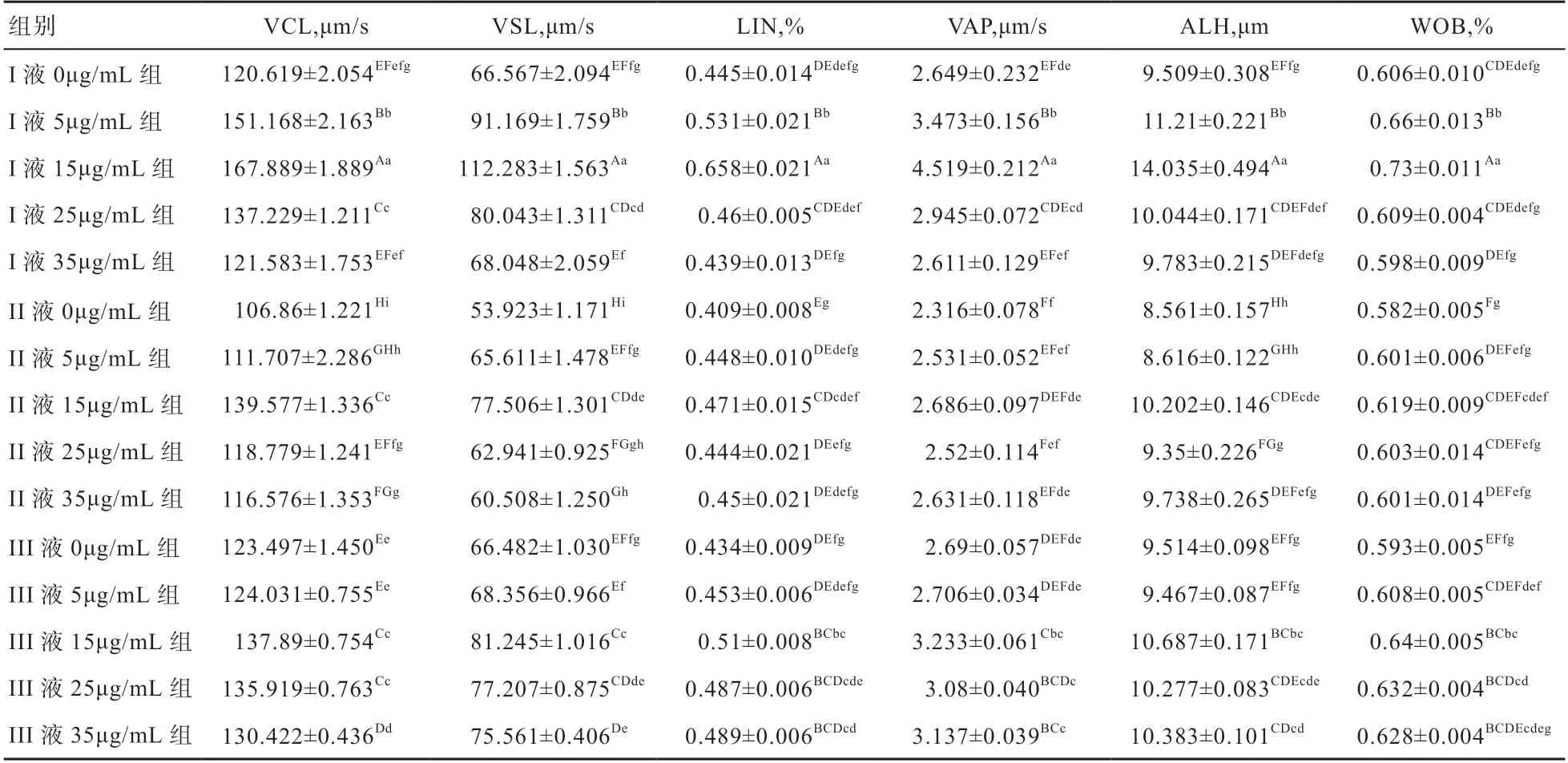
表2 不同稀释液添加PC 对精液冷冻后运动参数的影响
2.2 不同释液添加PC 对精液冷冻后质膜完整性的影响由图1 可知,I 液15 μg/mL 组的质膜完整率极显著高于I 液5 μg/mL 组,显著高于II 液15 μg/mL 组、III 液25 μg/mL 组,与III 液15 μg/mL 组无显著差异。
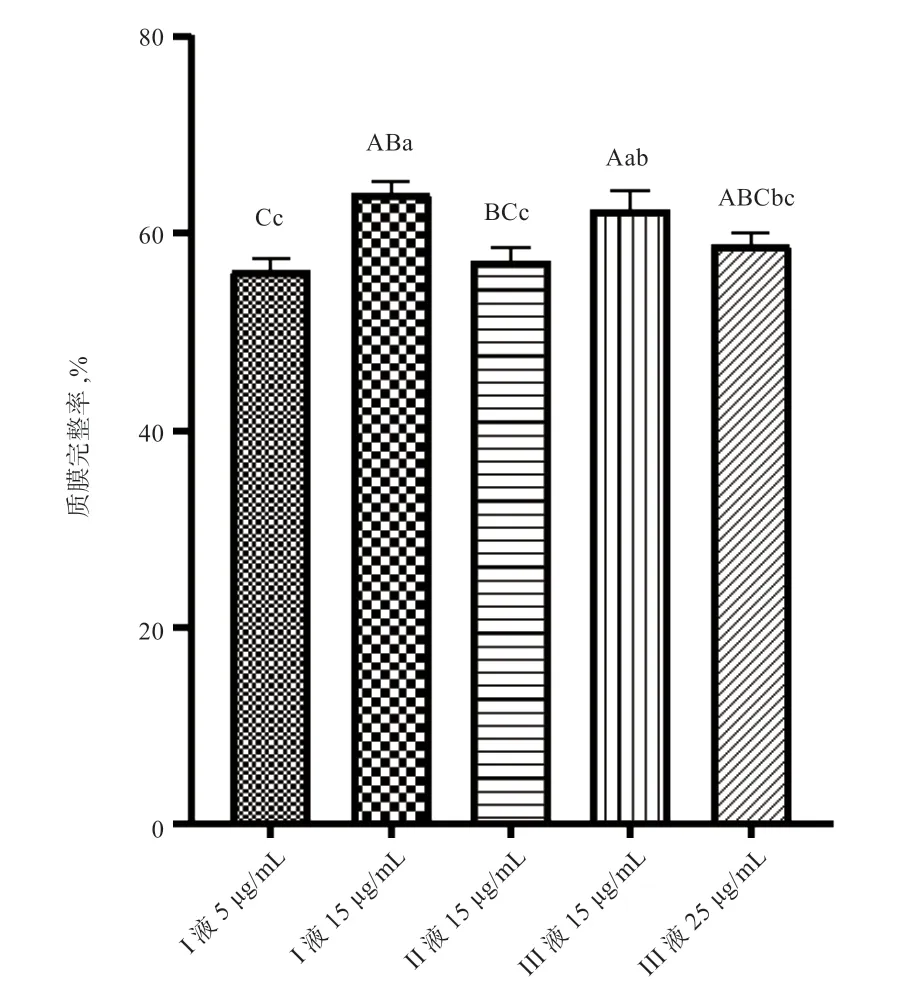
图1 PC 冻融后精子质膜完整率
2.3 不同释液添加PC 对精液冷冻后顶体完整性的影响由图2 可知,I 液15 μg/mL 组顶体完整率显著高于II液15 μg/mL 组,与其他组无显著差异。
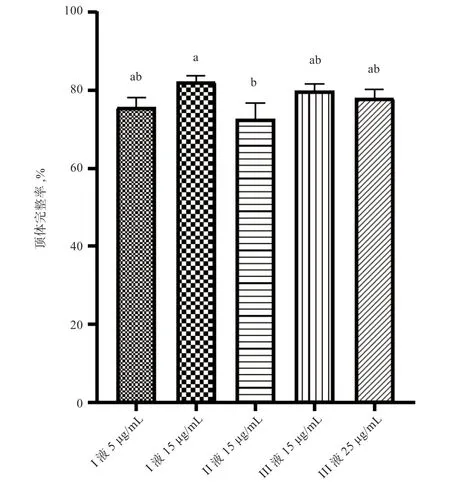
图2 PC 冻融后精子顶体完整率
2.4 不同释液添加PC 对精液冷冻后CAT、GSH-Px、T-AOC 活性的影响 由表3 可知,I 液15 μg/mL 组CAT酶活性显著高于II 液15 μg/mL 组,与其他3 组无显著差异。I 液15 μg/mL 组GSH-Px 活性高于III 液15 μg/mL组、III 液25 μg/mL 组、II 液15 μg/mL 组(P<0.01)和I液5 μg/mL 组(P<0.05)。I 液15 μg/mL 组T-AOC 含量最高,极显著显著高于I 液5 μg/mL 组、II 液15 μg/mL组和III 液15 μg/mL 组(P<0.01),与III 液25 μg/mL组无显著差异。

表3 不同释液添加PC 对精液冷冻后CAT、GSH-Px、T-AOC 活性的影响
3 讨 论
精液在冷冻-解冻过程中处于离体状态,与外界空气接触使精液中氧含量升高而产生过量的ROS,并发生脂质过氧化反应而破坏精子膜的结构与功能完整性,导致精子抗氧化能力、运动性能、活力下降,从而影响精子的受精能力[7]。因此,在精液冷冻稀释液中添加一定浓度的抗氧化剂能及时清除细胞内部的ROS,提高精子冷冻-解冻过程中的抗氧化能力,有效保护精子免受脂质过氧化损伤[8]。PC 是一种天然的抗氧化剂,具有较强的抗氧化活性,可以有效清除超氧阴离子自由基(O2-)和羟基自由基(-OH),可以参与花生四烯酸和磷酸的代谢以及蛋白质的磷酸化,使脂质避免过氧化损伤[9]。
本研究结果表明,在稀释液中添加PC 可提高冻融后的吐鲁番黑羊精液质量和抗氧化能力。线粒体是细胞的主要能量供应场所。线粒体通过氧化磷酸化和ATP的合成作用在维持正常的精子功能和能量稳态方面发挥重要作用[10]。精液冷冻后会破坏精子的线粒体功能并刺激精子产生过量的ROS,过量ROS 导致精子的抗氧化防御系统失灵,致使精子进入氧化应激状态[11]。ROS 还通过其脂质过氧化物MDA 直接氧化精子DNA碱基或与DNA 的共价键,从而导致细胞凋亡的发生[12]。然而,本实验结果表明,与空白对照组相比,在精液稀释液中添加不同浓度的PC 均能显著提高冻融后精子的运动速率、活率、质膜完整性、顶体完整性,且在I 液中添加15 μg/mL PC 时效果最好,当添加量到达35 μg/mL 时精子的活率和畸形率开始降低,与空白对照组之间无显著差异。这一结果与Wen[13]等在山羊精液低温保存中添加葡萄籽原花青素所得结果类似,但山羊精液低温保存中所需添加浓度略高,添加最佳浓度为30 µg/mL,当超过50 µg/mL 精液品质开始降低。吕松洁等[14]研究发现,当PC 添加量为10 μg/mL 时能显著提高湖羊冻融精子的质膜完整率和顶体完整率。另有研究表明,猪精液冷冻稀释液中添加30 µg/mL 和40 µg/mL 的葡萄籽原花青素可提高冻融后精子顶体完整率、线粒体活性和质膜完整率[15]。本研究中,在冻精稀释液中PC 的添加量为15 μg/mL 时能极显著提高精子质膜完整率,显著提高顶体完整率,但当添加量到达35 μg/mL 时顶体完整率和质膜完整率开始降低,说明当添加PC 浓度超过一定范围时,反而会破环精液品质。这可能是由于PC在精子脂膜中的作用与胆固醇的作用相似,通过脂膜的调节作用使细胞膜的稳定性增强,维持细胞膜的结构和功能的完整性,从而起到改善冻融精液品质的作用[16]。
精液冷冻保存过程中会产生过量的ROS,ROS 促进脂质过氧化,CAT 和GSH-Px 是精浆中内源性抗氧化剂,在氧化防御系统中起到清除自由基和维持细胞内氧化还原的作用[17-18]。本研究发现,在I 液中添加15 μg/mL PC 可显著提高CAT、GSH-Px 活性,在III液中添加25 ug/mL PC 时T-AOC 含量最高,说明PC在绵羊精液冷冻保存中具有较强的抗氧化作用,这与孙艳青[15]和胡亚美[19]在猪精液冷冻保存和常温保存中使用PC 的研究结果相一致。Long 等[17]研究表明PC 有效地防止了玉米赤霉烯酮(ZEN)诱导的氧化应激,改善了SOD 和GSH-Px 活性,降低了睾丸中MDA 含量。Li[20]等在公猪精液稀释液中添加PC,精液在保存过程中减少了ROS 的产生,从而改善精子线粒体活性,提高了T-AOC 水平和公猪精子活力。综上,PC 可以增强抗氧化酶的活性,降低氧化损伤,这应该是与PC 含有对抗ROS 和氧化应激作用的活性化合物有关,但PC对绵羊精液冷冻保存起保护作用的机制远远比抗氧化性复杂,具体的机理还尚未确切,需通过科学试验来进一步的研究。
4 结 论
本研究结果表明,在吐鲁番黑羊精液冷冻过程中添加PC 能显著提高冷冻-解冻后的精液质量与抗氧化能力,以I 液添加15 μg/mL PC 组效果最佳。
