围产期奶山羊血液生化、抗氧化及乳成分、产奶量的变化规律研究
2022-11-17何志成王琬婷
何志成,王琬婷,陈 冲,罗 军,李 聪
(西北农林科技大学动物科技学院,陕西省遗传育种与繁殖重点实验室,陕西杨凌 712100)
围产期一般指家畜产前2~3 周至产后2~3 周。奶山羊、奶牛等处于围产期的奶畜,由于代谢、胎儿增重、泌乳的能量需要大于自身摄入将会导致能量负平衡(Negative Energy Balance,NEB)。围产期机体消耗大量营养物质及机体储备用于代谢,导致机体出现低血糖、低血钙、低血磷的现象[1]。除此之外,NEB 导致奶畜机体在内分泌激素的作用下增加脂肪的动员和分解,并通过糖异生产生能量和释放游离脂肪酸(NEFA)[2]。大量NEFA 在肝脏中积累会损害机体代谢功能和免疫应答,且NEFA 不能及时被三羧酸循环转化而生成酮[3],并累积最终导致酮症。在高强度的代谢活动中,大量葡萄糖进入线粒体氧化分解供能,同时产生了自由基。当生成与清除自由基的动态平衡被打破,机体就会进入氧化应激状态[4]。氧化应激会对细胞器和生物大分子造成损伤,引起细胞凋亡、淋巴细胞的增殖和嗜中性粒细胞的功能下降,机体免疫力受到抑制,对外界病原体侵入的抵抗力下降[5-8]。
因此,本试验选择预产期前3 周的萨能奶山羊,测定其分娩前后(相对分娩时间)的血液生化指标、血液抗氧化指标及分娩后产奶量及乳成分指标,探究奶山羊围产期血液生化和泌乳的相关指标变化规律,揭示围产期奶山羊的应激情况,以期为生产上奶山羊围产期的精细化管理、预防各种产后代谢性疾病发生提供理论基础。
1 材料与方法
1.1 试验时间与地点 试验于2020 年12 月至2021 年1 月在陕西省西北农林科技大学西农萨能奶山羊原种场进行。
1.2 试验动物及饲养管理 选取体况、体重相近、低胎次(1~3 胎)、处于预产期前21 d 的健康西农萨能奶山羊17 只。所有奶山羊饲养于同一圈舍内,试验期间奶山羊自由饮水,每天饲喂3 次(7:00、14:00、21:00)相同全价混合日粮,日粮按照NRC(2007)奶山羊营养标准设计,可满足奶山羊的营养需要,日粮的组成和营养成分见表1。试验期持续6 周。

表1 基础饲粮组成及营养成分(风干基础)
1.3 样品的采集与处理 分别在产前21、14、7 d 和产后1、7、14、21 d 使用真空干燥管于晨饲前在羊颈静脉采血5 mL,将采集的全血带回实验室37℃水浴30 min 后用5 000 r/min 离心5 min,吸取2 mL 血清于离心管,标注羊号和采样日期,密封并冻存于-80℃冰柜以备后续测定。在产后1、7、14、21 d 记录产奶量,在记录日7:00 和14:00 进行手工挤奶,2 个时间点各采集50 mL 奶样混合均匀,加入1 粒防腐剂(Broad Spectrum Microtabs II,D&F Control System,美国),充分震荡使防腐剂溶解于奶样中,密封并存于4℃冰箱内以备后续测定。
1.4 测定指标及方法
1.4.1 血液生理生化、抗氧化及氧化损伤指标检测 每个血清样品吸取500 μL 送至陕西省咸阳市杨凌示范区医院生化科实验室检测谷草转氨酶(AST,IFCC 速率法)、谷丙转氨酶(ALT,IFCC 速率法)、谷氨酰转肽酶(GGT,IFCC 速率法)、总蛋白(TP,Doumas 法)、白蛋白(ALB,BCG 法)、球蛋白(GLO)、葡萄糖(GLU,葡萄糖氧化酶法)、总胆固醇(TCHO,COD-CE-PAP法)、甘油三酯(TG,GPO-PAP 法)、尿素(UREA,UV-GLDH 法)含量。血清总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)采用试剂盒(南京建成生物工程研究所)检测。
1.4.2 乳成分指标测定与分析 将奶样送至陕西省畜牧技术推广总站,采用乳成分体细胞联机测定仪(Combi 500,Bentley,美国)检测乳脂率、乳蛋白率、体细胞数(SCC)、总固形物率、乳糖率、尿素氮含量,其中SCC多为非正态分布,因此利用公式log2(SCC/100 000)+3转化为体细胞评分(SCS)再进行分析。
1.5 统计分析 所有数据使用Excel 进行初步整理和分析,利用SPSS 26 软件进行统计分析,采用单因素方差分析,采用Duncan's 法对不同时间点血液、产奶及乳成分指标均值进行多重比较,数据结果采用平均值±标准差表示,并以P<0.05 作为差异显著标准。
2 结果
2.1 奶山羊围产期血液生化指标变化情况 由表2 可知,血清中ALT 和TCHO 浓度在整个围产期变化均不显著,ALT 浓度在产后7~21 d 先上升后下降,TCHO浓度在产后1 d 下降至最低。其余血液生化指标在整个围产期内均呈一定的变化规律。分娩后血清中AST、GGT、TP、ALB 和GLO 浓度较分娩前有升高趋势。其中血清AST 浓度在分娩后1 d 至21 d 升高(P<0.05);血清GGT 浓度在分娩后1 d 稍有下降,随后逐渐升高并在分娩后21 d 达到最大值,且高于其他相对分娩时间(P<0.05);血清TP、ALB 和GLO 浓度在分娩后7~21 d 均高于分娩前(P<0.05)。而分娩前血清TG 浓度均高于分娩后(P<0.05);血清中UREA 浓度变化较波动,且产后其浓度有升高趋势;随着相对分娩时间的增加,血清中GLU 浓度在分娩前7~14 d 降低(P<0.05),并在分娩后较分娩前14~21 d 均升高(P<0.05),但仍低于分娩前21 d(P<0.05)。
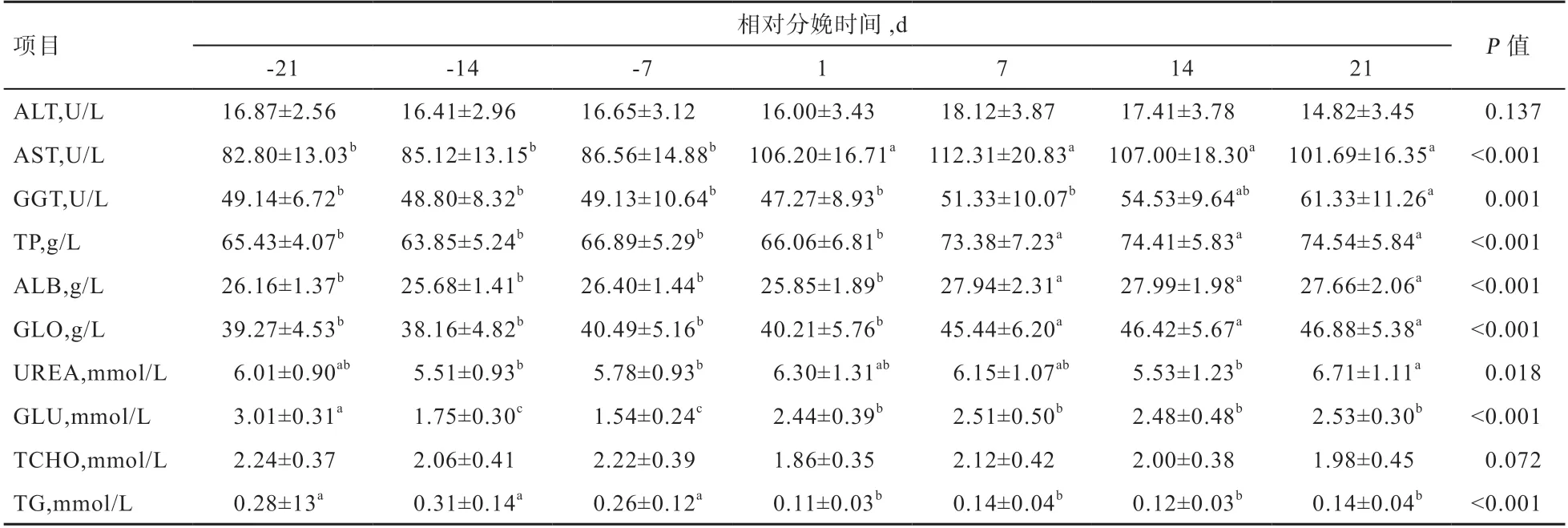
表2 奶山羊不同相对分娩时间血液生化指标的浓度变化
2.2 奶山羊围产期血清中抗氧化指标变化情况 由表3 可知,奶山羊接近分娩血清SOD、T-AOC、MDA浓度有提高趋势,而后逐渐恢复到产前水平;血清中CAT、GSH-Px 浓度在分娩前7 d 高于分娩前14~21 d(P<0.05),且在产后7~21 d 维持较高水平。多重比较结果表明,血清中SOD 和MDA 浓度在分娩前7 d 达到峰值,且MDA 高于分娩前14~21 d(P<0.05),随后在分娩后7 d 内下降(P<0.05),再逐渐恢复到分娩前14~21 d 的水平;而SOD 浓度则在达到峰值后逐渐在分娩后7 d 下降到产前14~21 d 的水平。血清中T-AOC浓度在分娩前7 d 升高(P<0.05),且在分娩后7 d 内逐渐升高并达到最大值,随后恢复到分娩前14~21 d 的水平。
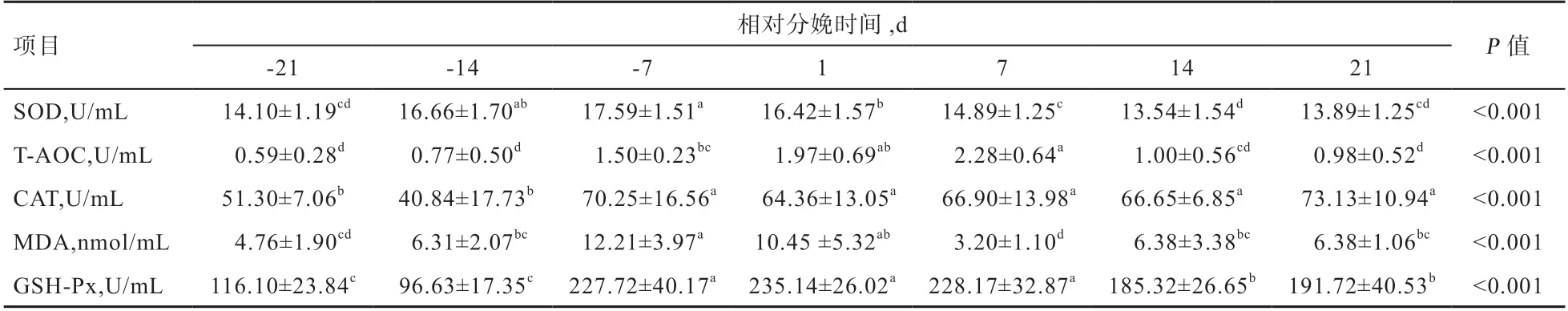
表3 奶山羊不同相对分娩时间血液抗氧化指标的含量变化
2.3 奶山羊产后产奶量及乳成分的变化情况 由表4 可知,随着泌乳天数的增加,奶山羊产奶量、乳中尿素氮含量及SCS 逐渐升高,且均在第21 天达到最大值,其中产奶量和SCS 在21 d 内变化不显著,乳中尿素氮含量在第21 天高于前2 周(P<0.05)。乳蛋白率和乳中总固形物率则在21 d 内逐渐下降,且占比均在第7 天为最大,高于14、21 d(P<0.05)。乳脂率呈先升高再降低(P<0.05),再升高的波动变化。乳糖率在7~21 d高于产后第1 天(P<0.05)。

表4 奶山羊产后不同泌乳周产奶量及乳成分变化
3 讨 论
3.1 围产期奶山羊血清生化指标的变化规律
3.1.1 肝功能指标 围产期多项代谢和合成活动均在肝脏中进行,因此肝功能指标在一定程度上可反映机体营养状况及应激水平。AST、ALT、GGT 是临床上评价肝脏功能的指标,能一定程度上反映肝脏的受损伤情况[9]。当肝脏或线粒体受损时,存在于细胞质及线粒体内的AST、ALT 渗透至血液,导致血液中AST、ALT 浓度升高[10],且在肝脏轻度炎症时,ALT 升高程度高于AST[11],而GGT 由肝脏合成,其活性随氧化应激的增加而增加[12]。在围产期的相关研究中[1,13],奶牛产后7 d 内肝功能指标均有升高趋势,且部分指标在随后仍稳定在高水平。本试验结果表明,ALT、AST 和GGT 主要在产后发生变化,且在产后7 d 内均有升高趋势,其中AST 和GGT 在产后维持在较高水平,ALT 在产后第21 天下降到产前21 d 的水平。这表明奶山羊在产后由于NEB 导致的代谢紊乱对肝脏损伤加大,且在数周内难以恢复至产前水平。
3.1.2 其他血液生化指标 ALB 是血浆中主要的蛋白质,有维持血浆渗透压的作用,也是一些生物分子的载体。GLO 则与免疫相关,在泌乳初期奶畜血液免疫GLO 通过内吞进入初乳中,是幼畜早期提高免疫力的途径。本试验结果表明,TP、ALB、GLO 的变化趋势一致,在产后7~21 d 显著高于产前和分娩后1 d 的水平。但郭仕辉等[1]、王国瑾等[14]研究发现,产后TP、GLB 较产前低,且处于缓慢恢复的状态。Madan 等[15]、Piccione 等[16]研究发现,TP、GLO 在分娩当天显著降低,并在产后2 周左右呈上升趋势,ALB 则在分娩当天显著上升,随后呈下降趋势并在产后30 d 内维持在低水平。王连江等[17]研究也表明,奶牛产后免疫应答下降。而本试验中奶山羊产后7 d 血清TP 的升高可能预示机体进行了蛋白质动员,以此满足乳腺及机体的需要[18],且肝脏作为蛋白质主要的代谢场所,受到氧化应激的影响,导致蛋白质的代谢受阻[19],这可能是TP、GLO、ALB 上升的原因。郭仕辉等[1]研究表明,产前2 周内GLU 浓度呈下降趋势,并在产后逐渐恢复,且在分娩当天奶牛低血糖症发病率最高。迟景波[20]研究也表明,产前低血糖症的发病率高于产后。肖劲邦[21]研究得出,产后脂肪的分解产物β-羟丁酸和游离脂肪酸较产前明显上升。本试验结果也表明,奶山羊产前7~14 d 大量消耗GLU 为机体代谢供能,且浓度下降至健康羊GLU 浓度参考范围以下(2.77~4.44 mmol/L),而血液TCHO、TG 含量并未在此阶段有明显变化,在分娩后1 d,血液TG、TCHO 含量明显下降且TG 在随后持续处于低水平,这表明奶山羊产前主要依靠血糖供能,产后脂肪则迅速分解补充血糖浓度为机体供能,同时奶山羊妊娠后期开始处于NEB 状态。UREA 在肝脏中合成,是蛋白质分解的终产物之一。郭仕辉等[1]研究表明,UREA 在产前产后波动较大,但在分娩当天血中含量最高。本试验中,血液UREA 含量在产后7 d 内较高,可能与产后NEB 导致的蛋白质代谢增强有关,而在产后第21 天血液中UREA 含量显著升高可能与肾脏、胃肠道UREA 的排出率有关[22-23]。Sadjadian 等[24]、郭仕辉等[1]研究表明,TCHO 在产前2 周内有下降趋势,产后逐渐上升并恢复到产前2 周的水平。上述结果与本试验在分娩当天变化趋势一致,但本试验血液TCHO含量在试验期内变化差异不显著,仅在分娩后第1 天明显下降,这可能由于奶山羊产后开启泌乳机体利用脂质为产奶提供能量和机体类固醇合成增加所导致。
3.2 围产期奶山羊血清抗氧化及氧化损伤指标的变化规律
3.2.1 氧化损伤指标 MDA 是脂质发生过氧化反应的终产物,具有生物毒性,是衡量机体受到氧化损伤程度的标志物之一[25]。张红飞等[26]、李宗辉[27]、余思佳等[28]研究表明,血清MDA 在分娩时达到峰值;而本试验血清MDA 在分娩前7 d 至产后1 d 呈较高水平,表明在分娩后奶山羊脂肪快速动员和分解,机体受到的氧化应激明显增加;而在产后第7 天MDA 含量显著下降,可能与当阶段T-AOC 水平的上升和机体NEB 状态的缓解有关。
3.2.2 抗氧化指标 围产期机体消耗的氧气显著增加,导致产生活性氧(ROS)显著增加,ROS 继而诱导脂质过氧化损伤细胞[29],且不饱和脂肪酸一级氧化产物脂肪酸氢过氧化物具有损伤细胞器和引起多种动脉疾病[30]。GSH-Px、SOD、CAT 等抗氧化物酶组成机体抗氧化系统[31]。T-AOC 反映机体总抗氧化应激的水平,其中CAT 和SOD 催化ROS 的歧化反应使之减少,GSH-Px能还原脂肪酸氢过氧化物[32]。张红飞等[26]研究发现,围产期奶牛血清GSH-Px 活性在产前25~5 d 逐渐降低,在分娩当天缓慢升高,随后缓慢下降;血清SOD 活性在产前15 d 升至最高,之后至产后40 d 呈下降趋势;CAT 在产前、产后10~30 d 呈上升趋势,在分娩当天下降至最低值。李宗辉[27]研究表明,SOD 含量在分娩前1 d 显著降低,之后在产后10 d 逐渐上升至产前水平。而本试验结果表明,奶山羊血清抗氧化指标在临近分娩及产后短期内未见有下降趋势。奶畜产后受NEB 状态的影响,脂肪大量分解供能,产生过量ROS,超出机体清除能力导致氧化应激,往往表现在临近分娩时抗氧化指标降低。但本研究中机体酶抗氧化系统及T-AOC 表现出相反变化,表明奶山羊在分娩前后的抗氧化应激能力提高,机体抗氧化能力对于增加的应激仍在未失控范围内,持续高水平的GSH-Px、CAT 和下降的氧化损伤指标同样表明机体对脂肪氧化产物的强清除能力。这也可能与低胎次(0~3 胎)奶山羊抗氧化能力较强相关[28]。
3.3 围产期奶山羊产奶量及乳成分指标的变化规律
3.3.1 产奶量 耿亚楠等[33]通过模型成功拟合产奶量指标,表明奶山羊在泌乳初期(产后0~3 周)产奶量逐渐上升。在本研究中,奶山羊产奶量在21 d 内呈上升趋势,且在第21 天达到最高值2.49 kg。从变化趋势上可以看出,奶山羊第21 天产奶量可能仍未达到产奶高峰。营养物质通过输液或者饮食的方式进入奶畜机体,影响血液生化指标浓度和流经乳腺的血流量,最终影响产奶量[34]。Wang 等[35]研究表明,在GLU 供应量不足时,乳腺的血流量和摄取GLU 量降低。随着试验期泌乳周的增加,奶山羊采食量增加,通过饮食摄入的营养物质增加,NEB 状态得到改善,导致乳腺血流量增加,最终使产奶量增加,这可能是奶山羊在泌乳前期产奶量呈现逐渐升高趋势的原因。
3.3.2 乳成分 合成乳成分的前体大部分来自血液生化指标,因此奶山羊围产期NEB 导致血液生化指标的变化同样对乳成分产生影响。本试验结果表明,奶山羊乳糖率、SCS 和乳中尿素氮含量随泌乳周的增加呈上升的趋势。谢芳等[36]研究也表明,随着产后NEB 消耗大量GLU 的情况得到改善,乳腺摄取GLU 增加,乳糖率缓慢上升。研究表明,乳中SCC 与胎次、环境温湿度指数有关[37-38]。而在本研究中SCS 虽然有上升趋势,但多重比较结果表明在产后3 周内SCS 变化差异不显著,这可能是由于生产管理条件的差异导致。血液中尿素氮通过扩散进入乳中[22]。Kessler 等[39]研究表明,奶牛血液尿素氮与乳中尿素氮含量存在正相关性。而本研究中血液UREA 含量与乳中尿素氮含量在产后7~21 d 呈现相同的变化趋势,且奶山羊乳中尿素氮含量除产后第1 天均明显高于牛奶中尿素氮均值范围(10~16 mg/dL)[40]。这表明随着泌乳周的增加,血液中尿素氮向乳中的扩散增加。产后采食量逐渐恢复和脂肪动员导致的血糖上升,加大了流经乳腺的血流量,从而使尿素氮的扩散增加[41],这可能是产后7~21 d 乳中尿素氮高含量的原因。
本试验中乳蛋白及总固形物分别在产后21、14 d 内有下降趋势,与相关研究结果一致[36,42]。关于乳蛋白的研究表明,奶牛产后7 d 内乳中与免疫和物质转运的相关蛋白表达量及丰度随时间的增加而下降,而血流量的变化影响乳腺吸收流经血液中的氨基酸,最终影响蛋白质合成,导致乳蛋白含量的变化[43-45]。这可能是乳蛋白产后呈下降趋势且乳蛋白率在产后随泌乳量的增加而逐渐趋于平缓的原因。乳中总固形物即乳中干物质,是衡量乳中营养物质含量的的指标。本试验中,产后总固形物含量在7 d 及14 d 呈连续显著下降的变化,这可能与产后初乳与常乳乳成分的差异相关,而产后14~21 d 总固形物含量趋于稳定可能与奶山羊采食量逐渐恢复,NEB 状态缓解有关,并最终导致从血液进入乳中的营养物质增加。
谢芳等[36]研究表明,水牛产后乳脂率变化较不规律。而本研究中乳脂率呈先上升再下降,最后上升的不规律变化。付宇阳等[42]研究表明,乳脂率在产后第1周内变化显著,随后呈缓慢下降趋势。乳中TG 在羊奶乳脂中占比约为95%[46-47],主要在乳腺中合成,原料由GLU 代谢提供。而本试验产后血清GLU 含量在小范围内波动,且乳脂率与血清GLU 含量随泌乳周的增加同步变化,可能是乳脂在产后21 d 内呈不规律变化的原因。
4 结 论
本研究结果表明,奶山羊围产期血液生化、抗氧化、乳成分及产奶量指标变化大,产前产后血液生化及抗氧化指标除ALT、TCHO 及产后除产奶量及乳中SCS 外,其余指标均变化显著,揭示奶山羊围产期生产性能指标的变化规律可在一定程度上反映机体的氧化应激和代谢状态。
