青海毛驴肠道微生物优势菌群分析
2022-11-17曹雁行艾德强董建宝张国梁黄娇娇官却扎西索佳佳孙玉江刘书琴
郭 荣,曹雁行,艾德强,董建宝,张国梁,黄娇娇,官却扎西,索佳佳,孙玉江,6*,刘书琴*
(1.青岛农业大学动物科技学院,山东青岛 266109;2.东营市现代畜牧业发展服务中心,山东东营 257091;3.青海省海北州刚察县青海省种羊繁育推广服务中心,青海海北藏族自治州 812200;4.山东畜牧兽医职业学院,山东潍坊 261061;5.青海省畜牧总站,青海西宁 810008;6.东营职业学院,山东东营 257091)
马属动物是食草性非反刍动物,具有高度分隔的胃肠道(Gastrointestinal Tract,GIT),可利用多种植物纤维[1-2]。驴作为马属动物,其与反刍动物最大的区别是属于后肠发酵,具有发育良好的后肠结构,驴后肠的潜在长度和体积超过4.5 m 和110 L,约为其前肠体积的15.95 倍[3]。
动物肠道中的微生物生态系统相对比较复杂,它们对宿主的生长代谢、营养消化与吸收、免疫力以及抵抗病菌入侵的能力等有着重要影响[4-5]。区域[6]及环境[7]是影响肠道微生物的主要因素。赵金香等[8]研究了干旱沙漠地带新疆驴盲肠中的细菌多样性,发现乳球菌科和松毛虫科在消化粗饲料过程中起关键作用。已有研究成果证实地理环境条件对鬣蜥、蝠属动物和欧洲荧火虫等肠道微生物的生物多样性有着非常重要的塑造效果[9-11]。
我国多样化的生态类型造就了品种高达30 多个丰富的驴种资源,青海毛驴主要分布在青海省海东、海南、海北以及黄南等地的农区和半农半牧区,属于高原大陆性气候[12]。不同地区往往有着不同环境条件,而宿主与共生菌如何适应不同地区环境且体内不同部位微生物差异一直是研究的热点之一[13]。现阶段随着对肠道微生物研究的日益重视,而对于驴肠道微生物的研究还为之甚少。本文利用高通量16S rRNA 测序的方法,与山东德州驴相比较,分析不同地区(青海和山东)和不同部位(胃、小肠、盲肠和直肠)对青海毛驴肠道菌群的组成和结构差异,对改善青海毛驴胃肠道微生态环境、预防与控制疾病的发生有重要的理论指导。
1 材料和方法
1.1 样本采集 各选取来自青海省(青海毛驴,海拔>3 000 m,试验组)和山东省(德州驴,海拔<30 m,对照组)的6 个个体(3 公3 母),采样对象均为成年健康驴(5~10 岁)。青海毛驴为舍饲,以麦草、青稞和豆秸等饲料为主,每日饲喂2~3 kg;德州驴为舍饲,以花生秧、玉米秸和麦糠麦秸等饲料为主,每日饲喂5~6 kg。
驴屠宰后,正确分离胃、小肠和大肠,具体部位确定如下:胃-贲门部至幽门部;十二指肠-胃结合部后10 cm;空肠-十二指肠结合部后10 cm;回肠-回盲口向前10 cm 处;盲肠-呈“逗号”状,为一盲端;直肠-靠近肛门端。用绳子扎紧各段间狭小接口,水平放置,从各肠道段中部取样,取等量的十二指肠、空肠和回肠内容物,混合后定义为小肠内容物。对包含内容物的胃、小肠(十二指肠、空肠和回肠)和大肠(盲肠、结肠和直肠)的重量进行称重记录,之后立即无菌采集胃、小肠、盲肠和直肠4 个部分的新鲜内容物样品,无菌收集于2 mL 无菌康宁冷冻管中(Corning Incorporated,New York,USA),做好标记后立即放于液氮中进行速冻,然后放于-80℃低温冰箱保存;收集完毕后排出内容物,对不含内容物的胃、小肠和大肠的重量再次进行称重记录,并测量记录小肠和大肠的长度。收集的样本送往Majorbio 生物公司进行16S rRNA 基因组分析。其中青海毛驴的小肠和大肠长度及其比例,胃、小肠和大肠内容物重量(内容物重量=含内容物重量-不含内容物重量)及比例如表1 所示。
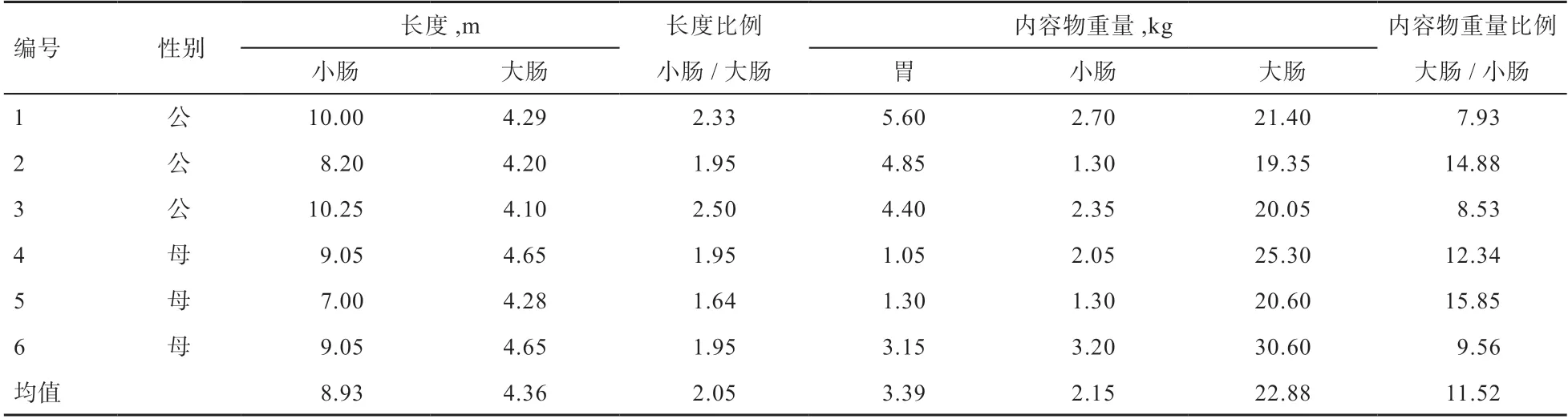
表1 青海毛驴胃肠道长度及其内容物重量统计
1.2 16S rRNA 基因测序
1.2.1 总DNA 提取和PCR 扩增 使用 TransGen AP221-02 DNA 试剂盒从肠道内容物样品中提取微生物群落基因组总DNA。使用1%琼脂糖凝胶来检测 DNA 提取物,并使用NanoDrop 2000 紫外可见分光光度计(Thermo Scientific,Wilmington,USA)测定DNA浓度和纯度。通过ABI GeneAmP® 9700 PCR 热循环仪(ABI,CA,USA)对细菌16S rRNA 基因的高变区V3-V4 进行扩增用,用的引物对为338F(5'-ACTCCTACGGGA GGCAGCAG-3')和806R(5'-GGACTACHVGGGTW TCTAAT-3')。16S rRNA 基因的PCR 扩增流程为:95℃3 min;95℃30 s,55℃30 s,72℃45 s,共27 个循环;72 ℃10 min,4 ℃终止。PCR 混合物包含5 ×TransStart FastPfu 缓冲液4 μL、2.5 mmol/L dNTPs 2 μL、正反向引物(5 μmol/L)各0.8 μL、TransStart FastPfu DNA 聚合酶0.4 μL、模板DNA 10 ng,最后ddH2O 补充至20 μL。PCR 反应一式三份进行。PCR 产物从2%琼脂糖凝胶中提取,并使用AxyPreP DNA 凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA)根据使用说明进行纯化,并使用QuantusTM荧光计(Promega,USA)进行定量。
1.2.2 Illumina MiSeq 测序 根据美吉生物公司(中国上海)的标准方案,在Illumina MiSeq PE300 平台(Illumina,San Diego,USA)上以等摩尔和双端方式汇集纯化的扩增子。
1.2.3 统计分析 原始16S rRNA 基因测序读数被解复用,由FASTQ 版本0.20.0[14]对其质量进行过滤,用FLASH 版本1.2.7[15]对其合并,标准如下:在任何位点的300 bp 读数在50 bp 滑动窗口上被截断,从而获得<20 的平均质量分数,并且小于50 bp 的截断读数被弃去,包含歧义字符的读数同样被舍弃;只有超过10 bp的重叠序列才会根据它们的重叠序列进行组装。重叠区域的最大失配率为0.2。弃去无法组装的读数;区分样品的方法是根据条形码和引物,调整序列方向,条形码精确匹配。
使用 UPARSE 7.1 版[16]对具有97%相似性截止值的操作分类单元(OTU)[16-17]进行聚类,并识别并删除嵌合序列。每个OTU 代表序列的分类通过RDP 分类器版本2.2[18]针对16S rRNA 数据库(Silva v138)使用0.7的置信阈值进行分析。
2 结果
2.1 稀释曲线分析 图1 显示,在8 个分组中,Shannon指数曲线上升后均逐步趋于平缓,说明测序数据达到饱和,能够覆盖肠道微生物组群落的绝大部分物种,结果可用于后续数据分析。

图1 Shannon 指数曲线
2.2α多样性分析 在OTU 水平,青海毛驴的胃、小肠、盲肠和直肠的微生物物种丰富度和多样性均高于德州驴。其中,小肠的丰富度和多样性最低,盲肠和直肠的丰富度和多样性均高于胃和小肠。
Shannon 指数表明(图2-A),青海毛驴胃的物种多样性低于其盲肠和直肠(P≤0.05),青海毛驴胃的物种多样性高于德州驴小肠(P≤0.01);青海毛驴小肠的物种多样性低于其盲肠和直肠(P≤0.01),而青海毛驴小肠的物种多样性低于德州驴盲肠和直肠的物种多样性(P≤0.05);青海毛驴盲肠和直肠的物种多样性高于德州驴各组(P≤0.05);德州驴小肠的物种多样性显著低于其盲肠和直肠(P≤0.01)。
Ace 指数表明(图2-B),青海毛驴胃的物种丰富度低于其直肠(P≤0.05);青海毛驴盲肠的物种丰富度显著低于青海毛驴直肠,青海毛驴盲肠的物种丰富度高于德州驴胃(P≤0.05)和小肠(P≤0.01)的物种丰富度;青海毛驴直肠的物种丰富度高于德州驴胃和盲肠(P≤0.01)以及小肠(P≤0.001)的物种丰富度;德州驴胃的物种丰富度低于其直肠(P≤0.05);德州驴小肠的物种丰富度低于其盲肠(P≤0.05)和其直肠(P≤0.01);德州驴盲肠的物种丰富度低于其直肠的物种丰富度(P≤0.05)。
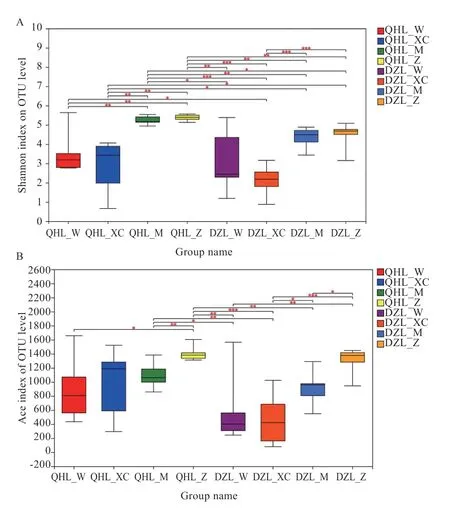
图2 α 多样性分析
2.3 基于门和属水平的微生物群落结构组成 在门水平上,共鉴定到20 个门水平菌,其中共有门18 个(90%),青海毛驴小肠有2 个独有菌门为P__Caldisericota(50%)和氢化戊烯菌(P__Hydrogenedentes,50%)(图3-A)。
青海毛驴前肠的优势菌门为变形菌门(Proteobacte ria,36.01%)和厚壁菌门(Fimicutes,32.68%),青海毛驴后肠的优势菌门为厚壁菌门(Fimicutes,56.89%)和拟杆菌门(Bacteroidota,29.19%)。德州驴前肠的优势菌门为厚壁菌门(Fimicutes,89.20%)和拟杆菌门(Bacteroidota,6.37%),德州驴后肠的优势菌门为厚壁菌门(Fimicutes,54.87%)、拟杆菌门(Bacteroidota,36.28%)和螺旋菌门(Spirochaetota,5.12%)(图3-C)。
在属水平上,共鉴定到276 个属水平菌,其中共有属125 个(45.29%),青海毛驴胃独有77 个菌门,占比前两个的为黄杆菌属和噬菌体属(Flavobacterium24.19%,Algoriphagus9.72%);青海毛驴小肠独有19个菌门,占比前2 个的为普罗威登斯菌属和原衣原体属(Providencia65.97%,_Candidatus_Protochlamydia4.17%);青海毛驴盲肠独有2 个菌门,占比前两个的属为琥珀弧菌属和副杆菌属(Succinivibrionacia_UCG-00250%,Paracaedibacteracia50%);青海毛驴直肠独有5 个菌属,占比前两个的为DMER64 和脱硫孢属(DMER6434.78%,DesulfurisPora30.43%);德州驴胃独有37 个菌属,占比前两个的为巨型单胞菌属和杆菌属(Megamonas19.52%,Coriobacteriacia8.5%);德州驴小肠独有9 个菌属,占比前两个的为脱甲基菌属和乳酸菌属(Demequinacia29.99%,Lacticigenium16.67%);德州驴盲肠独有1 个菌属为g__norank_f__NS11-12_marine_group;德州驴直肠独有1 个菌属为奥秘杆菌属(Arcanobacterium)(图3-B)。
青海毛驴前肠的优势菌属为链球菌属(Streptococc us,14.12%)、放线菌属(Actinobacteria,16.62%)和乳酸杆菌属(Lactobacillus,6.31%),青海毛驴后肠的优势菌属为理研菌属(Rikenellacia,10.11%)密螺旋体(Treponema,6.60%)和乳酸杆菌属(Lactobac illus,5.64%);德州驴前肠的优势菌属为乳酸杆菌属(Lactobacillus,61.13%)和链球菌属(Streptococcus,14.22%),德州驴后肠的优势菌属为链球菌属(Strepto coccus,15.77%)和理研菌属(Rikenellacia,8.73%)(图3-D)。

图3 肠道微生物群落结构组成
2.4 Beta 多样性分析
2.4.1 样本层级聚类分析 试验样品的菌群组成关系和结构利用相似度树状图描述。首先使用描述群落组成关系和结构的Weighted-unifrac 算法计算在OTU 水平各个样本间的距离,即根据 beta 多样性距离矩阵进行层次聚类分析,得到相似度树状图,结果如图4 所示,青海毛驴胃和小肠的菌群组成结构相似,成簇聚类到同一树杈分支点上;德州驴胃和小肠菌群具有不同的聚落结构,成簇聚类到另一树杈分支点上。青海毛驴直肠和德州驴直肠的菌群分别聚类在树杈分支点上,青海毛驴盲肠和德州驴盲肠的菌群分别聚类在树杈分支点上,从而形成鲜明的菌群结构派别。
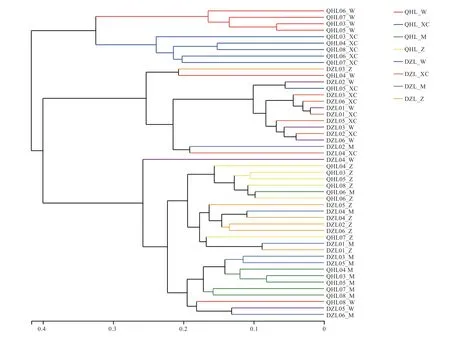
图4 样本层级聚类分析
2.4.2 PCoA 分析 利用主坐标(Principal co-ordinates analysis,PCoA)比较微生物的组成,结果表明,青海毛驴和德州驴的地区差异显著,且来自相同/相邻区域(胃和小肠,盲肠和直肠)的微生物群落比来自其他区域的微生物群落更相似(图5)。
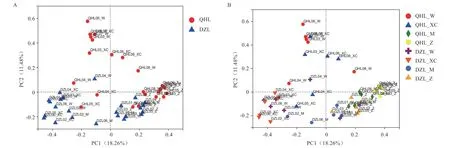
图5 PCoA 分析
2.4.3 组间差异显著性检验 在门水平上,厚壁菌门(Fimicutes)的丰度在德州驴中高于青海毛驴(P=0.002),在德州驴小肠中的丰度最高,在德州驴胃中的丰度高于青海毛驴小肠(P=0.037),在德州驴胃中的丰度高于青海毛驴直肠(P=0.04),在德州驴胃中的丰度高于青海毛驴胃(P=0.0019)。拟杆菌门(Bacteroidota)在青海毛驴和德州驴中,盲肠和直肠的丰度均高于胃和小肠(P=0.0002)。变形菌门(Proteobacteria)在青海毛驴的丰度高于德州驴(P=0.003),且在青海毛驴胃和小肠的丰度高于盲肠和直肠。蓝细菌(Cyanobacteria)只出现在青海毛驴中(P=0.0001),且只存在胃中。螺旋菌门(Spirochaetota)在青海毛驴和德州驴的盲肠和直肠的丰度高于胃和小肠(P=0.0006),在德州驴中,在盲肠中的丰度高于直肠,且在青海毛驴小肠的丰度高于德州驴小肠(P=0.048),在青海毛驴盲肠的丰度高于德州驴直肠(P=0.04)。放线菌门(Actinobacteria)在青海毛驴的丰度高于德州驴(P=0.001),且在青海毛驴中胃和小肠的丰度高于盲肠和直肠;在青海毛驴盲肠的丰度高于德州驴盲肠(P=0.0007)。乳头菌门(Patescibacteria)在青海毛驴的丰度高于德州驴(P=0.008)(图6)。
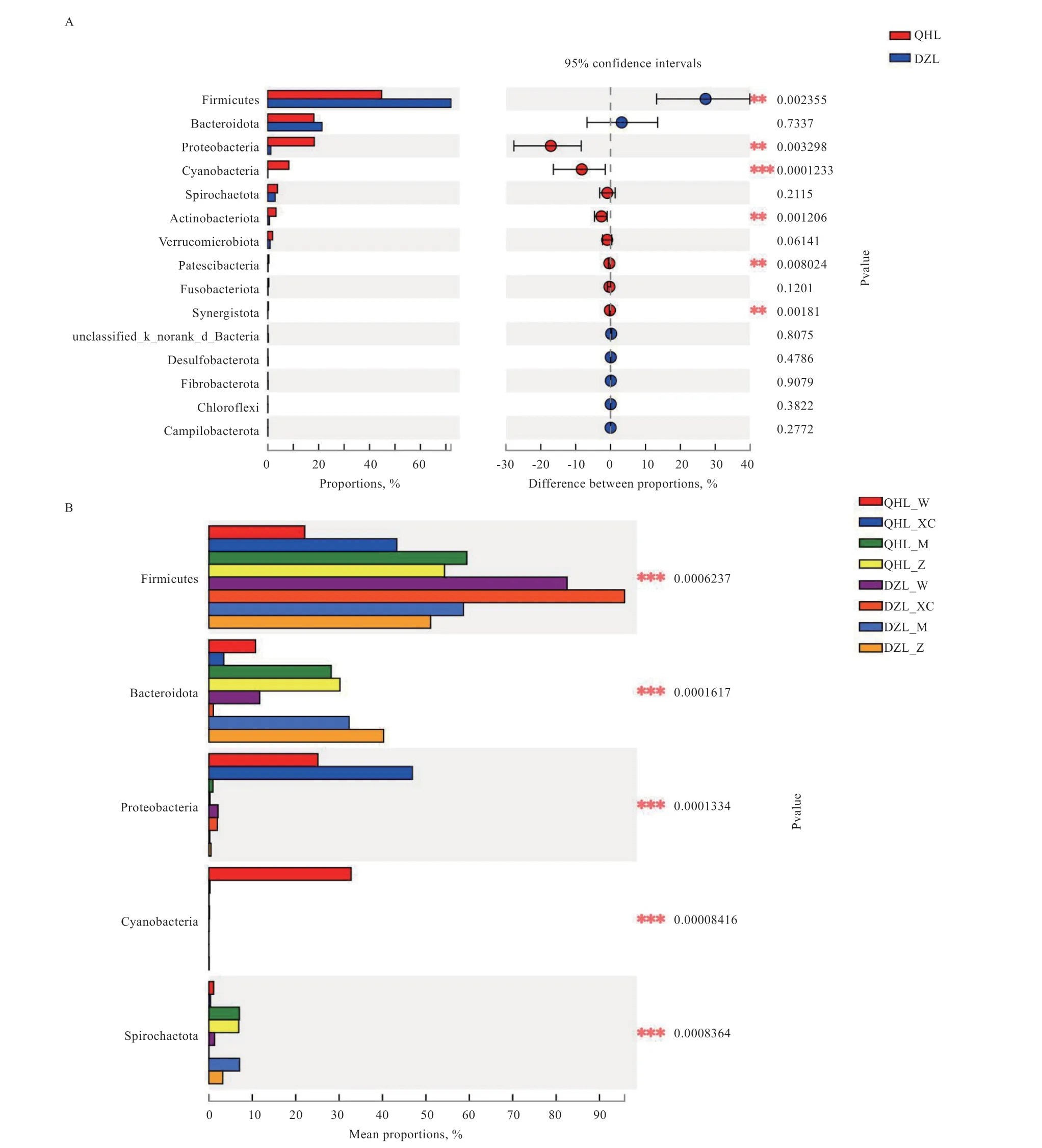
图6 在门水平进行组间差异显著性检验
在属水平上,乳酸菌属(Lactobacillus)在德州驴中的丰度高于青海毛驴(P=0.000006),且德州驴的平均相对丰度在胃和小肠中高于盲肠和直肠且高于青海毛驴的胃和小肠,青海毛驴的盲肠和直肠的乳酸菌丰度较低。链球菌属(Streptococcus)在德州驴的丰度高于青海毛驴(P=0.014),且在德州驴盲肠的丰度显著高于青海毛驴直肠(P=0.03),在青海毛驴胃的丰度显著高于青海毛驴直肠(P=0.04)。理研菌属(Rikenellacia)在盲肠和直肠的丰度高于胃和小肠,在青海毛驴直肠中的丰度高于青海毛驴盲肠(P=0.04)。放线菌属(Actinobacteria)在青海毛驴胃和小肠的丰度较高,在德州驴的丰度较低。叶绿体(Chloroplast)只存在于青海毛驴的胃中(P=0.001)。密螺旋体属(Treponema)在两组中盲肠和直肠的丰度高于胃和小肠,在德州驴小肠的丰度较低。毛螺菌属(Lachnospiracia)在青海毛驴的丰度高于德州驴,在盲肠和直肠中的丰度高于胃和小肠,在青海毛驴的盲肠丰度较高,在青海毛驴盲肠中的丰度高于青海毛驴直肠(P=0.0017)。产气荚膜杆菌(Clostridium)在德州驴的丰度高于青海毛驴(P=0.006)(图7)。
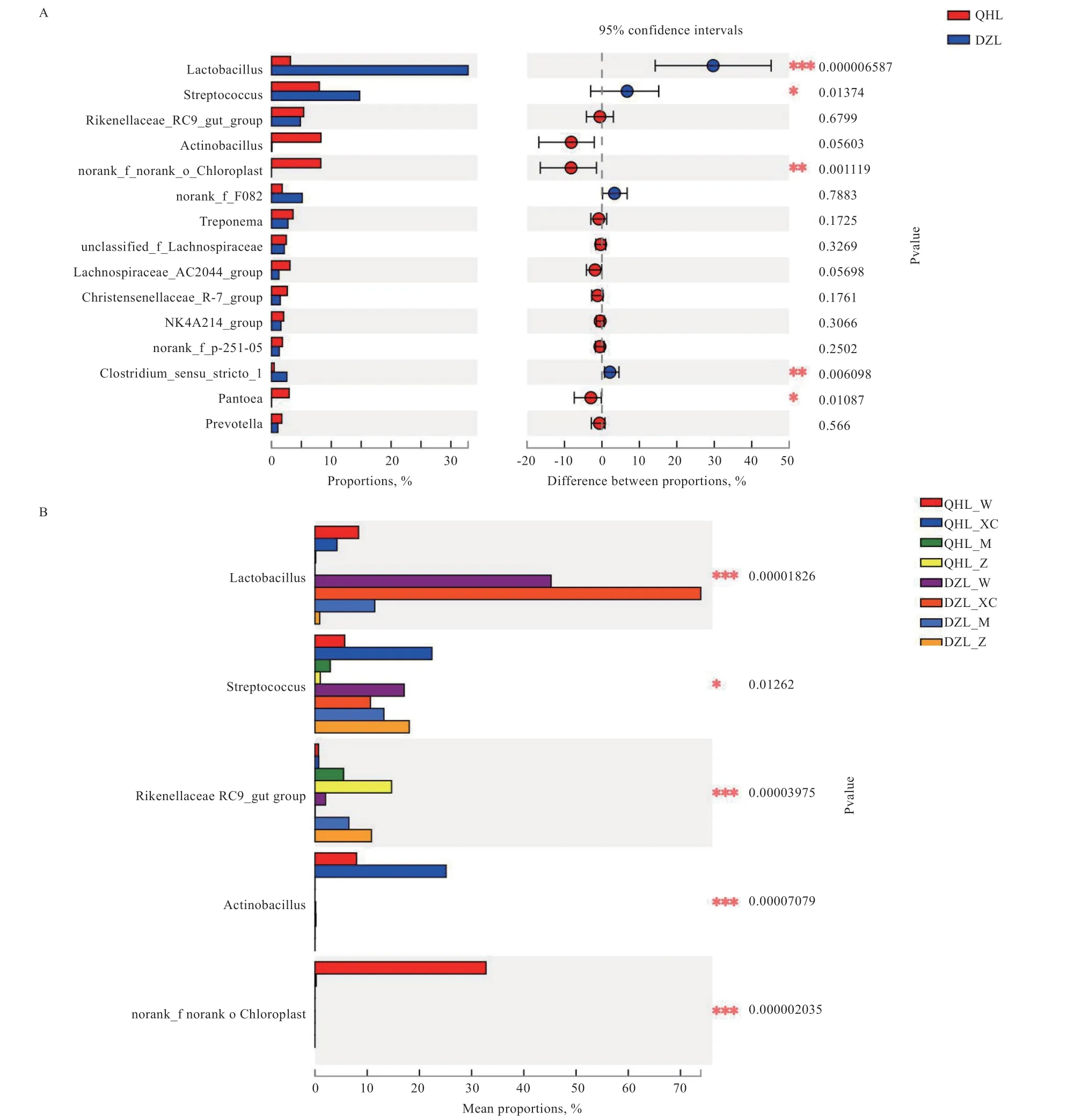
图7 在属水平进行组间差异显著性检验
2.4.4 LEfSe 多级物种差异判别分析 通过LEfSe 分析进行组别间差异比较,找到与丰度有显著性差异的类群,如图8 所示,对样本划分产生显著差异影响的群落或物种含量前三的细菌在青海毛驴胃中是蓝细菌(Cyanobacteria)、叶绿体(Chloroplast)和放线杆菌门(Actinobacteria);青海毛驴小肠中是变形菌门(Proteobacteria)、γ-变形菌纲(Gammaproteobacteria)、巴氏杆菌科(Pasteurellaceae);青海毛驴盲肠中是梭状芽孢杆菌纲(Clostridia)、乳螺目(Lachnospirales)、振螺目(Oscillospirales);青海毛驴直肠是理研菌科(Rikenellaceae)、毛螺菌科_AC2044(Lachnospiraceae_AC2044)、疣菌群属(Verrucomicrobiota)。

图8 LEfSe 多级物种层级树图
德州驴胃中是伯克氏菌目(Burkholderiales)、伯克氏菌科(Burkholderiaceae)、粪杆菌属(Faecalibacte rium);德州驴小肠是乳杆菌目(Lactobacillales)、杆菌(Bacilli)、厚壁菌门(Firmicutes);德州驴盲肠是普雷沃菌科(Prevotellaceae)、螺旋体属(Spiroch aetota)、密螺旋体属(Treponema);德州驴直肠是拟杆菌目(Bacteroidales)、拟杆菌属(Bacteroidia)、拟杆菌属(Bacteroidota)。
2.4.5 功能预测分析 通过PICRUSt 对OTU 丰度表进行标准化,然后对OTU 进行COG 功能注释,获得OTU 在COG 功能水平的注释信息及各功能在不同样本中的丰度信息。图9 显示,除去COG 的功能中比重最高的功能未知基因(Function unknown)和一般功能预测基因(General Function Prediction only)这两大类别,其中碳水化合物转运与代谢基因(Carbohydrate Transport and Metabolism)除了青海毛驴胃外,在青海毛驴的小肠、盲肠和直肠以及德州驴4 个部位均呈现高丰度分布状态;氨基酸转运与代谢基因(Amino Acid Transport and Metabolism)除了德州驴小肠外,在青海毛驴的4 个部位以及德州驴的胃、盲肠和直肠均呈现高丰度分布状态其余样品中均呈现高丰度分布状态,说明肠道中碳源物质代表碳水化合物和氮源物质代表氨基酸两种物质代谢旺盛。

图9 COG 功能分类统计图
3 讨 论
3.1 在门水平的微生物群落结构组成 微生物群落结构组成在门水平上的结果显示,青海毛驴前肠的优势菌门为厚壁菌门和变形菌门,青海毛驴后肠的优势菌门为厚壁菌门和拟杆菌门。厚壁菌门的物种丰度在德州驴中高于青海毛驴,在青海毛驴中的丰度后肠高于前肠,而在德州驴中的丰度前肠高于后肠。刘桂琴等[19]基于16S rRNA 测序对德州公驴的研究表明,驴前肠优势菌门顺序为厚壁菌门、变形菌门、拟杆菌门和放线菌门;后肠为厚壁菌门、拟杆菌门、螺旋体门和变形菌门。刘宇等[20]发现驴盲肠菌群优势顺序为厚壁菌门、拟杆菌门、疣微菌门和螺旋体门。有报道称厚壁菌门在草食动物中主要是利用碳水化合物[21],有提高动物免疫力和增强肠道功能的作用。
在马属动物中,前肠主要负责食物的消化和吸收,后肠与微生物发酵有关[22]。虽然在马的胃和小肠中已证实有轻微的发酵,但大肠仍是饲料发酵的最重要部分[23-24]。已知拟杆菌拥有丰富的编码碳水化合物活性酶的基因,能够根据可用性在肠道中不同类型的能量源之间轻松切换[25]。拟杆菌在大肠的消化相关微生物群中显著富集,并且不受粘膜相关微生物群中肠道位置的影响。李志鹏等[26]在梅花鹿瘤胃中菌群的研究发现,其中87.9%的16S rRNA 基因序列都属于拟杆菌门降解纤维的菌种序列。因此,拟杆菌在大肠中富集可能有助于宿主适应复杂的内部环境和大肠中纤维性碳水化合物的降解。之前已有研究证明,厚壁菌门和拟杆菌门是山羊[27]、牛[28]和马[29]等食草动物中最具优势的2 个门。同样,Chen 等[30]研究发现,肉牛瘤胃中厚壁菌门和拟杆菌门的含量随饲粮干草含量的增加而增加,特别是厚壁菌门。以上研究成果和本试验结果均说明,厚壁菌门和拟杆菌门可能与动物个体饮食特征和消化大量纤维性碳水化合物有关。瘤胃疣微菌属于典型的纤维降解菌,与纤维降解密切相关,可产生纤维酶降解纤维二糖等纤维类物质[31]。Patra 等[32]和Zhao 等[33]均证明瘤胃菌科微生物的数量与纤维素消化利用存在密切关系。由此可以看出,驴后肠具有极强的纤维素分解微生物基础,可以很好地解释其耐粗饲的原因。
3.2 在属水平的微生物群落结构组成 在属的水平上观察细菌组成时,青海毛驴前肠的优势菌属为链球菌属、放线菌属和乳酸杆菌属,青海毛驴后肠的优势菌属为理研菌属、密螺旋体和乳酸杆菌属。在青海毛驴中,乳酸杆菌在胃内和小肠内的平均相对丰度高于盲内和直内,表明乳酸杆菌是青海毛驴前肠的主要属。据报道,乳酸杆菌具有非纤维性碳水化合物降解能力(如戊糖、己糖和淀粉)[34],参与胆汁盐的解偶联[35],并通过产生抗微生物物质(如细菌素和乳酸盐)或与病原菌竞争粘膜粘附位点和营养物来抑制病原菌的增殖[36-37]。刘桂琴等[19]在驴肠道微生物多样性及代谢功能差异分析的研究表明,前肠中乳酸杆菌属为优势菌群,约占50.1%,其次为链球菌属,占21.2%。Liu 等[38]研究表明,在属水平上,乳酸杆菌在前肠中占优势,而链球菌在后肠中占优势。淀粉分解细菌-链球菌总是存在于饲喂高浓度日粮的反刍动物的瘤胃中[39]。与乳酸杆菌属相似,其发酵产物乳酸盐使肠粘膜成为酸性环境,因此,乳酸杆菌和链球菌都被认为是对马属动物有益的益生菌[40-41]。
3.3α多样性分析 在细菌门水平上,变形菌门、放线菌门和疣菌群门在青海毛驴的占比高于德州驴;在属水平上,乳酸菌属在德州驴高于青海毛驴;放线菌属在青海毛驴的胃内和小肠内,德州驴几乎没有;毛螺菌属在青海毛驴中的丰富度高于德州驴,叶绿体只在青海毛驴组出现,且只存在胃内中。叶绿体在青海毛驴的胃里分布的比较多,可能与青海地区海拔高,植被光合作用较强以及饲料因素有关,所以饲料中的含量相对较高。
青海地区比德州地区海拔高,随着海拔高度的增加温度会随之下降,而肠道菌群的物种组成易受环境温度的影响,环境温度降低会导致菌群α多样性降低[42-43]。动物实验中也发现了随着温度的降低,小鼠肠道菌群的α多样性会随之下降。Zietak 等[44]研究发现,长期生活在12℃的小鼠肠道菌群的α多样性明显低于生活在29℃的小鼠。但也有研究发现环境温度对宿主肠道菌群结构的影响也较小,如Li 等[45]研究发现生活在温暖环境(22℃)的小鼠肠道菌群结构与生活在寒冷环境(4℃)的小鼠肠道菌群结构相似。随着海拔高度增加,宿主生活环境中的氧浓度不断下降,但低氧并不是影响肠道菌群结构的关键因素[46];如Lucking 等[46]研究发现,长期处于低氧状态下小鼠肠道菌群的群落结构与正常小鼠相似;Khanna 等[47]的研究也证实宿主处于低氧环境时肠道菌群结构未发生改变。梁田等[48]研究也发现生活在不同海拔高度的藏族人群肠道菌群结构相似,无明显差异,因此推测低温和低氧等环境因素可能对藏族人肠道菌群结构的影响较小。在赵俊松等[49]的研究中西藏恒河猴种群的肠道微生物组成多样性和种群特有菌群种类均高于其他5 个地理种群(云南大理、贵州贵阳、四川西昌、广西南宁、海南海口),即西藏种群中肠道微生物菌群的多样性最高,且拥有最多种类的特有菌群;同时,青藏高原地区的低温、低氧和强紫外线的高海拔环境也有可能对恒河猴肠道微生物的组成多样性产生影响[50],帮助恒河猴适应青藏高原地区的高海拔环境[51]。Liu 等[52]通过高通量测序V3-V4 区16s rRNA 基因来分析藏野驴(中国青海省海北州高寒草甸)和非洲野驴(中国青海省玉树州沼泽草甸)的肠道微生物群,结果表明,藏野驴的干物质消化率显著高于非洲野驴,两组之间的α多样性没有显著差异,但β多样性差异显著,藏野驴比非洲野驴拥有相对更复杂的细菌网络,总体结果表明,藏野驴在干物质消化、肠道微生物群落组成和功能方面均优于非洲野驴。本文中青海毛驴地处高原,青海毛驴的菌群多样性和丰富度均高于德州驴,说明青海毛驴有其独特的肠道菌群以适应高原的低温、低氧以及高海拔。但是目前,低温和低氧对于肠道菌群结构的具体作用机制尚不清楚,需要更多的研究与数据支持。
3.4 功能预测 为探索微生物群的潜在功能,本实验使用PICRUSt 来确定不同肠道位置相关微生物群的潜在功能,结果显示,碳水化合物转运与代谢基因(Carbo hydrate Transport and Metabolism)除了在青海毛驴胃外,在其余各组均呈现高丰度分布状态;氨基酸转运与代谢基因(Amino Acid Transport and Metabolism)除了德州驴小肠外,其余样品中均呈现高丰度分布状态,说明肠道中碳源物质代表碳水化合物和氮源物质代表氨基酸两种物质代谢旺盛。这与其他动物的肠道微生物群的功能一致[25-26],也对应于微生物群的基础代谢功能及其生长和增殖所需的营养物质(如碳源和氮源)[53]。
4 结 论
本研究主要基于16S rRNA 基因高通量测序研究了青海毛驴的不同部位肠道微生物的差异。结果表明,青海毛驴的菌群多样性和丰富度均高于山东德州驴,且后肠的菌群多样性和丰富度均高于前肠。这些发现对青海毛驴的肠道微生物群有了更多的了解,为进一步的研究奠定基础。
