火炭母水煎液对金黄色葡萄球菌的抑菌活性
2022-11-17宋姗姗杨艾华周艳萌许译文李成玉王微微
宋姗姗,杨艾华,周艳萌,许译文,贤 浩,李成玉,王微微
(遵义医科大学基础医学院,贵州 遵义 563000)
金黄色葡萄球菌(Staphylococcusaureus,S.aureus)是一种人兽共患病原菌,可导致人和动物的多种疾病(包括腹膜炎、心内膜炎、肺炎等),严重威胁人类和动物的生命安全[1]。当前,抗生素依然是治疗金黄色葡萄球菌感染的主要药物,然而,由于传统的抗菌药物容易引起病原菌产生耐药性以及抗生素研发的缓慢,临床可能面临无药可用的窘境。
天然药用植物因具有安全性高、毒副作用小和不易产生耐药性等优点,越来越受到人们的关注[2-3]。研究表明,药用植物的抗菌机制主要包括改变细菌生物被膜的通透性、抑制参与菌体代谢的酶活性、影响细菌蛋白质和核酸的合成等[4]。药用植物中活性成分除了作用于病原体外,还可通过增强机体自身的免疫力来发挥其抑菌活性[5-6]。由此可见,药用植物的有效药物成分复杂,其抗菌作用可通过多种途径来综合实现,因此,需依据药用植物的有效药物成分的自身特点,采用体外试验和体内试验来全面地评价其抗菌作用和抗菌效果。
传统体内药效评价模型常使用哺乳动物,存在试验周期长、效率低、成本高等问题,无法满足药物研发高通量筛选的需要[7-8]。秀丽隐杆线虫(Caenorhabditiselegans)具有通体透明、易观察、易培养、繁殖快、与人类同源基因多等优点,在新抗菌药物开发领域受到众多学者的关注,为促进新型抗菌药的探索提供了一个更方便的工具[9-13]。本试验应用传统水煎法制备火炭母水煎液,通过琼脂平板法、微量肉汤稀释法和秀丽隐杆线虫-金黄色葡萄球菌感染模型等体内和体外试验,综合地评价火炭母水煎液对金黄色葡萄球菌的抑菌作用,以期为进一步研究和应用火炭母提供参考依据。
1 材料与方法
1.1 主要试剂 制霉菌素、5-氟尿嘧啶脱氧核苷(5-FUDR),均购自北京索莱宝科技有限公司;营养肉汤培养基、营养琼脂培养基,均购自北京奥博星生物技术有限公司;苯酚、硝酸铝、亚硝酸钠、硫酸等有机试剂,均购自阿拉丁试剂(上海)有限公司。
1.2 主要仪器 超净工作台,苏州安泰空气技术有限公司;恒温水浴锅、电热恒温培养箱,上海跃进医疗器械有限公司;高速离心机,上海卢湘仪离心机仪器有限公司;电热鼓风干燥箱,天津市泰斯特仪器有限公司。
1.3 实验菌种和模式生物 大肠杆菌(Escherichiacoli)OP50、金黄色葡萄球菌(编号:CMCC-26003,中国医学细菌保藏管理中心标准菌株)和野生型秀丽隐杆线虫(WT Bristol N2),均由遵义医科大学微生物与免疫学实验室提供。
1.4 火炭母水煎液的制备 准确称取火炭母干燥粉末50.0 g,加10倍体积蒸馏水浸泡30 min,加热煮沸后连续煎煮30 min,4层纱布过滤,收集滤液,药渣再加10倍体积蒸馏水,重复煎煮并过滤。合并滤液,加热浓缩至50 mL,制成生药含量为1.0 g/mL的火炭母药液,4 ℃保存备用。
1.5 主要活性成分的测定 参照赵仕花等[14]的苯酚-硫酸法,以无水葡萄糖为对照品,测定多糖含量;参照Li等[15]的硝酸铝-亚硝酸钠比色法,以芦丁为对照品,测定黄酮含量;参照Ebrahimabadi等[16]的Folin-ciocalteu法,以没食子酸为对照品,测定多酚含量。
1.6 体外抑菌试验
1.6.1 供试菌液的制备 将金黄色葡萄球菌接种于营养琼脂培养基中,37 ℃恒温培养18 h,然后挑取单菌落接种于肉汤培养基中,37 ℃、180 r/min摇床中培养6 h后,用生理盐水将菌液校正至0.5麦氏比浊标准[17]。
1.6.2 抑菌圈的测定 采用牛津杯法,取金黄色葡萄球菌菌液100 μL,均匀涂布于营养琼脂培养基平板上,然后在琼脂平板上间隔放置孔径6 mm的牛津杯,孔间距>20 mm。试验组:不同浓度(1 000、800、600、400 mg/mL和200 mg/mL)火炭母药液100 μL;阳性对照组:10 μg/mL环丙沙星100 μL;阴性对照组:生理盐水100 μL。37 ℃恒温培养18 h后,观察结果,测量并计算抑菌圈平均值[18]。判定标准:当抑菌圈直径≥20 mm时,表示极度敏感;当15 mm≤抑菌圈直径<20 mm时,表示高度敏感;当10 mm≤抑菌圈直径<15 mm时,表示中度敏感;当6 mm≤抑菌圈直径<10 mm时,表示低度敏感或者耐药[19]。
1.6.3 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定 采用微量肉汤稀释法测定火炭母药液对不同菌株的MIC。具体方法:使用营养肉汤将菌液稀释100倍[20],然后吸取100 μL菌液加于96孔培养板的第1~10孔,之后将不同浓度(1 000、500、250、125、62.5、31.25、15.63、7.80、3.91 mg/mL和1.95 mg/mL)的药液100 μL加至第1~10孔;空白对照孔(第11孔):营养肉汤200 μL,检测培养基是否污染;阴性对照孔(第12孔):菌液200 μL,检测菌液是否生长良好,每孔重复3次[21]。接种完成后,将96孔培养板置于37 ℃恒温培养18 h,观察其MIC。将最低抑菌浓度以上的几个浓度细菌接种到营养琼脂培养基上培养过夜,观察,菌落数小于5个的最小稀释度的药物浓度即为MBC[22]。
1.7 体内抑菌试验
1.7.1 线虫的培养及同步化处理 参照Brenner[23]的方法,在显微镜下挑取处于产卵期的单个雌雄同体的线虫转移到涂有E.coliOP50的NGM培养基中,20 ℃培养。选取含较多产卵期线虫的NGM平板,M9缓冲液将线虫冲洗、收集、离心。弃上清液,加入1.5 mL线虫裂解液,剧烈振荡8 min,至虫体全部裂解,迅速离心,弃上清液,用M9吹洗3次,离心,沉淀即可得到虫卵。收集虫卵,20 ℃静置培养24 h,即可得到L1期线虫。将L1期线虫收集至涂布有E.coliOP50的NGM培养基上,20 ℃培养48 h,即可得到同步化的L4期线虫[24]。
1.7.2 秀丽隐杆线虫-金黄色葡萄球菌感染模型的建立 吸取50 μL不同浓度的金黄色葡萄球菌菌悬液,均匀涂布在NGM平板上。感染组1:菌液浓度为1.5×109CFU/mL;感染组2:菌液浓度为1.5×108CFU/mL;感染组3:菌液浓度为1.5×107CFU/mL;感染组4:菌液浓度为1.5×106CFU/mL。室温下干燥20 min后,置于37 ℃培养8 h,取出室温放置。转接20条L4期线虫于感染平板上,并滴加一定浓度的5-FUDR,防止线虫繁殖。对照组:1.5×109CFU/mL 的E.coliOP50。20 ℃培养,每隔24 h观察1次线虫的存活,当其身体僵直且对触碰无反应则判定为死亡。记录线虫的平均生存时间和中位生存时间(LT50)。LT50即生存率在50%时对应的时间,因此,记录10条线虫死亡的时间。
1.7.3 火炭母水煎液对感染线虫的救治 确定细菌感染浓度,L4期线虫感染3 d后,将感染后的线虫用含有1 mmol/L NaN3的M9缓冲液洗涤,离心,弃上清液,重复3次后,收集虫体,取20条感染线虫转移至不同浓度的药物平板上,每组3个重复,并于20 ℃恒温静置培养。试验组1:加入1 000 mg/mL的火炭母药液100 μL;试验组2:加入800 mg/mL的火炭母药液100 μL;试验组3:加入600 mg/mL的火炭母药液100 μL;试验组4:加入400 mg/mL的火炭母药液100 μL;试验组5:加入200 mg/mL的火炭母药液100 μL;阳性对照组:加入10 μg/mL环丙沙星100 μL;对照组:E.coliOP50喂养线虫。每组设置3次平行试验,每隔24 h观察1次线虫的存活。
1.8 统计分析 采用软件SPSS 21.0进行统计学分析,Kaplan-Meier法绘制线虫生存曲线,Graph Pad Prism 7进行Pearson相关性分析,Log Rank检验法进行组间差异比较。P<0.05表明具有显著性差异,P<0.01表明具有极显著性差异。
2 结果
2.1 火炭母水煎液主要活性成分测定 本试验以传统水煎法制备火炭母水煎液,取1 mL 1.0 g/mL水煎液测定多糖、黄酮和多酚含量,结果见表1。

表1 火炭母水煎液中多糖、黄酮和多酚含量
2.2 火炭母水煎液对金黄色葡萄球菌的抑菌活性 本试验采用牛津杯法测定了火炭母水煎液对金黄色葡萄球菌的抑菌活性,结果见表2。当火炭母水煎液浓度≥200 mg/mL时,对金黄色葡萄球菌有抑制效果;浓度在1 000 mg/mL时,对金黄色葡萄球菌的抑菌圈直径为(17.5±0.1)mm,属于高度敏感。
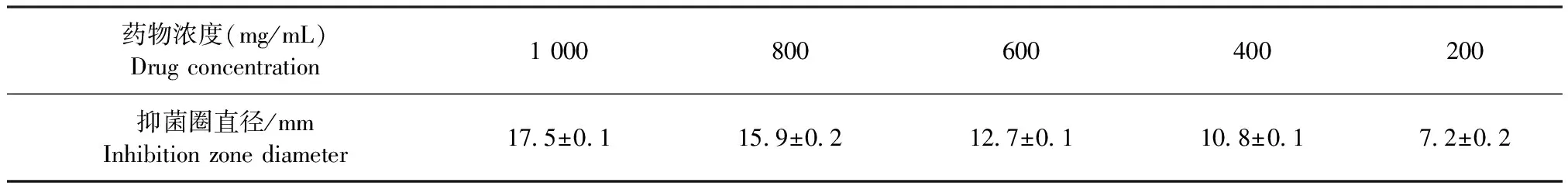
表2 抑菌圈直径大小随火炭母水煎液浓度的变化
2.3 火炭母水煎液MIC和MBC的测定 采用微量肉汤稀释法,观察培养板澄清度确定火炭母水煎液对金黄色葡萄球菌的MIC。结果显示,火炭母水煎液浓度在7.80~1.95 mg/mL时,培养板内液体浑浊,有菌生长;在500~15.63 mg/mL时,培养板内液体澄清透明,无浑浊现象,最终确定火炭母水煎液对金黄色葡萄球菌的MIC为15.63 mg/mL。取该药物浓度范围的培养孔内液体进行涂板,菌落计数,最终确定火炭母水煎液对金黄色葡萄球菌的MBC为31.25 mg/mL。
2.4 秀丽隐杆线虫-金黄色葡萄球菌感染模型的建立 金黄色葡萄球菌浓度可以影响线虫感染的程度,故选择不同浓度的细菌(1.5×109、1.5×108、1.5×107CFU/mL和1.5×106CFU/mL)对线虫进行感染,以确定建立线虫感染模型的最佳金黄色葡萄球菌浓度并构建模型,结果见图1和表3。对照组线虫最长生存时间为20 d,感染组1感染线虫最长生存时间为15 d;随着金黄色葡萄球菌菌液浓度的增加,线虫中位生存时间(LT50)逐渐缩短。采用Log Rank检验显示,感染组3和感染组4与对照组的生存曲线无统计学差异(P>0.05),提示该菌液浓度对线虫无明显致死效果;感染组1和感染组2的生存率均低于对照组,并且生存曲线与对照组均有统计学差异(P<0.05),说明菌液浓度范围在1.5×109~1.5×108CFU/mL时,金黄色葡萄球菌感染可造成线虫显著的致死效果,其中感染组1与对照组的差异极显著(P<0.01),说明该组对线虫的致死作用更强。因此,选用感染组1,即金黄色葡萄球菌菌液浓度为1.5×109CFU/mL用于构建线虫感染模型和感染线虫的救治试验。
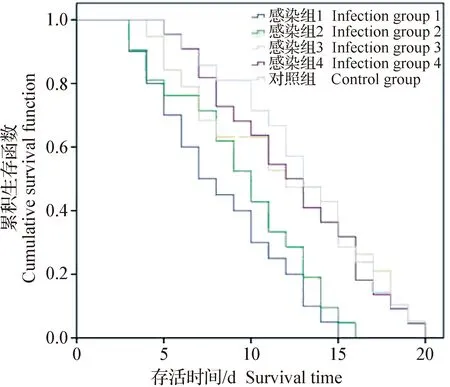
图1 不同浓度金黄色葡萄球菌感染线虫的生存曲线
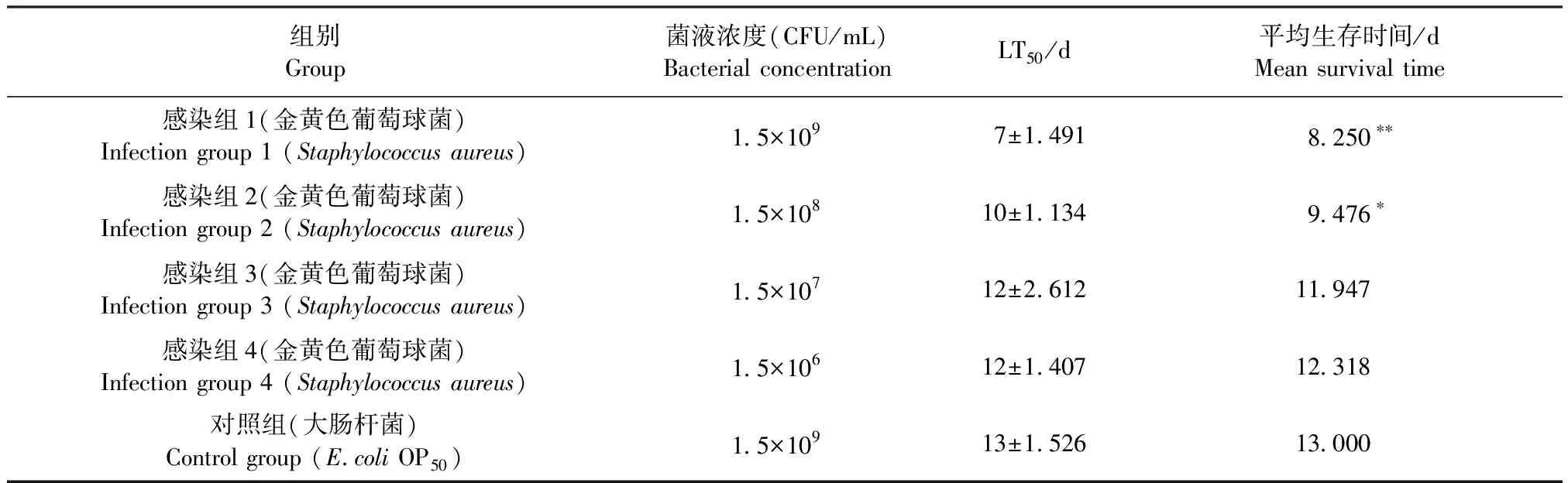
表3 不同浓度金黄色葡萄球菌感染后线虫的生存时间
2.5 火炭母水煎液对感染后线虫的救治 采用浓度分别为1 000、800、600、400 mg/mL和200 mg/mL的火炭母水煎液对金黄色葡萄球菌感染线虫进行救治试验,以线虫是否死亡为结局变量,记录线虫的生存状况,以分析不同浓度药物对感染线虫的救治情况。结果见图2和表4。1.5×109CFU/mL金黄色葡萄球菌感染线虫,试验组1线虫生存时间延长了4 d;与对照组相比,试验组1和试验组2的药液可以明显地提高线虫的存活率,并且生存曲线与对照组有统计学差异(P<0.05);试验组3、试验组4和试验组5的药液几乎无明显救治效果,说明在800~1 000 mg/mL的药物浓度范围内,药液能够有效治疗金黄色葡萄球菌感染的线虫。
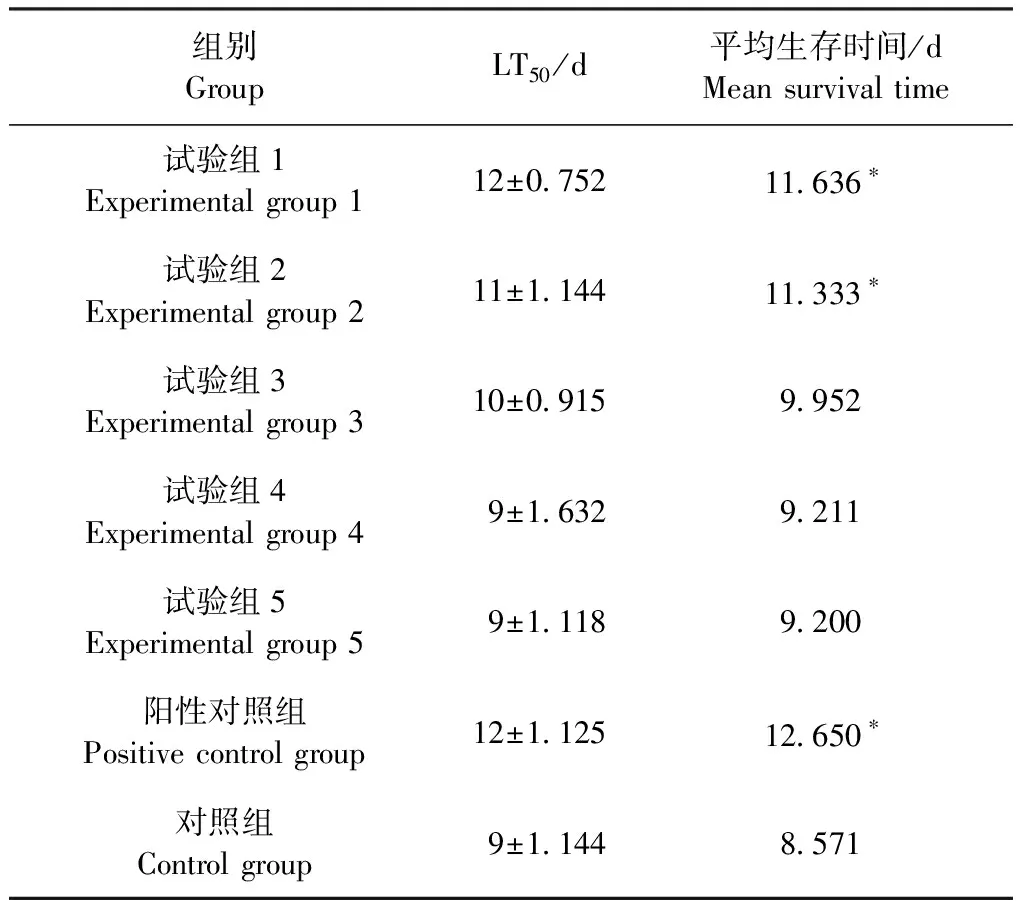
表4 不同浓度火炭母水煎液对感染后线虫生存时间的影响
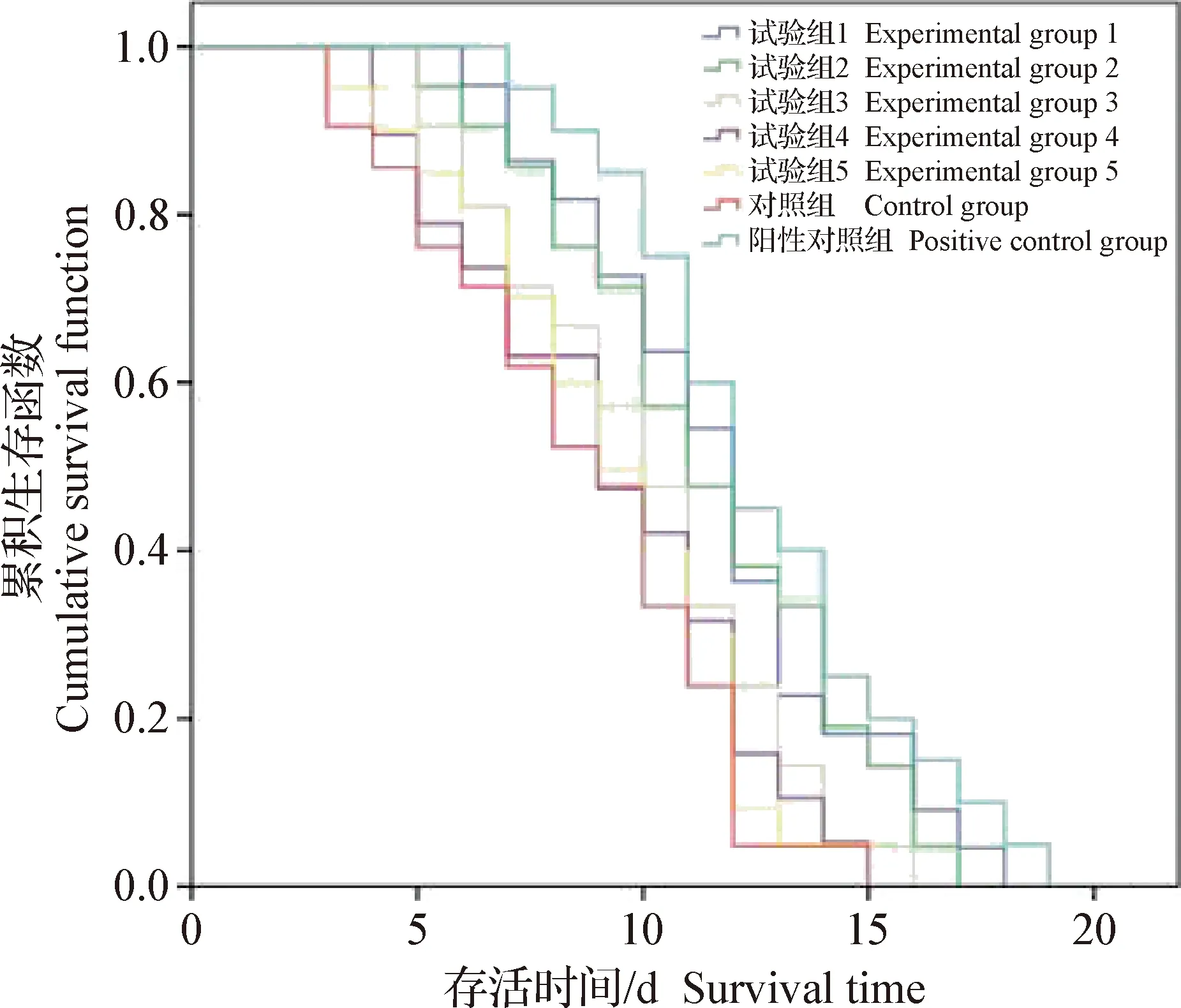
图2 不同浓度的火炭母水煎液治疗感染线虫的生存曲线
2.6 火炭母水煎液成分含量与抑菌活性的相关性 由表5可知,通过Pearson相关性分析,随着火炭母水煎液成分含量的增加,其抑制金黄色葡萄球菌的活性逐渐增强,具有相关性。其中,3种活性成分相比较,火炭母水煎液抑菌活性与黄酮含量的相关性最强,与黄酮具有抗炎、抗病毒、抗肝炎等药理作用相符。但火炭母水煎液的活性功效除受成分含量影响外,还与活性物质成分间的协同作用以及其他因素有关。因此,火炭母水煎液生物学活性不能仅从其活性物质含量的高低进行推测。

表5 火炭母水煎液活性成分与功效的相关性
3 讨论
近年来,随着抗生素广泛和大量的使用,细菌耐药率越来越高,促使人类必须不断开发新的抗菌药物。由于天然药用植物抗感染是利用其多种复杂有效成分调节机体平衡、提高机体免疫力,单纯体外试验无法确定药物效果,需体内外试验综合评价天然药用植物的抗菌作用[25]。因此,本试验采用牛津杯法和微量肉汤稀释法测定火炭母水煎液对金黄色葡萄球菌的体外抑菌作用,确定了火炭母水煎液对金黄色葡萄球菌的MIC为15.63 mg/mL、MBC为31.25 mg/mL,随后建立秀丽隐杆线虫-金黄色葡萄球菌感染模型,体内试验结果显示在800~1 000 mg/mL药物浓度范围内,火炭母水煎液对金黄色葡萄球菌感染的线虫有救治作用。
秀丽隐杆线虫作为一种简单、公认的新型模式生物在医学领域被广泛应用,包括细菌致病机制和抗生素筛选等研究[26]。周雨朦等[9]建立了秀丽隐杆线虫-耐药铜绿假单胞菌感染模型,并将其作为整体生物模型,用于排除毒性高且体内外相关性差的抗生素。本试验通过建立秀丽隐杆线虫-金黄色葡萄球菌感染模型,评价了火炭母水煎液对线虫感染金黄色葡萄球菌后的治疗效果,基于对不同浓度的火炭母水煎液对金黄色葡萄球菌感染后线虫生存时间的观察,结果显示高浓度的火炭母水煎液能够延长感染后线虫的生存时间,但对生存时间的影响为非浓度依赖性,即随着浓度的增加,线虫生存时间并无明显变化。
本试验选取了天然药用植物火炭母,通过体外试验和体内试验确定了其水煎液对金黄色葡萄球菌具有抑菌效果,为金黄色葡萄球菌感染的治疗提供了新思路。本试验结果发现,火炭母的药理功效与其有效成分含量存在相关性,因而,在后续研究中将对火炭母水煎液中的有效成分进行分离纯化,分析各有效成分的抗菌效果,以期为火炭母抗菌成分的研究及应用提供参考依据。
