不同抗性烟草品种(系)苗期接种PVY后生理生化指标变化
2022-11-16董环宇杨超群郭笑维朴世领
董环宇,杨超群,郭笑维,冯 月,朴世领*,高 崇
(1.延边大学 农学院,吉林 延吉 133002;2.云南农业大学 烟草学院,云南 昆明 650201;3.延边州农业科学院,吉林 龙井 133400)
马铃薯Y病毒(Potato virus Y, PVY),是一种典型的烟草病毒,在世界范围内广泛存在,该病毒的存在会缩减烟叶产量,降低烟叶的品质[1]。烟草感染该病毒之后,主要生理表现为烟叶黄化斑驳、茎脉及根系坏死、生长缓慢,甚至出现整片的枯萎,对烟草产量有重大影响[2-3]。感染该病毒后的植株,其烤后烟叶色泽差,烟味差,极大降低产品品质,同时烟叶的总氮、烟碱含量降低,烟草由此丧失经济价值,甚至给种植者带来难以估量的损失[4]。PVY的传播方式主要是通过植株间的汁液摩擦以及蚜虫活动,同时其易与黄瓜花叶病毒(CMV)、烟草花叶病毒(TMV)、马铃薯X病毒(PVX)、烟草蚀纹病毒(TEV)等病毒形成复合性感染[5]。相关研究表明,具有不同抗性的烟草品种在接种PVY后,一些生理指标如抗氧化酶、净光合速率等会发生一定程度的变化[6-9]。张武等[10]在马铃薯苗期接种PVY病毒后发现,其相关抗氧化酶活性增强,丙二醛含量升高,总叶绿素含量减少。孟令远等[11]发现,植物体内各种不同类型的保护酶互相作用,其活性强弱可以反映植物体的生理活动。该研究选用4种具有典型代表意义的烤烟品种作为试材,研究烟草苗期接种PVY病毒前后的生理生化指标变化,旨在为今后烟草生产中马铃薯Y病毒病的早期鉴定提供理论依据。
1 材料与方法
1.1 材料及试验设计
以该课题组前期工作中鉴定出的NC95(感病)、云烟87(中感)、延晒6号(中抗)、SY04-3(高抗)作为供试品种。将选取的4份烟草品种(系)作为试材,苗期进行人工接种PVY试验,试验处理设置为接种PVY处理及未接种PVY处理,共设置8个处理,每个处理3次重复。
1.2 病毒接种及取样方法
PVY由延边朝鲜族自治州农业科学院提供。病毒溶液由病叶研磨后取上清液加蒸馏水稀释制成,并保存在4 ℃冰箱备用。接种时,待烟草长至4~5片真叶时,以棉签蘸取石英砂轻轻划过叶片,再快速向伤口喷适量病毒液以完成病毒接种。
于接种后0、7、14、21、28、35 d测定8个处理的超氧化歧化酶(SOD)、丙二醛(MDA)、叶绿素含量以及光合速率等各项生理生化指标,各处理取长势一致的烟苗6株,3株洗净表面灰尘后烘干测定干物质积累量,另3株采摘后立即用液氮速冻送往实验室,进行相关生理指标测定。将每个处理的5片烟叶混合,3次重复测定。
1.3 测定项目与方法
1.3.1 干物质积累量的测定
采用常压干燥法[12]对烟苗进行去泥洗净操作后测量鲜重,后置入100~105 ℃的电热恒温鼓风干燥箱(DHG-9240A)当中进行烘干,连续烘干到3次恒重,冷却后测定质量得到烟苗干重。
1.3.2 抗氧化酶活性和丙二醛含量的测定
SOD的测定参考邹琦等[13]的氮蓝四唑法进行。CAT活性测定参照蒋传葵等[14]的分光光度法进行。MDA含量测定参照李合生[15]的硫代巴比妥酸法进行测定。
采用美国CID公司生产的CI-340便携式光合测定仪,选晴天上午8~11点,对每个品种选择长势一致的5个烟苗,由上而下第3片真叶进行测定。采用SPAD-205叶绿素仪测定叶绿素含量。
1.4 数据统计及主成分分析
选择SPSS20和Microsoft Excel 2013软件统计分析试验数据及绘图。对4个品种接种与未接种处理各生理生化指标数据进行独立样本T检验。并采用28 d时接种PVY的各品种生理生化指标为综合抗性评价的原始数据,对其进行主成分分析。
2 结果与分析
2.1 4个烟草品种接种后干物质变化规律
各品种接种与未接种处理的干物质积累量列于图1,在接种后7~35 d,对照处理的干物质积累量均呈迅速上升趋势,而接种处理的干物质积累量均呈平稳上升趋势,各品种接种PVY处理的干物质积累量均低于相应对照处理。在接种14 d开始,感病品种(NC95)和中感品种(云烟87)的接种处理分别与对应未接种处理间均存在极显著差异(P<0.01)。进一步分析各品种接种处理的干物质积累增加(减少)幅度可知,接种后21~35 d,4个接种处理的干物质积累量降幅间均存在显著差异,由大到小依次为高抗品种(SY04-3)、中抗品种(延晒6号)、中感品种(云烟87)、感病品种(NC95)(表1)。综上所述,抗性越强的品种,干物质积累的减少幅度越小。
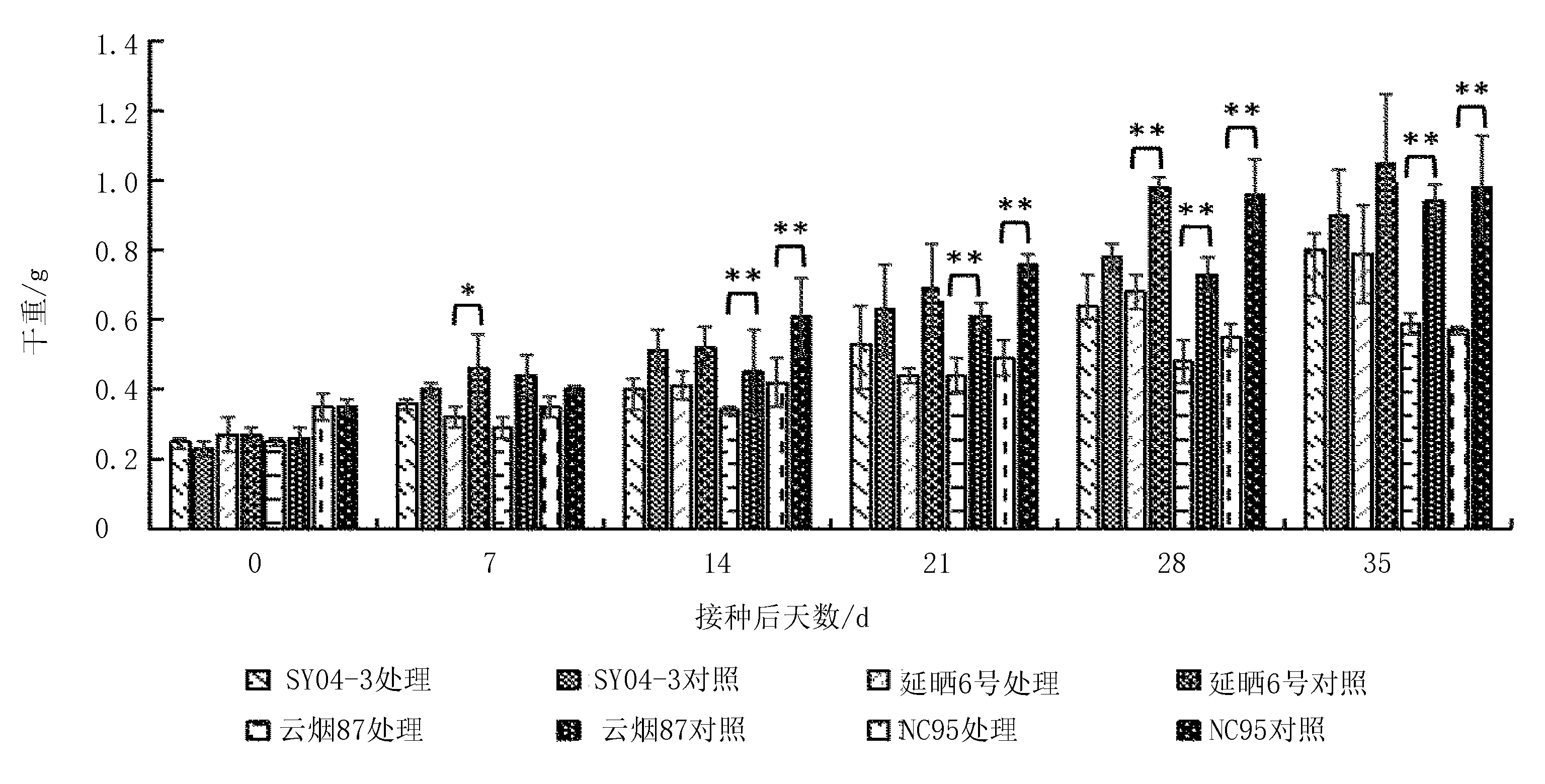
注:*表示为处理间t测验P<0.05,**表示为处理间t测验P<0.01,下同
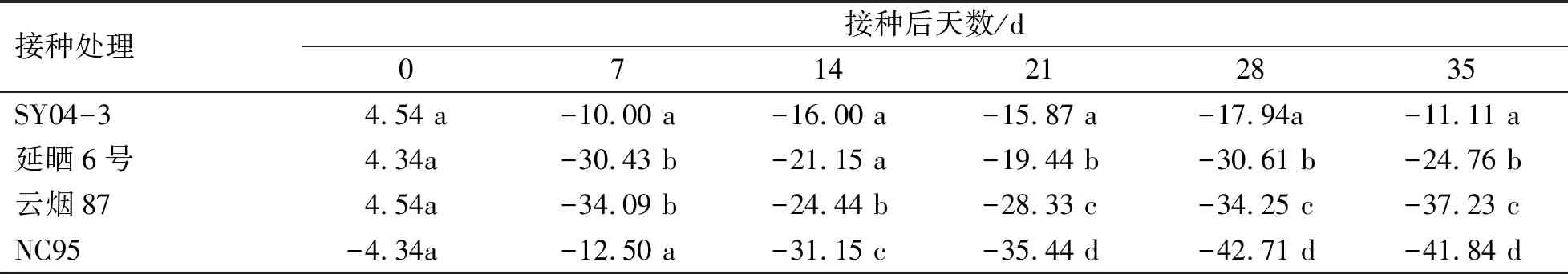
表1 各品种PVY接种处理的干物质积累增加(减少)幅度
2.2 4个烟草品种接种后抗氧化酶活性变化规律
2.2.1 4个烟草品种接种后超氧化物歧化酶(SOD)活性变化规律
各品种接种与未接种处理的SOD活性变化规律见图2。

图2 PVY接种与未接种的烟草中SOD活性的变化
由各品种接种与未接种处理的SOD活性变化规律可知(图2),各接种处理SOD活性均随接种时间的延长呈先迅速上升后下降的趋势,于接种后7 d酶活性达到峰值,之后开始下降,而各品种对照处理SOD活性均呈平稳上升趋势。接种后7~21 d,接种处理SOD活性均高于相应对照处理,而接种28~35 d,接种处理均低于相应对照处理。各品种接种处理的SOD活性增(降)幅度如表2所示,随接种时间延长,各品种接种处理的SOD活性增幅呈先升后降的趋势,在接种0~7 d迅速上升,并在第7天时各品种SOD活性增幅均达到最大,由大到小依次为109.29%(SY04-3)、80.08%(延晒6号)、67.76%(云烟87)和64.68%(NC95)。接种后7~35 d,各品种SOD活性增幅均逐渐下降,其中,SY04-3的SOD活性下降幅度最小,NC95下降幅度最大。
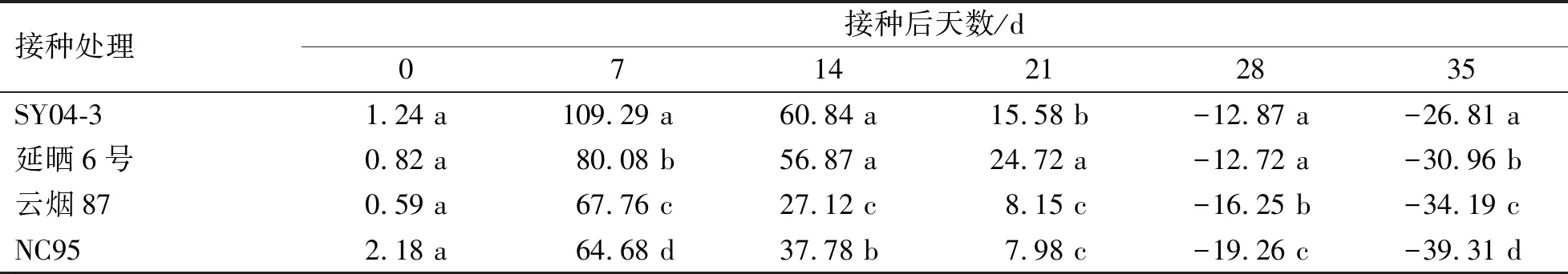
表2 各品种PVY接种处理的SOD活性上升(下降)幅度
2.2.2 4个烟草品种接种后过氧化氢酶(CAT)活性变化规律
同步教学的产生顺应了社会发展的需要,具有重要的历史意义。它是对个别教学方式的否定,是人类历史上的第一次重大的教学改革,有力地推动了教育事业的发展,促进了人类社会的进步。我们从我国近代语文教育发展的两个方面的分析中可见一斑。
由各品种接种与未接种处理的CAT活性变化规律可知(图3),PVY胁迫进程中,各接种处理CAT活性变化规律与SOD活性变化规律基本一致,即随接种时间推进活性均呈先上升后下降的趋势,但其酶活性峰值出现于接种后14 d,SY04-3活性最大(120.5 U·g-1·min-1),其次是延晒6号(105.25 U·g-1·min-1)、云烟87(92.25 U·g-1·min-1),最低的为NC95(87.36 U·g-1·min-1)。而各品种对照处理CAT活性均随接种时间的持续而增长。接种28 d时,除SY04-3外其余3个品种接种处理CAT活性均极显著低于相应对照处理(P<0.01),在接种后35 d,4个品种接种处理均极显著低于相应对照处理(P<0.01)。各品种接种处理的CAT活性上升(下降)幅度说明(表3):各品种接种处理的CAT活性增幅均呈先升后降趋势,并在14 d均达到峰值,其中,SY04-3(高抗)活性增幅,分别为延晒6号(中抗)的1.48倍、云烟87(中感)的2.95倍和NC95(感病)的4.30倍;在35 d时,SY04-3降幅最小,而NC95降幅最大,且4个品种增幅之间均存在显著性差异(P<0.05)。

图3 PVY接种与未接种的烟草中CAT活性的变化

表3 各品种PVY接种处理的CAT活性上升(下降)幅度
2.3 4个烟草品种接种后丙二醛(MDA)含量变化规律
各品种接种与未接种处理的MDA含量变化规律结果表明(图4),在接种后7~35 d,接种处理的MDA含量均呈迅速上升趋势,而对照处理的MDA含量均呈平稳上升趋势,各品种接种PVY处理的MDA含量均高于相应对照处理。接种后7 d,除SY04-3外其余3个品种接种处理MDA含量均极显著高于相应对照处理(P<0.01),在接种后14~35 d,4个品种接种处理均极显著高于相应对照处理(P<0.01)。各品种接种处理MDA含量增(降)幅度表明(表4),各品种MDA含量增幅均随接种时间的推进呈先升后降趋势。在接种7~35 d,各品种间MDA含量增加幅度均存在显著性差异(P<0.05),其中,高抗品种(SY04-3)MDA含量增幅始终显著低于其他品种(P<0.05),说明PVY抗性最强,而感病品种(NC95)显著高于其他品种(P<0.05),PVY抗性最弱。
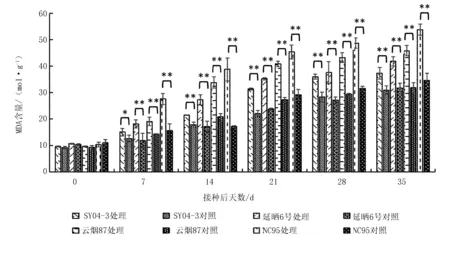
图4 PVY接种与未接种的烟草中MDA含量的变化
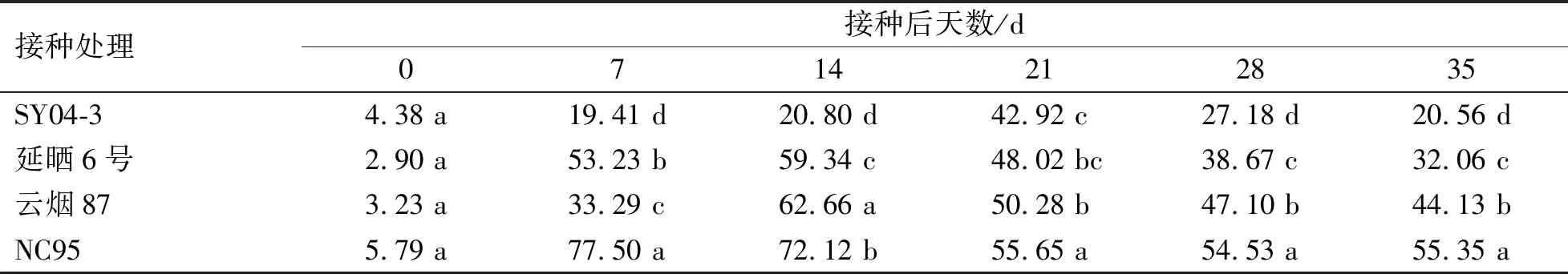
表4 各品种PVY接种处理的MDA含量增加(减少)幅度
2.4 4个烟草品种接种后净光合速率和叶绿素含量变化规律
由各品种接种与未接种处理的净光合速率变化规律可知(图5),在接种后7~35 d,4个品种的净光合速率均随接种时间的延长呈下降趋势,而对照处理的净光合速率随时间延长均呈平稳上升趋势。在接种后7~14 d,除SY04-3外其余3个品种接种处理净光合速率均极显著性低于相应对照处理(P<0.01),在接种后21~35 d,4个品种接种处理均极显著低于相应对照处理(P<0.01)。各品种接种处理的净光合速率增加(减少)幅度表明(表5),接种后7~35 d,各品种净光合速率降幅均呈明显增加趋势,其中,下降幅度最大的是NC95(感病),下降幅度最小的是SY04-3(高抗),且不同品种间的净光合速率的变化幅度均存在显著性差异(P<0.05)。

图5 PVY接种与未接种的烟草净同化速率的变化规律
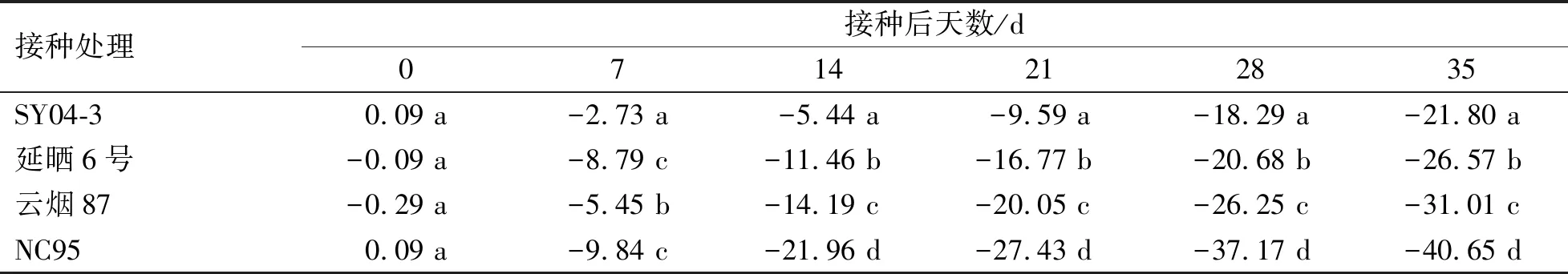
表5 各品种PVY接种处理的净同化速率增加(减少)幅度
各品种接种与未接种处理间叶绿素含量变化规律显示(图6),各品种对照处理的叶绿素含量随时间延长均呈平稳上升趋势,而接种处理叶绿素含量随接种后时间的延长均呈下降趋势。接种后0~7 d,各品种接种处理与相应对照处理之间均无显著性差异。在接种后7~35 d,各接种处理叶绿素含量均低于对照处理。在接种后14 d,感病品种(NC95)和中感品种(云烟87)叶绿素含量均显著低于对照处理(P<0.05),在21~35 d均极显著低于对照处理(P<0.01)。而高抗品种(SY04-3)和中抗品种(延晒6号)在接种后21~35 d叶绿素含量均显著低于对照处理(P<0.05)。由各品种接种后处理叶绿素含量增(降)幅度可知(表6),接种病毒后7~35 d,各品种叶绿素含量降幅逐渐增大,其中,下降幅度最大的是NC95(感病),下降幅度最小的是SY04-3(高抗)。综上所述,PVY抗性越强,叶绿素含量降低幅度越小。

图6 PVY接种与未接种的烟草中叶绿素含量变化规律
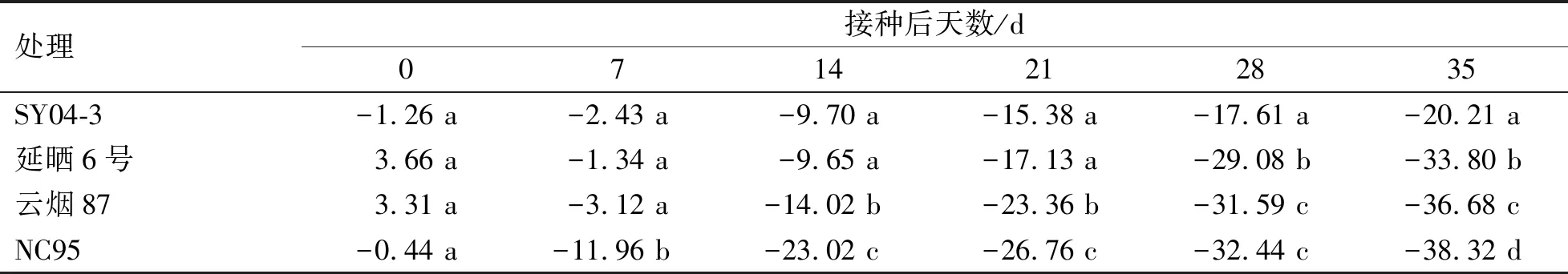
表6 各品种PVY接种处理的叶绿素含量增加(减少)幅度
2.5 基于主成分分析的4个烟草品种接种后综合性抗性评价
对4份烟草品种基于主成分分析进行PVY抗性排序(表7),SY04-3品种抗PVY的抗性程度最强,为2.48,延晒6号和云烟87次之,分别为1.17和-1.1,NC89抗PVY的抗性程度最低,为-2.25。该试验通过主成分分析值对不同烟草品种PVY抗性进行了排序,其结果与人工抗性鉴定结果为参照的抗性排序相同。
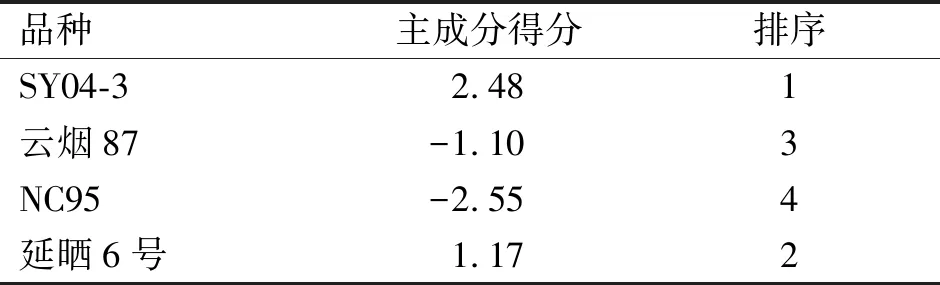
表7 接种PVY烟草生理指标主成分分析得分及抗性排序
3 讨论与结论
烟草接种PVY后会对烟株的生长发育产生较为严重的负面影响,主要表现为引起烟株花叶、斑驳、矮化、畸形、脉带坏死等症状,严重影响烟叶的质量与产量。该试验结果表明,对同一品种而言,接种PVY后,干物质积累量的增幅小于对照。4个烟草品种间比较可知,品种对PVY抗性越弱,其与对照间的差异越显著。
烟株在逆境条件下会发生一系列生理生化变化,导致活性氧的产生和累积,对烟苗植株产生一定程度的伤害[16]。活性氧会使细胞膜脂过氧化,对植物细胞的膜系统产生危害[17]。为消除这种活性氧,烟草植株体内形成抗氧化系统,同时增加抗氧化酶的活性,在过氧化氢酶(CAT)、超氧化物歧化酶(SOD)相互作用、彼此协调下,会维持细胞中的正常活性氧水平,从而有效抵御、减轻活性氧所产生的氧化胁迫伤害[18]。SOD作为清除活性氧类的主要酶类,能催化2O2-+2H+→H2O2+O2的反应[19]。该试验结果表明,烟株接种PVY后7~14 d ,由于病毒不断在烟株内部扩散,活性氧的积累也随之增加,协助烟株抵御病毒的侵害,高抗品种SY04-3的SOD活性比感病品种NC95更大,较高的SOD活性抵御了活性氧对烟株的伤害;但当活性氧的累积超出烟株内源SOD的消除能力时,烟株的生长发育便会受到明显的影响,与对照组相比,处理组的SOD活性随接种时间的延长逐渐下降,直至低于对照组,SOD活性变化与烟株感染PVY后的病程发展一致,说明SOD活性可作为判断烟株是否受PVYN病毒感染的重要指标。房保海等[20]研究表明,经烟草低头黑病菌处理后,无论抗病品种还是感病品种,超氧化物歧化酶活性均表现为先升高后下降,这点与该试验结果相同。
CAT作为植物细胞内非常重要的活性氧清除剂,其生理功能是将H2O2还原为O2和H2O[21]。O2-经SOD歧化可产生对细胞伤害更严重的H2O2和OH-自由基,而CAT与此物质的清除密切相关[22]。由试验结果可知,不同烟草品种的CAT活性均在接种PVY后有所上升,但由于PVY感染初期产生的活性氧伤害主要由非酶系统清除,所以CAT的活性没有在短时间内迅速升高,而CAT活性在处理后期的大幅度降低可能与烟草感染PVY后内部代谢紊乱有关;但总体上抗病品种的CAT活性高于感病品种,即高抗品种SY04-3的CAT活性减小幅度也小于感病品种NC95,其变化幅度与烟草品种抗性有一定关联,CAT活性变化也可作为辅助鉴定烟株感染PVYN的生化指标。该试验研究发现,烟草接种病毒后,过氧化氢酶活性会升高,且抗病品种的酶活性高于感病品种,这与杨建卿等[23-25]的研究结果基本一致。
MDA是膜脂过氧化作用形成的最终分解产物,其含量可以反映植物受到逆境伤害的程度。这与该试验研究结果相同,高抗品种SY04-3在接种PVY后,与其他品种相比,MDA含量最低并且增幅较小,而感病品种NC95在接种PVY后MDA含量持续大幅度上升,各处理MDA含量均高于相应对照组,且抗病性越强,MDA含量增幅越小。
叶绿素是光合作用中最主要的光合色素[26-28],植株感染病毒后,随着病毒不断侵染植株,叶绿体受到破坏,合成受阻,引起花叶、黄化或红化,同时降低其光合效率。由试验结果可知,PVY侵染烟草植株后,随着病毒的持续侵染,植株的光合速率明显降低,对照处理的光合速率则相对平稳,无大幅度波动;高抗品种SY04-3的光合速率降低幅度较小,而感病品种NC95则受PVY影响较大,光合速率明显降低。植物在感染病毒后,叶绿素分解酶的活性会有所增加,叶绿素被转化为叶绿素酯和叶绿素醇,导致叶绿素含量下降[29]。试验结果表明,4个烟草品种在接种PVY后,叶绿素含量均有所下降且低于相应对照组。病毒感染后期,与光合速率规律相似,抗病品种叶绿素含量降幅均小于感病品种。
主成分分析可以为不同烟草品种间的抗病性评价提供一个新的途径,通过生理生化指标对不同品种进行PVY抗性排序,主成分的选择需对原始数据进行降维处理,根据累积方差贡献率>80%和初始特征值>1的原则,从而确定主成分的数目。其中每个主成分都是原始变量的线性组合且互不相关,这些主成分可反映初始变量的绝大部分信息,且所含的信息互不重叠,从而达到简化评价指标的目的[30]。该主成分分析结果表明,4份烟草品种抗PVY的综合性排序由强到弱依次为SY04-3、延晒6号、云烟87和NC95,其结果与生理生化指标为参照的抗性排序相同。
由以上讨论可以得出,4个烟草品种在生理生化表现上与其品种抗性相对应,在接种PVY后,抗性较强的品种在抗氧化酶和丙二醛含量等方面表现更为优异,而抗性较弱的品种反之。通过分析感染PVY前后烟草植株的生理指标变化情况,可将干物质积累、光合速率、抗氧化酶活性等逆境生理指标作为辅助鉴定烟草抗PVY强弱的依据。
