番茄根系分泌物苹果酸和丁香酸对土壤细菌群落结构和潜在功能的影响
2022-11-16严文辉李志丹邓逐流谷益安
严文辉, 李志丹, 邓逐流, 谢 忱, 谷益安, 雷 鹏, 王 瑞, 李 莎, 徐 虹
(1.南京工业大学生物与制药工程学院,江苏南京211816;2.南京工业大学食品与轻工学院,江苏南京211816)
微生物参与土壤中众多的生化反应,是有机质的分解者和碳氮循环的驱动者,在土壤生态系统的养分循环中扮演着重要角色[1]。土壤微生物对植物生长具有重要意义,不仅可促进植株生长和养分吸收,还能缓解植物病害侵染和非生物胁迫[2-6]。植物将光合作用合成的11%~44%的碳以有机分泌物的形式释放至根际[7-8],植物根系分泌物包括有机酸和糖类等低相对分子质量化合物[9]。根系分泌物能够介导植物和微生物间的互作,例如植物可通过分泌特定根系分泌物来抵御病害侵染。酚酸类物质与植物抗病性密切相关,例如油棕榈分泌的丁香酸能够强烈抑制茎腐病病原菌的生长[10],番茄根系分泌物中的咖啡酸能够抑制青枯病病原菌生长[11],黄瓜分泌的香草酸能够降低根际中潜在致病菌木霉菌(Trichoderma)和镰刀菌(Fusarium)的相对丰度[12]。有趣的是,植物根系分泌物还可通过富集有益菌群来间接提高其对外界胁迫的适应性,例如有机酸是植物吸引有益菌的重要根系分泌物组分。当拟南芥叶片被病原菌丁香假单胞菌(Pseudomonassyringaestrain Pst DC3000)侵染时,其根系会分泌苹果酸以吸引有益菌枯草芽孢杆菌(Bacillussubtilisstrain FB17)从而其增强抗病能力[13];植物促生菌解淀粉芽孢杆菌(BacillusamyloliquefaciensNJN-6)对香蕉根系分泌的苹果酸表现出强烈的趋化性[14]。
番茄是中国重要的经济作物,其根系分泌物中含有较高比例的丁香酸和苹果酸,二者在调控番茄植株和土壤微生物互作过程中发挥了重要作用[15-17]。例如番茄分泌的苹果酸能吸引有益菌解淀粉芽孢杆菌(BacillusamyloliquefaciensT-5)[15]和荧光假单胞菌(PseudomonasfluorescensWCS365)[18-19]在其根际定殖;病原菌AgrobacteriumtumefaciensB6的侵染可诱导番茄根系分泌具有广谱抑菌作用的丁香酸[20]。尽管苹果酸、丁香酸对番茄生长具有重要作用,但其对土壤微生物组成及功能的影响尚不明确。根际土壤微生物来源于土壤,在不同土壤中种植相同的作物可能形成不同的根际微生物群落[21],因此供试土壤是研究根系分泌物对土壤微生物调控作用不可忽视的因素。天然根系分泌物的组成十分复杂,因此许多研究采用化学标准品配制的溶液模拟根系分泌物,以阐明根系分泌物对微生物群落的调控作用[12,22-23]。根系分泌物对土壤微生物的影响在一定程度上与物质浓度有关[24],例如香草酸仅在浓度较高的情况下才能对镰刀菌(Fusarium)产生抑制作用[12]。据估算,植物土壤中根系分泌物的分泌量(以碳计)约为0.05~0.10 mg/(g·d)[25-27]。本研究将苹果酸、丁香酸作为外源物,以较低剂量持续添加到黄瓜田、番茄田土壤中,借以模拟根系分泌物的自然分泌过程,并通过定量PCR、16S rRNA扩增子高通量测序及功能预测手段探究苹果酸、丁香酸对土壤细菌总量、群落组成和群落潜在功能的影响。
1 材料与方法
1.1 供试土壤
供试土壤分别采自南京市江宁区麒麟街道番茄田、南京市江宁区谷里街道黄瓜田。使用土钻采集0~20 cm表层土壤,自然风干后过10目筛,混匀后用于后续研究。
黄瓜田土壤的理化性质:土壤pH值5.76,电导率583.00 μS/cm,可溶性有机碳含量101.73 mg/kg,铵态氮含量7.48 mg/kg,硝态氮含量62.61 mg/kg。番茄田土壤的理化性质:土壤pH值5.42,电导率241.67 μS/cm,可溶性有机碳含量36.13 mg/kg,铵态氮含量23.56 mg/kg,硝态氮含量235.48 mg/kg。
1.2 苹果酸、丁香酸添加方法
分别取5 g土壤置于9孔板的单孔内,2种土壤各设置3个处理:(1)丁香酸处理,(2)苹果酸处理,(3)无菌水(对照),每个处理设3个重复。研究发现,植物根系土壤中根系分泌物的分泌量(以碳计)约为0.05~0.10 mg/(g·d)[25-27]。根据上述研究结果,本研究初步设置土壤中苹果酸、丁香酸的终含量(以碳计)为0.075 mg/g。
具体操作过程如下:分别配制3.667 g/L苹果酸、2.396 g/L丁香酸水溶液,然后用NaOH溶液调节pH值至7.0,以排除苹果酸、丁香酸对土壤pH值的影响,并过滤除菌。试验期间,每周一、周四分2次添加无菌水、无菌苹果酸溶液和无菌丁香酸溶液,每孔(共计5 g土壤)添加1 ml溶液或无菌水。将9孔板于25 ℃条件下培养,每隔2 d称取孔板质量以维持土壤含水量为最大持水量的60%,6周后收集土壤并立即提取土壤DNA。
1.3 土壤DNA的提取及实时荧光定量PCR
采用DNeasy PowerSoil DNA提取试剂盒(QIAGEN)提取土壤总DNA,提取步骤参照产品说明书。用Nano Drop(Thermo Scientific)微量核酸定量仪测定所提取DNA的质量和浓度。提取含有16S rRNA基因序列的质粒(pMD19-T载体),测定DNA浓度后以10倍为间隔梯度稀释为实时荧光定量PCR的标准品,将各浓度标准品进行实时荧光定量PCR测定,得到Ct值,以DNA浓度为纵坐标、Ct值为横坐标建立标准曲线。引物采用细菌通用引物F338(5′-ACTCCTACGGGAGGCAGCAG-3′)、R518(5′-ATTACCGCGGCTGCTGG-3′),使用SYBR Premix Ex Taq试剂盒(TaKaRa)和7500快速实时荧光定量PCR系统(Applied Biosystems)。每个样品设置3个重复,以灭菌ddH2O作为阴性对照。
1.4 细菌群落组成分析
使用细菌通用引物563F(5′-AYTGGGYDTAAAGVG-3′)、802R(5′-TACNVGGGTATCTAATCC-3′)对16S rRNA基因V4高变区进行PCR扩增,25.00 μl PCR扩增体系包括5.00 μl 5×反应缓冲液、5.00 μl 5×嘌呤脱氧核苷酸和胞嘧啶脱氧核苷酸高含量基因的PCR扩增缓冲液(GC buffer)、2.00 μl 脱氧核糖核苷三磷酸dNTP(2.5 mmol/L)、1.00 μl正向引物(10 μmol/L)、1.00 μl反向引物(10 μmol/L)、2.00 μl DNA模板、8.75 μl ddH2O、0.25 μl Q5 DNA酶。扩增程序:98 ℃预变性2 min;98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,72 ℃延伸5 min,25~30个循环。PCR产物经琼脂糖凝胶电泳和Nano Drop微量核酸定量仪检测后送至上海派森诺生物科技有限公司进行双向MiSeq测序。测序数据使用UPARSE标准操作流程[28]进行降噪:对同一样本的双向序列进行装配,去除低质量序列(最大期望误差为1.0)并用UCHIME方法[29]去除嵌合体(Chimera),然后将序列按照97%的相似性阈值指派为操作分类单元(Operational taxonomic unit,OTU)。使用Mothur[30]将所得样本的序列数量统一为最小序列数量(14 597条)。OTU的分类地位使用核糖体数据库项目(RDP Pipeline)[31]进行注释,置信阈值为80%。
1.5 细菌群落功能的预测
用Tax4Fun[32]对细菌群落功能进行预测。Tax4Fun基于最小16S rRNA序列相似度的最近邻法实现,提取KEGG数据库原核生物全基因组16S rRNA基因序列后,用BLASTN算法将其比对到SILVA SSU Ref NR 数据库(BLAST bitscore>1 500)建立相关矩阵,采用UProC、PAUDA 2种方法注释KEGG数据库中的原核生物全基因组功能信息,然后将其对应到SILVA数据库中,实现SILVA数据库功能注释。测序样品以SILVA数据库中的序列作为参考序列,聚类得出OTU,进而获取功能注释信息[33]。Tax4Fun分析基于R语言包Tax4Fun2。
1.6 数据分析
用SPPS 21进行方差分析(ANOVA,Tukey检验法)。用Mothur计算样本间的Bray-Curtis距离矩阵并构建聚类树。多元回归树(Multivariate regression tree,MRT)分析使用R(3.2.0)中的Vegan、Mvpart、MVPARTwrap软件包,分析基于OTU数据的Hellinger转换。细菌群落属水平的热图采用R(pheatmap 包)绘制,处理间差异使用Lefse[34]软件进行分析,筛选标准为P<0.05和线性判别分析(Linear discriminant analysis,LDA)结果>2。
2 结果与分析
2.1 添加外源苹果酸、丁香酸对黄瓜田和番茄田土壤总细菌含量的影响
实时荧光定量PCR结果表明,添加外源苹果酸时,土壤中的总细菌含量略有上升,但与对照相比变化不显著。与对照相比,添加外源丁香酸能显著降低土壤中的细菌总量(P<0.05),在黄瓜田、番茄田土壤中的降幅分别为56.38%、50.57%,添加外源苹果酸、丁香酸对土壤中细菌总量的影响在2种土壤中呈现相同的趋势(图1)。
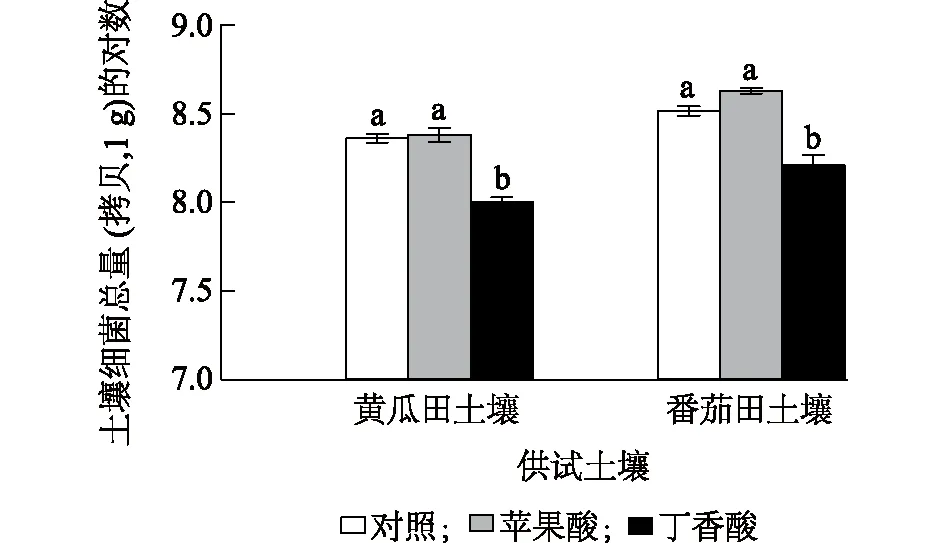
同一类土壤中的不同处理间标有不同小写字母表示差异显著(P<0.05)。
2.2 添加外源苹果酸、丁香酸对黄瓜田和番茄田细菌群落组成的影响
尽管供试黄瓜田、番茄田土壤细菌OTU差异明显(黄瓜田土壤的OTU数量为855~903个,番茄田土壤的OTU数量为1 100~1 115个),但是与对照相比,添加外源苹果酸、丁香酸对黄瓜田、番茄田土壤中的OTU数量均无显著影响(图2A)。在黄瓜田土壤中,添加外源苹果酸处理的土壤细菌OTU数量显著高于添加外源丁香酸处理(P<0.05)。
基于Bray-Curtis距离的聚类分析结果表明,土壤细菌群落可根据不同土地利用方式(黄瓜田和番茄田)及不同外源添加物(丁香酸、苹果酸)处理形成明显聚类(图2B),表明相同处理的数据重复性较好。多元回归树分析结果显示,土地利用方式和外源添加物质的种类(苹果酸、丁香酸和无菌水)共可解释77.88%的细菌群落组成变异(图2C),其中土地利用方式是影响土壤细菌群落组成的最大因子,可解释51.33%的土壤细菌群落组成变异,而外源添加物质共可解释26.53%的土壤细菌群落组成变异。
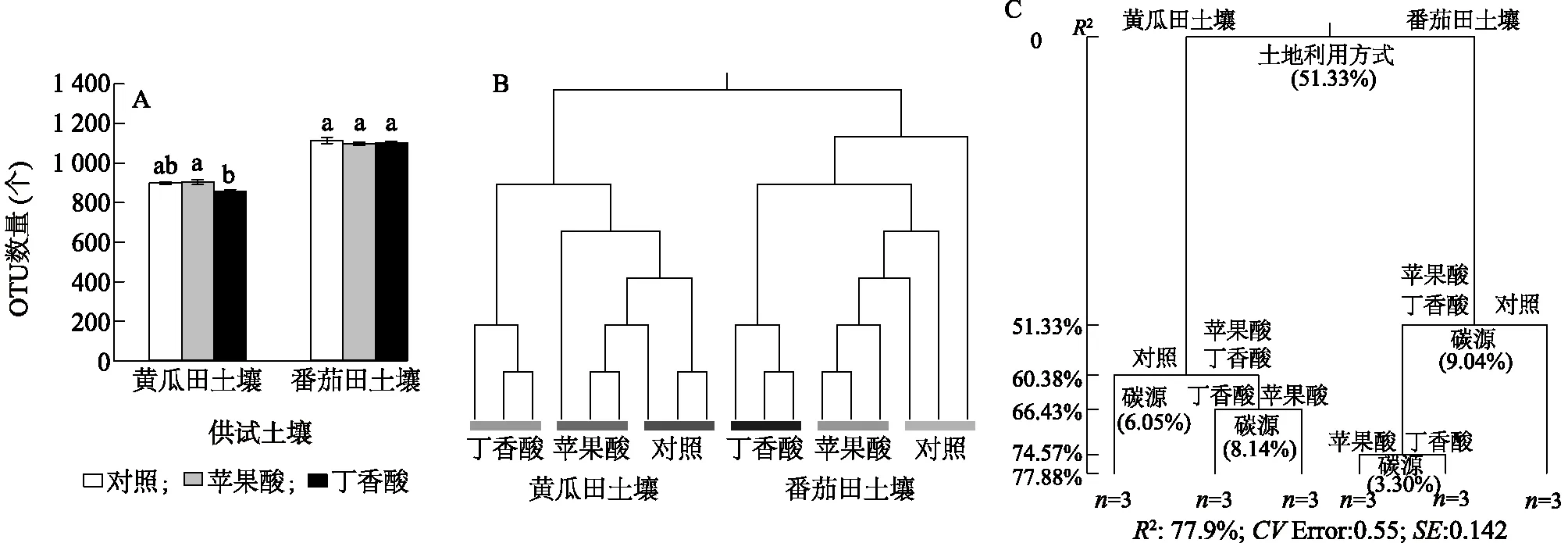
OTU:操作分类单元;CV Error:交叉验证误差;SE:标准差。A:土壤细菌OTU数量;B:基于Bray-Curtis距离的聚类分析结果;C:细菌群落多元回归分析结果。同一类土壤中不同处理间标有不同小写字母表示差异显著(P<0.05)。
本研究共检测到167个细菌属,其中相对丰度排名前20%(共34个)的属占比较高,34个细菌属的相对丰度累计可达40.14%。热图分析结果显示,添加外源苹果酸、丁香酸对主要细菌属(相对丰度排名前20%)的相对丰度有明显影响。在黄瓜田土壤中,添加外源苹果酸诱导了Burkholderia、Pseudonocardia属的富集(LDA结果>3,P<0.05),分别比对照高17.82倍、1.55倍;同时,添加外源苹果酸显著降低了Gaiella、Aridibacter、Arenimonas3个属的相对丰度。添加外源丁香酸显著提高了Gp6、Burkholderia、Flavitalea、Aridibacter、Gp1和Methylobacterium共6个属的相对丰度,比对照高1.13~47.73倍,并显著降低了Nocardioides、Massilia、Methylobacillus、Arenimonas、Subdivision3_genera_incertae_sedis、Solirubrobacter、Gp17和Ohtaekwangia共8个细菌属的相对丰度(图3a)。
在番茄田土壤中,添加外源苹果酸后,土壤中富集了Gp6、Ramlibacter、Gp16、Pseudonocardia和Labilithrix共5个细菌属,相对丰度比对照高0.94~2.33倍,而显著降低了WPS-1_genera_incertae_sedis、Kofleria、Flavisolibacter、Methylobacillus、Terrimonas、Flavitalea和Ohtaekwangia共7个属的相对丰度。添加外源丁香酸后,土壤中富集的细菌属共有7个:Spartobacteria_genera_incertae_sedis、Ramlibacter、Massilia、Pseudonocardia、Phenylobacterium、Myxococcus、Aridibacter,比对照高0.19~11.70倍,相对丰度显著降低的属仅有Kofleria(图3b)。有趣的是,添加外源苹果酸在2种土壤中均能显著富集Pseudonocardia,而添加外源丁香酸在2种土壤中均能显著富集Aridibacter。
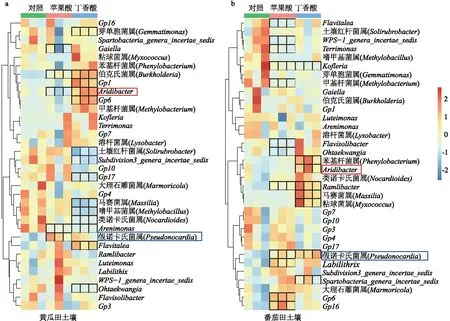
a:黄瓜田土壤细菌在属水平的热图;b:番茄田土壤细菌在属水平的热图。黑框表示相同土壤中与对照差异显著;蓝框、红框表示添加外源苹果酸、丁香酸在黄瓜田、番茄田土壤中共同富集的类群。部分拉丁名暂无统一的中文名。
2.3 添加外源苹果酸、丁香酸对黄瓜田和番茄田土壤细菌群落潜在功能的影响
细菌菌群以生物膜的形式在植物根表面定殖,形成生物膜是根际菌群影响植物生长的功能基础。Tax4Fun功能预测结果表明,与对照相比,添加外源苹果酸在2种土壤中对生物膜形成均无显著影响,而添加外源丁香酸则均能抑制细菌生物膜形成,在黄瓜田、番茄田土壤中,生物膜形成的功能丰度分别比对照低0.206个百分点、0.282个百分点,且添加外源丁香酸在番茄田土壤中的作用显著(图4a)。
丁香酸是一种芳香烃,添加外源丁香酸可以提高土壤细菌对芳香族化合物的降解能力,与对照相比,添加外源丁香酸在黄瓜田、番茄田土壤中对芳香族化合物降解能力的增幅分别为0.226个百分点、0.347个百分点,并且在番茄田土壤中的作用显著。此外,添加外源苹果酸同样提高了番茄田土壤细菌群落对芳香族化合物的降解能力(图4b)。苹果酸属于短链有机酸,添加外源苹果酸处理能够提高土壤细菌对短链有机酸的降解能力,与对照相比,在黄瓜田、番茄田土壤中土壤细菌对短链有机酸的降解能力分别提高了0.037个百分点、0.080个百分点,并且在番茄田土壤中的作用显著;此外,与对照相比,添加外源丁香酸处理同样提高了番茄田土壤对短链有机酸的降解能力(图4c)。
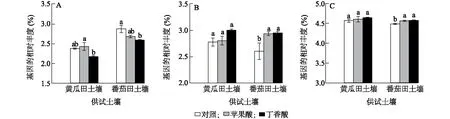
A:生物膜形成相关基因的相对丰度;B:芳香族化合物降解相关基因的相对丰度;C:短链有机酸降解相关基因的相对丰度。相同土壤中处理间不同小写字母表示差异显著(P<0.05)。
3 讨论
在本研究中,添加外源苹果酸虽然能提高细菌总量,但是影响不显著,可能由于外源苹果酸施加剂量较低造成的。例如,以往的研究发现,苹果酸浓度越低,其对根际促生菌BacillussubtilisFB17的吸引效果越弱[13]。与苹果酸不同的是,添加外源丁香酸可显著降低黄瓜田、番茄田土壤细菌总量。有研究发现,丁香酸可以通过破坏细胞膜渗透性来抑制大肠杆菌(Escherichiacoli)[35]、酒类酒球菌(Oenococcusoeni)[36]、阪崎克罗诺杆菌(Cronobactersakazakii)[37]的生长,因此添加外源丁香酸能够降低土壤中细菌总量可能与其抗菌能力有关。此外,添加外源苹果酸、丁香酸对细菌总量的影响在不同土壤中的表现一致,说明不同来源的土壤微生物群落对于同一物质的响应存在相似性。
添加外源苹果酸、丁香酸能够显著地改变土壤细菌组成,但与对照相比,添加外源苹果酸、丁香酸处理的OTU数量没有显著变化,说明二者对土壤细菌群落组成的影响是通过改变某些细菌类群的丰度实现的。例如,在不同土地利用方式的土壤中,苹果酸均能显著提高假诺卡氏菌属(Pseudonocardia)的相对丰度,而丁香酸均能显著提高Aridibacter的相对丰度。Pseudonocardia隶属于放线菌门(Actinobacteria)假诺卡氏菌科(Pseudonocardiaceae)[38],有研究发现该属细菌具有降解芳香族化合物的功能及潜在的抑菌功能[39-42],但其与植物的关联尚不明确。Aridibacter是植物根际的主要细菌[43-45],具有反硝化功能[42],遗憾的是,该细菌属与植物的关系有待深入研究。碳是土壤微生物生存的一大限制因素[45],添加外源的含碳有机物可以为土壤微生物的生长提供营养[7,46-47],因此苹果酸、丁香酸可能作为直接的营养物质来提高Pseudonocardia、Aridibacter的丰度。另一方面,土壤细菌之间存在资源竞争关系,添加碳源可能缓解细菌之间的竞争关系从而导致Pseudonocardia、Aridibacter的丰度提高[48-49]。
生物膜是大量微生物细胞由胞外聚合物包裹形成的膜状结构,生物膜的形成是微生物在植物中成功定殖的先决条件[14]。以往的研究发现,苹果酸能够促进多种微生物形成生物膜[13-15,18-19],但是本研究发现,苹果酸对生物膜形成的作用不显著,可能由于苹果酸的施加剂量较低[24]。在番茄田土壤中添加外源丁香酸可显著抑制细菌生物膜的形成潜能,或与丁香酸的抑菌特性相关[10,35]。在土壤中添加外源某些物质可能富集该类物质的降解细菌类群,例如近期的研究发现,长期的秸秆还田可富集秸秆降解真菌,从而加速秸秆腐解速率[50],酚类化合物可以诱导根际酚酸降解微生物的富集[51]。本研究发现,添加外源丁香酸可富集芳香族化合物降解菌,添加外源苹果酸可富集短链有机酸降解菌。值得注意的是,添加外源苹果酸同样可富集芳香族化合物降解菌,而添加外源丁香酸则富集了短链有机酸降解菌。在本研究中,添加外源苹果酸处理土壤中富集的假诺卡氏菌属(Pseudonocardia)是一种可有效降解芳香族化合物的细菌类群[52-53]。植物根际富集的根际微生物群落与土壤来源有关[21,54-55]。在本研究中,添加外源苹果酸、丁香酸仅在番茄田土壤中能显著提升芳烃、短链有机酸降解菌的相对丰度,而在黄瓜田土壤中的作用不显著,说明不同利用类型的土壤微生物对植物根系分泌物的响应存在差异。
4 结论
添加外源苹果酸对土壤细菌总量的影响不显著,而添加外源丁香酸能显著降低土壤细菌总量。添加外源苹果酸、丁香酸均能显著改变土壤细菌群落组成,添加外源苹果酸在黄瓜田、番茄田土壤中均能富集假诺卡氏菌属(Pseudonocardia)细菌,而添加外源丁香酸在黄瓜田、番茄田土壤中均能富集Aridibacter属细菌。添加外源苹果酸能显著提高细菌群落的短链有机酸降解能力,添加外源丁香酸可降低细菌生物膜的形成能力并提高细菌群落对芳香族化合物的降解能力,但上述作用与土壤利用方式有关。
