儿童重症肺炎继发噬血细胞性淋巴组织细胞增生症临床特征分析
2022-11-16涂小波雷尚春魏玉敏冉海波
涂小波 舒 畅 邓 芳 雷尚春 魏玉敏 冉海波
重庆医科大学附属儿童医院呼吸科 国家儿童健康与疾病临床医学研究中心 儿童发育疾病研究教育部重点实验室 儿科学重庆市重点实验室(重庆 400014)
在国际组织细胞协会噬血细胞性淋巴组织细胞增生症(hemophagocytic lymphohistiocytosis,HLH)2004指南中,HLH被定义为以抗生素治疗无效的持续性发热、外周血细胞两系/三系减少、肝脏及脾脏肿大、肝功能损害、高三酰甘油血症/低纤维蛋白原、高铁蛋白血症等表现为特征的临床综合征,并可在骨髓、肝、脾、外周淋巴组织中发现良性组织细胞增多伴噬血细胞现象[1]。HLH 按其发病机制可分为原发性和继发性。继发性HLH,又称反应性HLH,可由感染、肿瘤、风湿性疾病、药物等因素触发,其中继发于感染因素者最常见,称为感染相关噬血细胞综合征(infection-associated hemophagocytic syndrome,IAHS)。国内外关于重症肺炎继发HLH 的报道逐年增多[2-3]。如若早期接受小剂量糖皮质激素和/或人丙种免疫球蛋白免疫调节治疗,多数重症肺炎继发HLH病例可以痊愈[2]。故2019年北美的组织细胞增多症联盟建议用拟HLH(HLH mimics)来描述这类治疗上不需严格以HLH-2004方案化疗,随原发疾病控制而好转的临床综合征,以区别于其他如肿瘤、结缔组织系统疾病、EB病毒感染继发的HLH[4]。
儿童继发性HLH较成人少见,且预后明显优于传统分类的原发性HLH。既往在儿童中的研究主要关注原发性HLH的筛检标准及影响其预后的危险因素。随着对继发性HLH研究的不断深入,Fardet等[5]提出了继发性HLH早期识别诊断的风险预测模型如HScore评分,并已应用于临床[6]。本研究回顾性分析重症肺炎继发HLH患儿的临床特点及相关危险因素,为进一步阐明其发生发展过程和发病机制提供临床经验。
1 对象与方法
1.1 研究对象
回顾性分析2012年10月1日至2019年12月31日于重庆医科大学附属儿童医院住院治疗明确诊断为重症肺炎继发HLH(观察组)患儿的临床资料。随机选取2019 年于该院住院就诊的重症肺炎患儿作为对照组。观察组纳入标准:①年龄29 天~18 岁;②符合重度(重症)肺炎诊断标准[7];③病史资料齐全、详实;④符合国际组织细胞学会HLH-2004对HLH 的临床诊断标准[8]。排除标准:①存在原发免疫缺陷、肿瘤性疾病、器官移植术后等基础免疫状态异常者;②非重症肺炎继发HLH,包括原发性HLH,肿瘤相关、免疫缺陷相关、结缔组织性疾病相关HLH,EB病毒感染继发的HLH等。对照组纳入标准:同观察组纳入标准①~③;排除标准:同观察组排除标准①外,同时排除合并HLH的病例。
1.2 方法
1.2.1 临床资料收集 收集患儿基本情况(包括入院信息、年龄、体重、出生史、喂养史、既往健康情况、家族史等),临床表现包括肺部体征、神经系统表现、肝脾淋巴结肿大情况、皮疹等,实验室检查包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白、乳酸脱氢酶(LDH)、C 反应蛋白(CRP)、降钙素原(PCT),病原体检出情况,影像学检查资料,住院经过(住院天数,是否ICU治疗)及最终结局(存活、死亡)。
1.2.2 治疗方案和随访 两组病例均予以抗感染治疗,包括临床经验性或依据细菌培养检测结果予以有效抗细菌治疗,或针对病毒特异性检出结果予以抗病毒治疗,或依据真菌学结果予以相应抗真菌治疗。部分病例予以人丙种免疫球蛋白(0.8~1.0 mg·kg-1·d-1×2 d)、小剂量糖皮质醇激素(泼尼松龙或甲基泼尼松龙2~4 mg·kg-1·d-1,5~7天后减量,每2周减半直至停用)治疗。观察组根据病情需要按HLH-2004 化疗方案予以地塞米松、依托泊苷、环孢素A 序贯化疗并个体化调整。因所有病例均未行HLH-2004 化疗维持治疗,结局事件简单定义为存活(临床治愈)或死亡。两组患儿均随访至出院后8周或死亡。
1.3 统计学分析
采用SPSS 25.0统计软件进行数据分析。非正态分布的计量资料以M(P25~P75)表示,组间比较采用Wilcoxon 秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。采用受试者工作特征(ROC)曲线分析实验室指标对于重症肺炎继发HLH的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
初步纳入重症肺炎合并HLH患儿64例,排除基础免疫状态异常(全脾切除术后)1 例,原发性HLH 1例,肿瘤相关HLH 6例(腹腔实体肿瘤1例、淋巴瘤1例、急性白血病4例)、免疫缺陷相关HLH 7例、结缔组织性疾病相关HLH 1例,EB病毒感染继发HLH 10例,最终纳入观察组38例。通过调取2019年度全年重庆医科大学附属儿童医院出院诊断为重症肺炎(未合并HLH)患儿3 064 例,采用简单随机法抽样100例,排除发病年龄<29天2例、基础免疫状态异常2例(急性髓细胞性白血病1例、肝移植术后1例),最终纳入对照组96例。
与对照组相比,观察组年龄较大,6月龄~2岁比例较高,发热、嗜睡、反应差和烦躁比例较高,中位热程较长,肝脾、淋巴结肿大,皮疹,浮肿的比例较高,肺部听诊中细湿啰音、气促和/或发绀的比例较低,差异有统计学意义(P<0.05)。见表1。
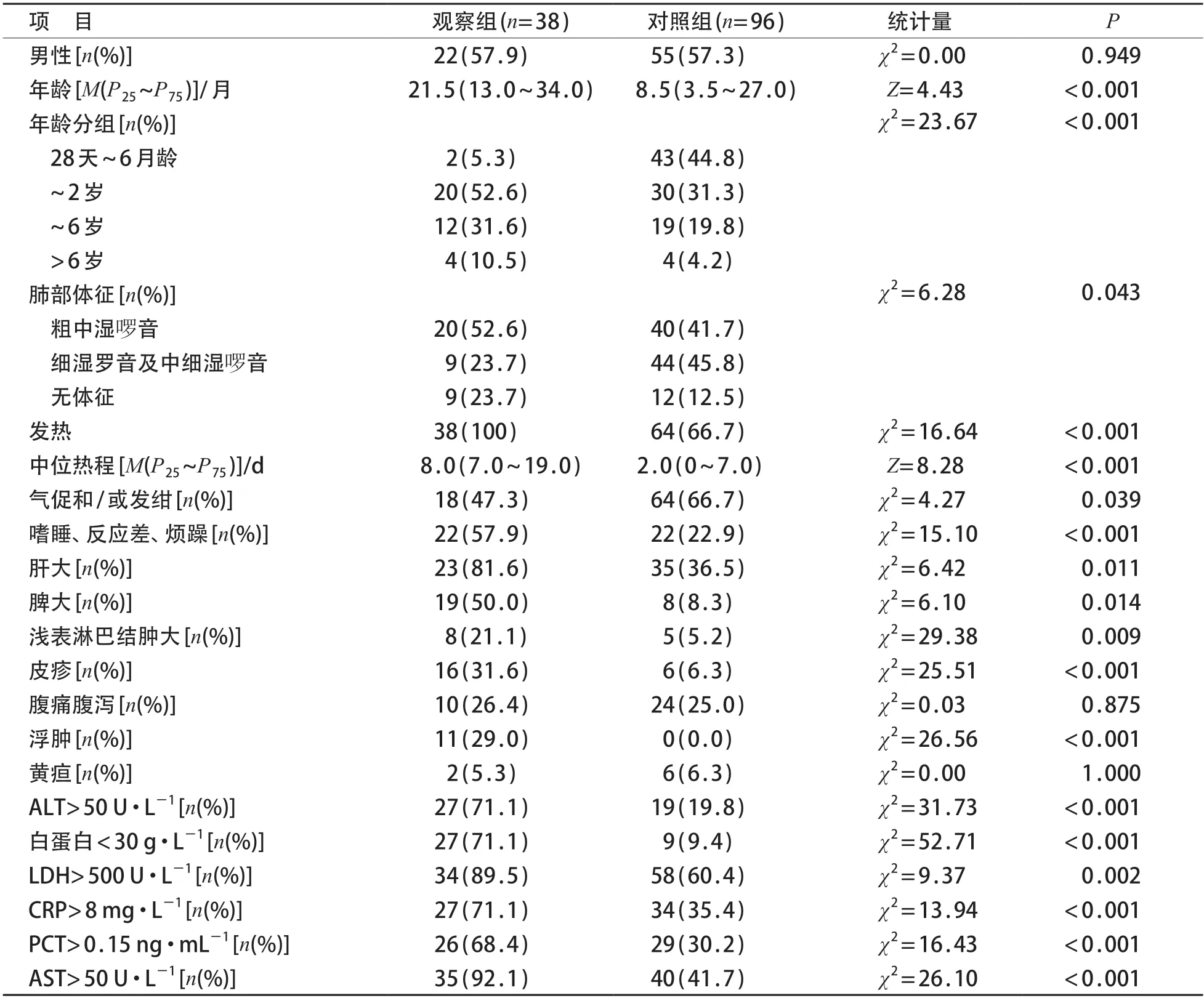
表1 观察组及对照组一般临床资料比较
2.2 两组间实验室检查比较
与对照组相比,观察组ALT、AST、LDH 异常升高,白蛋白<30 g/L,CRP>8 mg/L,PCT>0.15 ng/mL的比例较高,差异有统计学意义(P<0.05)。见表1。
2.3 两组间病原体检出情况比较
观察组检出病原体54 株,其中病毒20 株,细菌18 株,肺炎支原体10 株,真菌6 株(白色假丝酵母菌5 株,黄曲霉菌1 株)。对照组检出病原体126株,其中检出病毒58株,细菌53株,肺炎支原体14株,真菌1株。与对照组相比,观察组腺病毒和真菌比例较高,RNA 病毒比例较低,差异有统计学意义(P<0.05)。见表2。
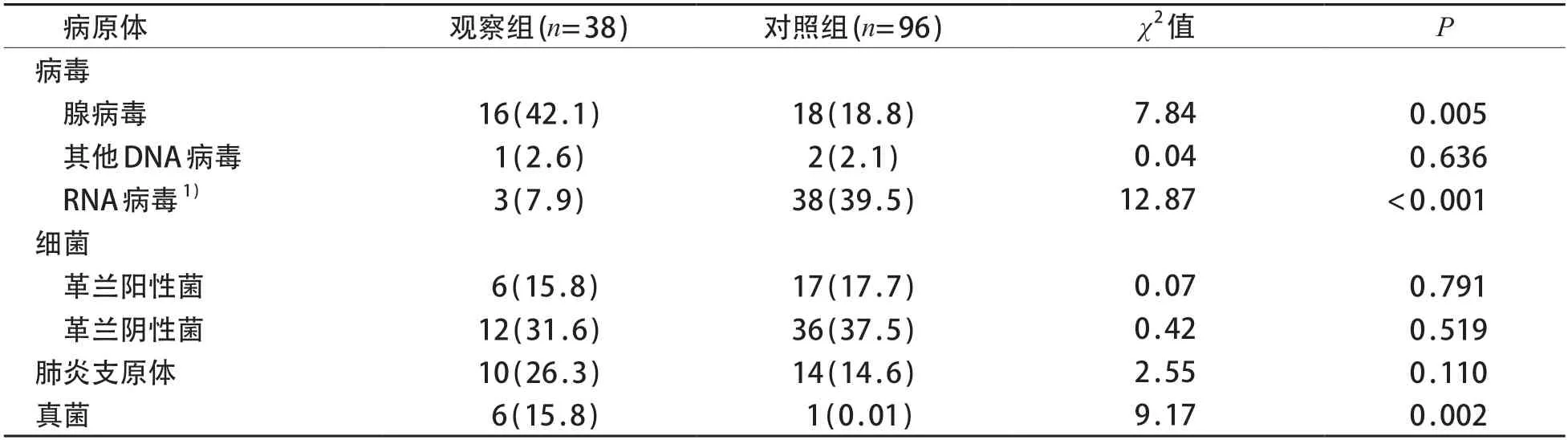
表2 观察组与对照组下呼吸道标本各类病原体检出率情况[n (%)]
2.4 两组间胸部影像学结果比较
观察组38例均行肺部CT检查;对照组96例均行胸片检查,65 例行肺部CT 检查。观察组胸腔积液、肺实变/肺不张、双肺广泛病变发生率均高于对照组(P<0.05),差异有统计学意义(P<0.05)。见表3。
2.5 两组治疗及预后
观察组38例,中位住院天数14.9天(7.8~19.4天)。10 例于确诊后自动出院(其中8 例于出院1 周内死亡),其余28 例患儿均接受抗感染治疗。23 例加用人丙种免疫球蛋白或小剂量糖皮质激素治疗,其中20 例痊愈,3 例于急性期死亡;5 例接受HLH-2004方案治疗,临床治愈2例,均在化疗后8周内停药,未行HLH-2004 维持治疗,3 例死亡。所有患儿均未行造血干细胞移植。对照组96例,中位住院天数8.5天(5.9~13.9天)。所有患儿均予抗感染治疗,其中22例联合静脉使用人丙种免疫球蛋白或小剂量糖皮质激素抗炎。
两组之间住院天数、病死率和ICU 入住率差异有统计学意义(P<0.05)。见表3。
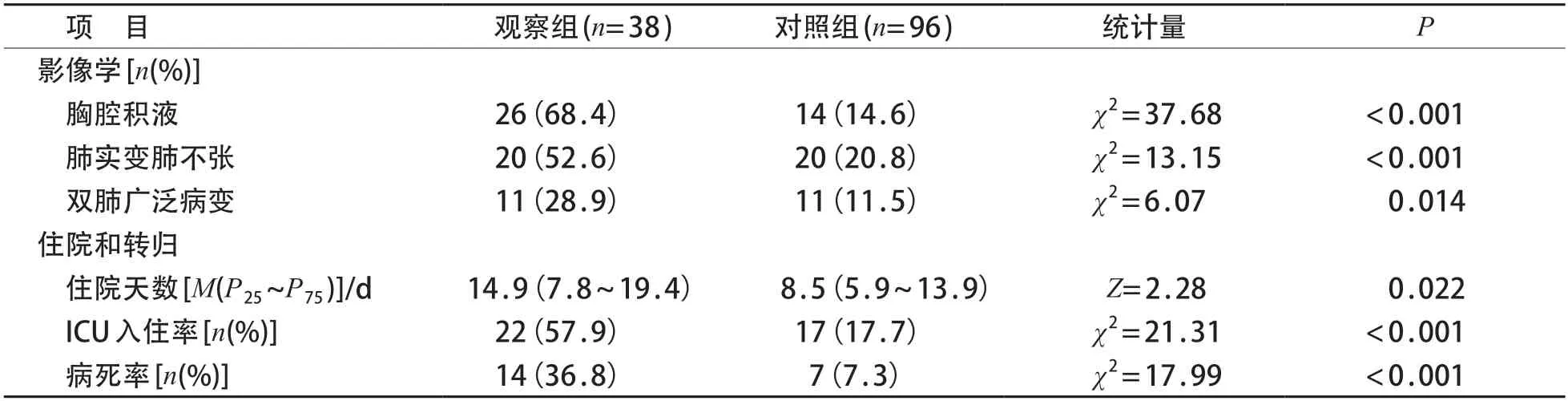
表3 观察组与对照组影像学和住院情况比较
2.6 各指标对于重症肺炎继发HLH的预测价值
采用ROC 曲线分析CRP、PCT、ALT、LDH、AST、白蛋白对于重症肺炎继发HLH 的预测价值,其中LDH对重症肺炎继发HLH的预测价值较高,曲线下面积(AUC)为0.93(0.88~0.98),约登指数为0.78,截断值为804.35 IU/L。见表4和图1。
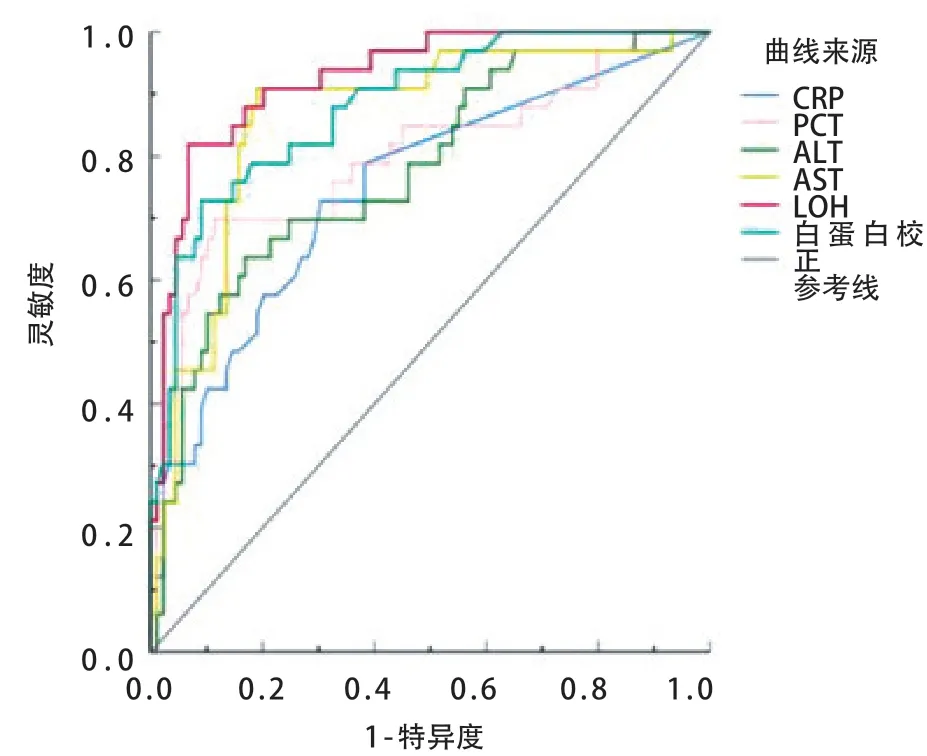
图1 不同因子预测重症肺炎继发HLH 的ROC 分析
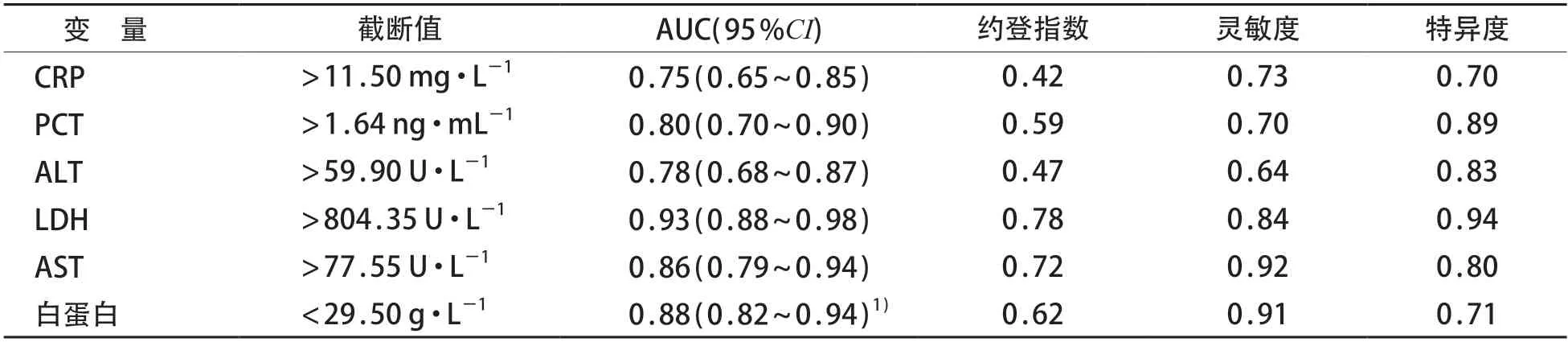
表4 不同指标预测重症肺炎继发HLH的ROC曲线分析
3 讨论
重症肺炎继发HLH的病例报道逐年增多[6],早期识别重症肺炎儿童继发HLH 风险有助于临床及时诊治。本研究旨在分析重症肺炎继发HLH患儿与未继发HLH 的重症肺炎患儿的临床特征及实验室检查结果差异,寻找能预测儿童重症肺炎继发HLH的实验室指标。
本研究中重症肺炎继发HLH 组患儿以6 月龄~2岁龄为主,与既往感染继发性HLH报道[6]相似;中位起病年龄较对照组大,考虑与继发性HLH的发生关键在于系统免疫反应的过度激活有关。年龄越小,免疫系统越不成熟,尤其6个月内机体体液免疫、单核吞噬细胞功能尚未发育,这可能是两组年龄差异的原因。
观察组病例全部有发热表现,其次为肝肿大23例(81.6%),与既往文献[9-10]相符,脾肿大仅19例(50.0%),较既往继发性HLH文献报道[9]偏低,与既往儿童重症肺炎继发HLH 报道[10]相仿。观察组患儿多数以发热起病,而对照组多以咳嗽、喘息起病,观察组较对照组呼吸道症状轻、体征少,但肺部影像学检查提示观察组肺部病变更明显,考虑原因为疾病起病形式及发展过程不同导致的差异。有研究发现与普通型肺炎比较,暴发性肺炎常以发热为首发及主要症状[11],提示以发热起病的重症肺炎患儿系统性炎症反应可能更重,临床应予重视。
本研究发现观察组多数病例LDH升高且程度明显,与既往儿童感染相关性HLH研究结果相符合[12]。有研究表明LDH 可作为成人感染继发HLH 风险的独立预测因子[13]。本研究通过ROC曲线分析显示,以LDH>804.35 U/L作为截断值预测重症肺炎继发HLH,其灵敏度为84.2 %、特异度为93.6 %,准确度为78.0 %,故LDH升高,亦可作为预测儿童重症肺炎继发HLH的参考指标。重症肺炎继发HLH患儿中低蛋白血症多见(71.1 %),与既往儿童继发性HLH研究结果相符合[11],ROC分析结果提示利用白蛋白<29.5 g/L作为截断值预测重症肺炎继发HLH的灵敏度为90.5 %、特异度71.1 %,提示重症肺炎患儿白蛋白下降对继发HLH有早期提示作用。
本研究中发现腺病毒是导致儿童重症肺炎继发HLH的重要病原,与既往儿童感染继发性HLH中的报道[11]相似。腺病毒侵入后与机体免疫系统相互作用表现为:吞噬细胞吞噬受感染后凋亡细胞,识别病毒识别受体而活化,释放一系列细胞因子激活机体固有及特异性免疫系统[14]。在重症感染下,腺病毒往往复制快速且拷贝数量大,受感染细胞广泛,甚至播散导致全身性腺病毒病;而机体免疫反应不断增强,尤其是细胞毒性T 淋巴细胞在病毒感染细胞未被清除时持续不断活化,导致机体免疫失衡[15]。故临床对于腺病毒感染所致重症肺炎出现肺外脏器受累时,须警惕继发HLH 的可能。虽然既往已有关于肺炎支原体肺炎继发HLH的部分病例报道,本研究中肺炎支原体在重症肺炎继发HLH 组有一定检出率(26.3%),与相关研究中肺炎支原体检出率(23.3%)[10]相仿,但本研究中肺炎支原体检出率在两组间差异无统计学意义,尚须进一步研究证实。
本研究发现重症肺炎继发HLH 患儿胸腔积液发生率为68.4%,较国内外继发性HLH肺部受累研究报道的34.0%~45.6%高[16-17],而与国内重症肺炎继发HLH报道的65.7%相仿[10]。对照组胸腔积液发生率为14.6%,显著低于观察组,提示并发胸腔积液与重症肺炎患儿易继发HLH相关。
观察组患儿中位住院天数更长,ICU入住率、病死率更高,大部分病例予抗感染、较低强度的免疫调节治疗可以治愈,与既往感染继发HLH文献报道[12,16]相符合,提示对于重症肺炎继发HLH 患儿,及时予以免疫调节治疗可帮助患儿机体平息失控的系统炎症因子风暴,给原发疾病治疗争取时间、改善预后。
综上,重症肺炎患儿继发HLH 者病情严重、病死率更高。本研究中,继发HLH 者较单纯重症肺炎患儿LDH 升高及白蛋白降低更明显,其中LDH>804.35 IU/L 对重症肺炎继发HLH 的预测价值较高。腺病毒感染、存在胸腔积液的重症肺炎患儿更易继发HLH。
