微RNA-21和Peli1在自身免疫性早发性卵巢功能不全小鼠体内的表达及意义
2022-11-16杨雨涛李欣然谢嘉欣马闻擎付霞霏
杨雨涛,李欣然,谢嘉欣,王 袁,马闻擎,付霞霏
南方医科大学珠江医院妇产科,广州 510280
早发性卵巢功能不全(premature ovarian insufficiency,POI)是指女性在40岁前出现卵巢功能衰退的临床综合征,以月经紊乱(如停经或月经稀发至少4个月)伴高促性腺激素和低雌激素为特征,且间隔>4周连续2次卵泡刺激素(folliclestimulating hormone,FSH)>25 IU/mL[1]。POI病因复杂,包括遗传因素、自身免疫失调、感染或医源性因素等。自身免疫失调可能参与4%~30%的POI发生。POI与其他自身免疫病密切相关,如艾迪生病、抗磷脂抗体综合征、甲状腺功能减退症和糖尿病等[2-3]。
miRNA是长约22 nt的非编码RNA。这些miRNA能够与mRNA结合,阻断蛋白质编码基因的表达,防止它们翻译成为蛋白质,在细胞增殖、代谢、凋亡、分化等生物学过程中发挥重要调控作用。miRNA-21是一种多功能miRNA,可调节炎症,在先天性和获得性免疫反应、生殖系统疾病、心血管系统疾病及多种肿瘤中发挥至关重要的作用[4]。前期研究表明,过表达miRNA-21与减少颗粒细胞凋亡有关,并部分缓解了化学治疗引起的卵巢损害(卵泡计数、卵巢质量和雌二醇水平增加,FSH水平降低)[5],但尚未阐明miRNA-21与自身免疫性POI的相关性。
通常一种miRNA可以和多个靶基因相互作用。miRNA-21能靶向Pellino-1(Peli1)基因,促进致病性辅助性T细胞17的葡萄糖代谢[6]。miRNA-21的一些靶基因如信号转导及转录激活因子3与癌症有密切关系[7]。Peli1基因编码的蛋白质是一种高度保守的环指类E3泛素化连接酶,在T细胞中多处表达,并负性调节T细胞活化[8]。目前,普遍认为自身免疫性POI的发病机制是T细胞比例失衡,调节性T细胞(regulatory T cell,Treg)比例下降[9]。研究发现过表达Peli1可以改善自身耐受性和免疫抑制,并发现Peli1与多种自身免疫病有关,如系统性红斑狼疮、自身免疫性脑脊髓炎[10-11]。因此,miRNA-21可能通过调控Peli1参与自身免疫性POI的发生和发展。
本研究通过生物信息学预测miRNA-21的靶基因,并分析miRNA-21和其靶基因Peli1在自身免疫性POI模型小鼠中的表达,为探讨自身免疫性POI的发病机制和治疗策略提供依据。
1 材料和方法
1.1 动物及分组 7~8周龄雌性BALB/c小鼠(体重为18~22 g,动物合格证号44005800010117)购自南方医科大学实验动物中心[实验动物生产许可证号SCXK(粤)2018-0002,实验动物使用许可证号SYXK(粤)2019-0215]。所有小鼠均在(30±2)℃和14 h光照/10 h黑暗条件下自由摄食、饮水,每天早上8:00-9:00进行阴道涂片检查。选用发情周期正常的24只小鼠随机均分为POI组和对照组,每组12只。本研究通过南方医科大学动物实验伦理委员会审批(2018A030313167)。
1.2 POI模型小鼠构建 小鼠透明带3(zona pellucida 3,ZP3)多 肽(NSSSSQFIHGPR,中 国捷威生物科技有限公司)以1 mg/mL的质量浓度溶解于蒸馏水中,超滤除菌。然后将ZP3多肽溶液乳化成等体积的完全免疫佐剂和不完全免疫佐剂。POI组小鼠在后足和腹部皮下注射0.15 mL含75 µg ZP3多肽的完全免疫佐剂乳剂,14 d后在相同部位皮下注射0.15 mL含75 µg ZP3多肽的不完全免疫佐剂乳剂。自第2次注射后6周,小鼠出现发情周期不规则或延长,证明POI模型小鼠建立成功。对照组小鼠在相同部位注射等体积生理盐水。
1.3 卵巢结构和卵泡计数 第2次注射后6周 (POI小鼠建模成功)随机选取POI及对照组小鼠各6只,取单侧卵巢,用4%多聚甲醛溶液固定后进行石蜡包埋、切片(厚度为5 μm),然后进行H-E染色。在光镜下通过盲法观察自身免疫性卵巢炎程度并进行各级卵泡(原始卵泡、初级卵泡、次级卵泡、成熟卵泡)计数。
1.4 卵巢功能检测 第2次注射后2~6周,每天用细尖吸管收集小鼠阴道分泌物进行阴道涂片,通过亚甲蓝染色在相差显微镜下观察小鼠的发情周期。POI组和对照组各6只小鼠从眼球取外周血后,在4 ℃下以1 509×g离心10 min,分离血清。通过ELISA检测试剂盒(瑞士Roche公司)检测血清抗米勒管激素(anti-Müllerian hormone,AMH)水平,采用放射免疫试剂盒(北京北方生物技术研究所)检测血清FSH水平,采用化学发光免疫分析系统(德国Bayer公司)检测血清雌二醇水平。上述检测委托南方医科大学珠江医院检验科完成。
1.5 炎症因子测定 取POI及对照组剩余的各6只小鼠,取一侧卵巢在无菌条件下制成匀浆,用ELISA检测试剂盒(美国Life Technologies公司)检测卵巢组织中炎症因子γ-干扰素和IL-10水平。
1.6 脾脏Treg比例测定及分选 用含2% FBS的Hanks平衡盐溶液使脾脏破碎,通过筛网去除组织碎片,加入红细胞裂解液混匀后静置5 min,1 000×g离心5 min,弃上清,用PBS洗涤2次,再悬浮。细胞与荧光标记的抗小鼠CD4、CD25抗体及同型对照的小鼠IgG2a抗体(美国eBioscience公司)偶联30 min,用Fix&Cell Fix&Perm细胞固定透化试剂盒(美国Life Technologies公司)固定透化。然后用Fc受体阻断剂封闭细胞,再使用抗小鼠转录因子叉头框蛋白3抗体进行染色。最后用PBS洗涤2次,再悬浮后进行流式细胞术分析。将脾细胞悬液在4 ℃、168×g离心10 min,弃上清,取细胞沉淀悬浮于含2% FBS和1 mmol/L EDTA的PBS中。用EasySepTM小鼠CD4+CD25+Treg分离试剂盒Ⅱ(加拿大Stemcell Technologies公司)从脾细胞悬液中分离CD4+CD25+Treg。
1.7 外周血和卵巢组织miRNA-21的检测 取两组各12只小鼠的外周血,用红细胞裂解液(加拿大Cedarlane公司)去除红细胞,在室温下以241×g离心10 min,沉淀物用PBS洗涤2次,得到外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。通过锥虫蓝染液染PBMC,在明场显微镜(德国ZEISS公司)下观察PBMC活性 并 计 数。用TRIzol试 剂(美 国Invitrogen公司)分别提取小鼠PBMC和两组各12只小鼠另一侧卵巢组织的总RNA。引物由广州烨善生物科技有限公司合成。在ABI PRISM®7500型PCR检测系统上使用特异性引物进行qPCR扩增,PCR反 应 条 件:95 ℃ 5 min,95 ℃ 15 s、60 ℃32 s循 环40次。用 公 式2-ΔΔCt计 算Peli1mRNA相对表达量。小鼠PBMC中目的基因的检测以Cel-miRNA-39模拟物作为内参照,miRNA-21上游引物序列为5'-ACACTCCAGCTGGGTAGCTTATCAGACTGA-3',下游引物序列为5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCAACATC-3';Cel-miRNA-39模拟物上游引物序列为5'-GACTTCATCACCGGGTGTAAATC-3',下游引物序列为5'-TATCGTTGTTCTCCACTCCTTGAC-3'。小鼠卵巢组织中目的基因的检测以U6作为内参照,miRNA-21上游引物序列为5'-ACACTCCAGCTGGGTAGCTTATCAGACTGATG-3',下游引物序列为5'-CTCAACTGGTGTCGTGGA-3';U6上游引物序列为5'-CTCGCTTCGGCAGCACA-3',下游引物序列为5'-AACGCTTCACGAATTTGCGT-3'。
1.8 生物信息学分析 通过TargetScan 5.1(http://www.targetscan.org/)、miRecords(http://c1.accurascience.com/miRecords/)、mirDIP(http://ophid.utoronto.ca/mirDIP/)和miRanda(http://www.microrna.org/microrna/home.do)数 据 库 筛 选 出miRNA-21的靶基因。对4个数据库中共有的基因进一步通过查阅文献筛选。
1.9 外周血及脾脏Treg中Peli1的检测 采用TRIzol试剂(美国Invitrogen公司)分别提取小鼠PBMC和CD4+CD25+Treg的总RNA。以GAPDH作为内参照进行qPCR,反应条件和相对表达量的计算方法如1.7节所述。Peli1上游引物序列为5'-TGGTCCCTATGTCCCTCTGT-3',下游引物序列 为5'-TGCGTACCATGAGGAAGTG-3';GAPDH上游引物序列为5'-GGCCTCCAAGGAGTAAGAAA-3',下游引物序列为5'-GCCCCTCCTGTTATTATGG-3'。
1.10 统计学处理 应用SPSS 20.0软件进行统计学分析。计量资料均符合正态分布且方差齐,以±s表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结 果
2.1 小鼠一般状态 建模成功后,POI组小鼠表现为运动迟钝、毛发光泽减弱、摄食量减少等抑郁样行为,抓取时反抗不强烈;对照组小鼠仍保持行为活跃、摄食量正常,抓取时反抗强烈。
2.2 卵泡结构及卵泡计数 卵巢组织经H-E染色后在显微镜下观察到,POI组卵泡数量明显减少,未见成熟卵泡,黄体数量减少,卵巢间质成分增多;对照组小鼠卵巢结构规则,成熟卵泡和生长中卵泡数量较多,各级卵泡形态及数量正常,发育良好,可见黄体形成(图1)。POI组小鼠卵巢中原始卵泡、初级卵泡、次级卵泡和成熟卵泡的数量分别为2.67±1.37、1.25±0.62、1.42±0.90和0.83±0.72,分别少于对照组相应各级卵泡的数量(分别为5.58±1.44、2.75±0.97、3.92±1.00和2.58±1.00),差异均有统计学意义(P均<0.05)。
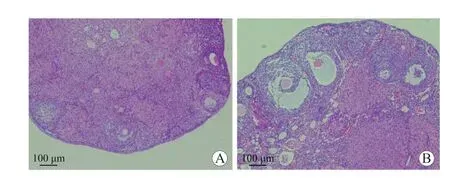
图1 小鼠卵巢苏木精-伊红染色光镜下观察结果
2.3 发情周期 第2次注射后4周,POI组6只小鼠发情期减少,阴道涂片结果提示无核角化上皮细胞减少,与有核上皮、白细胞并见。第2次注射后5周,POI组10只小鼠出现发情周期紊乱,发情间期延长。第2次注射后6周,POI组小鼠基本无发情期,仅为发情间期,阴道涂片结果提示偶尔见少量核上皮细胞,几乎全是白细胞。观察期间对照组小鼠发情周期均正常。
2.4 激素水平 POI组小鼠血清雌二醇、AMH水 平 均 低 于 对 照 组[(30.97±3.51)pg/mL vs(44.09±4.87)pg/mL、(4.17±0.52)ng/mL vs(7.87±0.91)ng/mL,P均<0.01],而POI组 小鼠血清FSH水平高于对照组[(4.59±0.81)IU/L vs(1.94±0.32)IU/L,P<0.01]。
2.5 炎症因子水平 POI组小鼠血清γ-干扰素水平高于对照组[(4.17±0.40)pg/mL vs(2.82±0.37)pg/mL,P<0.01],而血清IL-10水平低于对照组[(0.96±0.10)pg/mL vs(1.70±0.38)pg/mL,P<0.01]。
2.6 脾 脏Treg比 例 POI组 小 鼠 脾 脏Treg的 比例 为(4.82±0.58)%,低 于 对 照 组[(10.91±1.12)%,P<0.01]。
2.7 miRNA-21表 达 在 小 鼠PBMC中,POI组miRNA-21表达水平为0.63±0.09,低于对照组(0.99±0.03,P<0.01)。在小鼠卵巢组织中,POI组miRNA-21表达水平为0.54±0.06,也低于对照组(1.55±0.18,P<0.05)。
2.8 miRNA-21生物信息学分析 用TargetScan 5.1、miRecords、mirDIP和miRanda数据库分别筛选出382、25 422、3 345和3 561个miRNA-21靶基因,其中4个数据库共同筛选出的miRNA-21靶基因有244个。通过查阅相关文献发现Peli1对蛋白质进行泛素化修饰参与多种细胞生物学过程,包括程序性死亡、自噬的发生与调控,故确定Peli1为进一步研究的目标基因。
2.9Peli1mRNA表达 在小鼠PBMC中,POI组Peli1的mRNA表达水平为0.12±0.12,低于对照组(1.47±0.32,P<0.01)。在小鼠脾脏Treg中,POI组Peli1的mRNA表达水平为0.27±0.23,也低于对照组(1.19±0.35,P<0.05)。
3 讨 论
自身免疫性POI的发病率逐年上升,但其发病机制仍不明确,需进一步研究。POI研究进展较缓慢的一个重要原因是自身免疫性POI模型小鼠的构建方法没有统一标准。有研究者用ZP3多肽成功构建自身免疫性POI模型并使用该模型进行后续实验[12-13]。本研究通过ZP3多肽二次免疫构建POI模型小鼠,发现POI组小鼠的发情周期、卵巢结构、激素和炎症因子水平与对照组相比均发生改变,证明建模成功。
Treg是一类调控机体免疫功能的细胞群,以表达转录因子叉头框蛋白3、CD25、CD4为表型特征,能维持免疫系统对自身成分的耐受,使机体保持免疫稳态,在感染、肿瘤、免疫相关性疾病等方面具有抑制各种生理病理免疫应答的作用。Kobayashi等[9]研究发现,POI患者CD4+CD69+T细胞的数量增加,而Treg减少。本研究通过构建自身免疫性POI模型小鼠并测定Treg比例发现,POI组的Treg比例与对照组相比下降,说明Treg在自身免疫性POI中具有调节免疫、维持机体稳态的作用。
miRNA是一种在物种间高度保守的非编码小RNA,在代谢性疾病、癌症等中起关键作用。miRNA-21是最早鉴定出的哺乳动物miRNA之一,在免疫应答和炎症性疾病中起重要作用。在系统性红斑狼疮中,miRNA-21表达上调且可使淋巴细胞的数量减少[14]。miRNA-21也与子宫肌瘤、子宫内膜癌等妇科疾病相关[15-16]。本研究发现在自身免疫性POI模型小鼠中,外周血和卵巢组织中miRNA-21表达均下降,说明miRNA-21可能参与自身免疫性POI的发生和发展。
Peli1是一种泛素连接酶,与多种自身免疫病的发生和发展密切相关,其基因位于染色体2p13.3,长度为3 780 bp。在小鼠淋巴细胞浸润组织中,外来抗原激活T细胞膜上的T细胞受体,进一步刺激协同信号分子CD28,诱导Peli1表达增加[17]。针对系统性红斑狼疮的研究发现,Peli1调节Treg的活性,使滤泡性辅助性T细胞减少和Treg增加,并且Peli1mRNA水平与系统性红斑狼疮疾病活动指数呈负相关[18-19]。小胶质细胞对多发性硬化及动物模型实验性自身免疫性脑脊髓炎的发病至关重要。Xiao等[11]的研究结果表明,Peli1在小胶质细胞中大量表达,并在自身免疫性脑脊髓炎诱导过程中促进小胶质细胞趋化因子和促炎细胞因子的合成,从而促使T细胞募集到中枢神经系统。本研究通过4个预测miRNA靶基因的数据库进行预测并分析相关文献,筛选出Peli1基因,验证结果显示自身免疫性POI小鼠PBMC和脾脏Treg中Peli1的mRNA表达均低于对照组,初步证明了Peli1参与自身免疫性POI的发生和发展。
目前,miRNA-21与靶基因Peli1的关系和结合位点及Peli1如何调节Treg的比例和功能,从而参与自身免疫性POI发生和发展的具体机制尚未完全明确。miRNA-21与靶基因Peli1的关系及结合位点可通过双萤光素酶报告基因等实验验证。作为E3泛素化连接酶,Peli1能够介导靶蛋白泛素化,而泛素化是调节Treg活化的重要机制[20]。Peli1参与K48和K63泛素链的形成,在T细胞的增殖、活化中发挥作用。Peli1通过泛素化负性调节NF-κB通路激活并引起c-Rel蛋白的降解,导致c-Rel在细胞核内的表达下降,最终抑制滤泡性辅助性T细胞的增殖及淋巴细胞的过度活化。Liu等[21]研究表明,miRNA-155通过Peli1/c-Rel途径调节辅助性T细胞的数量和功能。Qiu等[6]研究也表明,miRNA-21通过Peli1/c-Rel途径促进致病性辅助性T细胞17的葡萄糖代谢,导致自身免疫病。
综上所述,在自身免疫性POI模型小鼠中,miRNA-21和其下游靶基因Peli1的表达降低,而Peli1通过调节Treg活性使Treg数量减少,表明miRNA-21和Peli1参与自身免疫性POI的发生和发展,这为自身免疫性POI的辅助诊断和治疗提供了可能的新靶点。
