自闭症谱系障碍人群词义加工的脑激活模式:基于fMRI研究的元分析
2022-11-15俞稼钰靳羽西梁丹丹
俞稼钰 靳羽西 梁丹丹,3
·元分析(Meta-Analysis)·
自闭症谱系障碍人群词义加工的脑激活模式:基于fMRI研究的元分析
俞稼钰1靳羽西2梁丹丹2,3
(1香港理工大学中文及双语学系, 香港 999077) (2南京师范大学文学院, 南京 210097) (3中国科学技术大学语言科学交叉研究中心, 合肥 230026)
本研究筛选了11项采用功能性磁共振成像技术探究言语自闭症人群词义加工的研究, 探讨了该人群与典型人群脑激活模式的差异是否具有跨研究的稳定性。结果表明, 差异的脑激活模式稳定存在, 且表现为主要涉及左额上回的典型脑区激活不足。该结果为言语ASD人群语言加工的神经机制提供了来自词义加工的跨研究激活证据, 在明确“减弱的额叶激活”这一稳定差异表现的基础上, 强调了针对不同语言加工任务开展元分析研究的必要性。
自闭症谱系障碍, 词义, fMRI, 元分析
1 引言
自闭症谱系障碍(Autism Spectrum Disorder, ASD)是一种神经发育障碍, 以社会交流和交往障碍、重复刻板行为和狭隘兴趣为特征(Diagnostic and statistical manual of mental disorders: DSM-5, 2013)。通常, ASD人群在语言习得方面会遇到一定困难。部分ASD个体终生无法发展出功能性语言(Tager-Flusberg et al., 2005), 能够发展出功能性语言的ASD个体(后称言语ASD)在语言习得过程中仍会表现出与典型发展人群(Typically developing, 简称TD)的差异, 例如, 与同龄人对话时不恰当地使用过于正式的词汇, 或在理解心理动词(如认为, 以为)等方面存在困难(Eigsti et al., 2011)。由于该人群在语言方面表现出持续的困难, 研究者们使用了如功能性磁共振成像(functional magnetic resonance imaging, fMRI)等脑成像技术探究ASD人群语言加工的神经机制, 试图在大脑的语言加工区域找到与该人群语言障碍相关的结构和功能标记(Harris et al., 2006)。
现有针对ASD人群语言加工神经机制的研究一致发现了加工语言刺激时, 该人群的脑激活模式与TD组存在差异, 但在具体差异表现上存在争议。Herringshaw等人(2016)总结了现有针对ASD人群语言障碍的大脑基础的三种假说, 并采用了元分析的方法探究了ASD人群完成语言加工任务时跨研究的大脑激活模式更支持哪一种假说。这些假说包括相反的语言网络功能偏侧化, 增强的视觉加工区域激活, 以及减弱的额叶激活伴随增强的颞叶激活。具体而言, 有研究指出在语言加工任务中, 与TD被试相反, ASD被试更多地激活右半脑相关脑区, 并据此假设了这一相反的语言脑区偏侧化可能是该人群语言加工表现出困难的原因(Kleinhans et al., 2008); 也有研究发现与TD对照组相比, ASD组在完成语言加工任务时, 更多激活了与视觉/视觉空间编码相关的脑区(如枕叶和顶叶), 并推测了该激活模式可能是该人群部分语言加工任务表现异常的大脑基础(Kana et al., 2006); 还有研究报告了ASD被试加工语言刺激过程中表现出了减弱的额叶激活伴随增强的颞叶激活(Harris et al., 2006)。以上单独研究可能由于任务类型、被试数量和分析方法等原因未获得一致结论, 而采用元分析方法对单独研究结果进行整合, 能够明确ASD人群加工语言刺激时跨研究一致激活的脑区。Herringshaw等人(2016)采用了激活似然性估计法(Activation Likelihood Estimation, ALE)探究了与TD人群相比, ASD人群加工语言刺激(词义, 句义, 韵律等)时一致的大脑激活差异模式。该研究结果发现以上的三种假说并没有哪一种得到所有语言加工任务的支持, 其中涉及视觉刺激加工和词汇理解的任务支持了相反的偏侧化假说, 涉及视觉刺激加工和句子加工的任务支持了增强的视觉加工区域激活假说, 而减弱的额叶激活伴随增强的颞叶激活则未能够获得该元分析结果的支持。这一结果暗示了完成不同语言加工任务时, ASD人群与TD人群的差异激活模式可能不同, 需要区别不同类别的语言加工任务开展分析。
通常认为, 言语ASD人群语言能力核心损伤在语义−语用方面(Tager-Flusberg, 1985)。Kanner (1943)最初描述自闭症时提及, “给一个词项赋予多个意义的困难”是该人群较为显著的语言能力损伤, 且他们在习得和利用语义范畴知识方面也存在困难。Phan等人(2021)同样采用了ALE分析法探究了ASD人群加工语义过程中大脑激活模式与TD人群的异同。该研究发现, 与TD组相比, ASD组额外激活了涉及左颞中回和左颞上回的部分脑区; 与ASD组相比, TD组额外激活了涉及左额上回的部分脑区。尽管该研究未明确表示他们的研究结果支持了ASD人群语言加工“减弱的额叶激活伴随增强的颞叶激活”的假说, 但他们的发现符合该假说的描述。这一元分析结果与Herringshaw等人(2016)的发现存在差异。尽管Phan等人(2021)已将范围缩小到语义加工, 但该研究同时包括了句层面和词层面的语义加工研究。考虑到词义加工和句义加工的底层机制存在差异, 与词义加工相比, 句义加工包括了词义整合、句法加工等额外要求, 且Herringshaw等人(2016)发现句义加工和词义加工的整合分析结果支持了不同的差异激活模式, 因此需要进一步区分句层面和词层面的语义加工, 开展对应的元分析研究。
由于词义加工能力在语言习得和发展过程中的首要和基础地位, 多年来, 学者们对ASD人群的词义加工开展了行为、神经等丰富多样的研究, 不断加深对该人群的词义加工能力的认识。在行为层面, 现有研究结果表明加工词义时, 言语ASD人群表现为能力与损伤并存。曹漱芹和方俊明(2008)报告了言语ASD人群拥有一般词义加工能力, 在Stroop任务, 普通名词的语义范畴判断任务和语义启动任务中与TD人群表现类似(Eskes et al., 1990; Tager-Flusberg, 1985; Toichi & Kamio, 2001)。然而, 也有研究报告了言语ASD人群的词义加工能力存在损伤。黄静和梁丹丹(2013)的综述研究报告了在语言回忆任务中, 从儿童至成人, ASD被试回忆语义相关词的数量显著少于典型发展对照组(Bowler et al., 2000; López & Leekam, 2003; Smith et al., 2007; Tager‐Flusberg, 1991),且语义聚合程度显著较低(Cheung et al., 2010; Gaigg et al., 2008)。此外, 在词汇流畅性任务中, ASD被试会产出远离范畴原型的词和不属于目标类别的词(Dunn et al., 1996)。在无分类规则的词汇分类任务中, ASD被试也表现出了一定的困难(Minshew et al., 2002)。在神经层面, Harris等人(2006)发现一组ASD成人在完成词义加工任务时, 较少激活布洛卡区, 但相对较多地激活了颞中回。也有一系列研究发现了ASD被试加工词义时, 涉及左额下回的激活与TD被试无显著差异, 但表现出了涉及右纹外视觉皮层(right extrastriate visual cortex)的广泛激活(Gaffrey et al., 2007; Shen et al., 2012)。这些研究都一致表明了在完成词义加工任务时, ASD被试与TD被试在大脑激活模式方面存在差异, 但可能由于被试、实验任务、分析方法等因素在具体差异模式方面存在不同。然而, 目前尚未有研究采用元分析的方法, 探究ASD人群完成词义加工任务时跨研究的脑激活模式。
总而言之, 已有研究在行为层面总结了言语ASD人群能够加工部分词的基础语义, 拥有一定的词义加工能力, 但他们对词与词之间的意义联系并不敏感, 词汇组织方式与TD人群存在差异(Naigles & Tek, 2017), 因而在复杂或内隐的词义加工任务中的表现与TD组存在差异(宋宜琪, 靳羽西, 2018)。在神经层面, 单独研究结果一致发现言语ASD人群加工词义时的大脑活模式与TD人群存在差异, 但在具体差异表现上未达成一致, 也尚不明确该人群加工词义时的大脑激活模式差异是否具有跨研究的稳定性。此外, 针对语言加工和语义加工开展的元分析结果暗示了单独对言语ASD人群加工词义时的脑激活模式开展元分析研究的必要性。因此, 本研究将聚焦于言语ASD人群加工词层面语义时的大脑激活模式, 筛选采用fMRI技术的研究结果, 运用ALE分析法, 探究ASD人群与TD人群加工词义时的脑激活模式差异是否具有跨研究的稳定性; 若差异模式稳定存在, 具体表现如何?
2 方法
2.1 文献检索
文献检索分为英文文献和中文文献两个部分。英文文献检索在Pubmed和PsycINFO数据库进行, 采用以下关键词:(‘fMRI’ OR ‘functional MRI’ OR ‘functional magnetic resonance’ OR ‘neuroimaging’) AND (‘semantic processing’ OR ‘lexical processing’ OR ‘word processing’) AND (‘ASD’ OR ‘autism’ OR ‘autism spectrum disorder’)。由于发表在中文期刊上的探究ASD人群语言加工的fMRI研究有限, 中文文献检索的关键词与英文文献检索略有差异。中文文献检索使用中国知网学术期刊网络出版总库, 将文献来源限制为:北大核心, CSSCI和CSCD, 并采用以下关键词:“语义”和“自闭症/孤独症”或“fMRI”和“自闭症/孤独症”。
2.2 文献的纳入与排除
检索获得的文献需要满足以下纳入标准:(1)期刊论文; (2)被试为获得ASD诊断的儿童, 青少年和成人; (3)设置典型发展对照组; (4)被试在fMRI扫描期间完成词层面的语义加工任务; (5)报告了峰值激活坐标; (6)坐标体系为MNI或Talairach; (7)分别报告TD被试和ASD被试加工词义时的脑激活情况。
本文的第一作者和第二作者依据上述纳入和排除标准在标题、摘要和全文三个方面依据上述标准进行独立筛查, 最后确定纳入本次元分析的文献数量为11篇。图1展示了文献检索完成后的筛选流程。
2.3 激活似然性估计法
本研究使用GingerALE 3.0.2软件(http:// brainmap.org/ale/)在标准MNI空间下, 依据文献报告的激活峰值点(foci)开展ALE分析。ALE分析方法将先分别计算每个实验中某种条件下全脑范围内每个体素(voxel)的激活可能性, 然后检验体素跨实验激活的稳定性(胡传鹏等, 2015)。本研究中首先对文献中提取的TD组和ASD组分别开展ALE分析, 参数设置如下:Cluster-level FWE = 0.05, Threshold Permutations = 1000,value = 0.001。随后, 进行TD组和ASD组的联合分析(conjunction analysis)和差异分析(TD组–ASD组/ ASD组–TD组)。
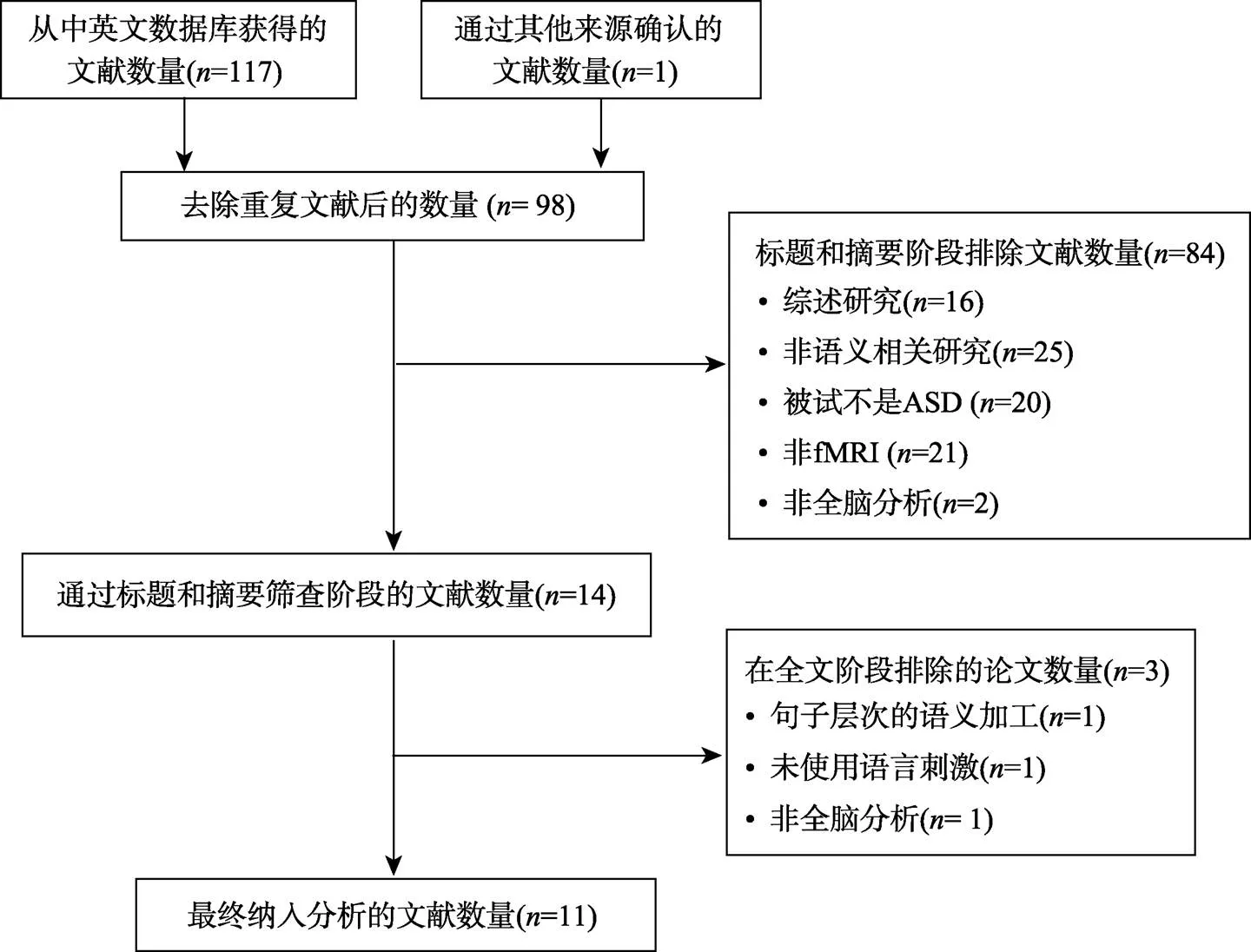
图1 文献筛选流程图
3 结果
3.1 定性分析
259名8~50岁的TD被试和241名8~52岁的ASD被试被纳入到当前的分析中。表1列出了11项研究中纳入最终分析的被试基本信息。假设本元分析应具有中等效应量0.5, 大异质性3, 且已知每项研究的每个被试组别组的平均人数为22.7,效应量数量为11, 获得本元分析的统计效力为0.78。
以平均年龄18岁为界限, 11篇研究中有5篇研究探究了成人组的词义加工(Gaffrey et al., 2007; Harris et al., 2006; Kana et al., 2017; Kleinhans et al., 2008; Shen et al., 2012), 有6篇研究探究了儿童及青少年的词义加工(Bednarz et al., 2017; Chen et al., 2016; Fan et al., 2021; Knaus et al., 2017; Knaus et al., 2008; Wong et al., 2019)。在ASD诊断方面, 7篇研究依据DSM-4诊断标准(Chen et al., 2016; Gaffrey et al., 2007; Harris et al., 2006; Kleinhans et al., 2008; Knaus et al., 2017; Knaus et al., 2008; Shen et al., 2012), 1篇研究依据DSM-4招募被试但依据DSM-5进行再确认(Wong et al., 2019), 1篇研究依据DSM-5诊断标准(Fan et al., 2021), 2篇研究未说明诊断标准仅提供了使用的诊断工具(Bednarz et al., 2017; Kana et al., 2017)。尽管诊断标准存在差异, 但纳入研究的障碍组被试均符合自闭症谱系障碍诊断。
表2报告了进入元分析的11项研究的具体信息。其中8篇研究的实验材料源于英语(Bednarz et al., 2017; Gaffrey et al., 2007; Harris et al., 2006; Kana et al., 2017; Kleinhans et al., 2008; Knaus et al., 2017; Knaus et al., 2008; Shen et al., 2012)。其余3篇研究的实验材料源于汉语(Chen et al., 2016; Fan et al., 2021; Wong et al., 2019)。纳入最终分析的研究大致采用了以下4种语义加工任务, 要求被试判断词所属的语义类别(Gaffrey et al., 2007; Kleinhans et al., 2008; Shen et al., 2012), 判断词是否具有某种语义特征(Harris et al., 2006; Kana et al., 2017; Knaus et al., 2008), 判断词与词之间的语义关系(Chen et al., 2016; Fan et al., 2021; Wong et al., 2019), 以及同时要求被试判断语义关系和类别(Bednarz et al., 2017)。
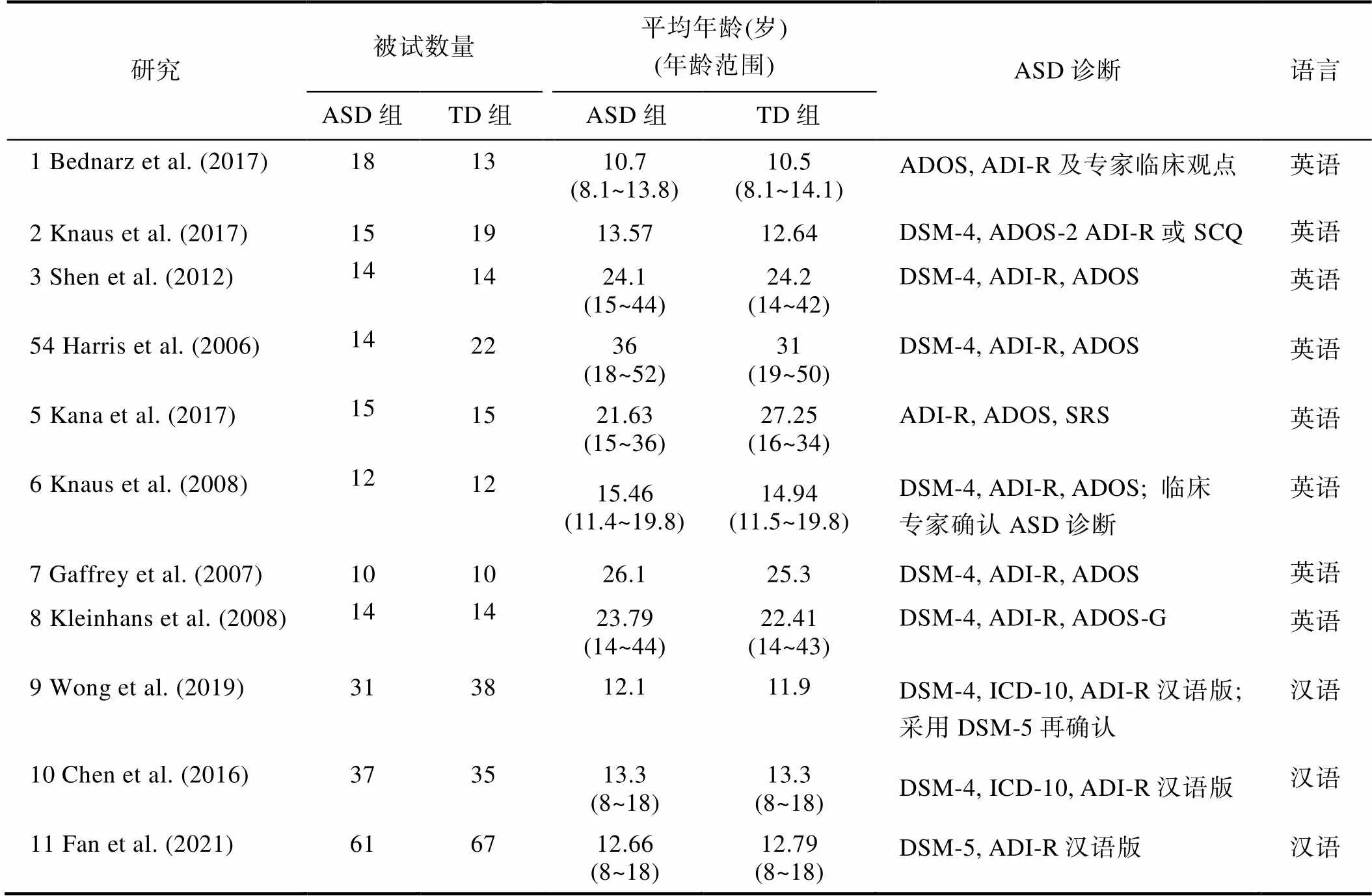
表1 纳入分析被试的基本信息
注:ADOS: Autism Diagnostic Observation Schedule; ADI-R: Autism Diagnostic Interview-Revised; DSM-4: Diagnostic and statistical manual of mental disorders, 4thEdition; ADOS-2: Autism Diagnostic Observation Schedule-2ndEdition; SCQ: Social Communication Questionnaire; SRS: Social Responsiveness Scale; ADOS-G: Autism Diagnostic Observation Schedule-General; ICD-10: International Statistical Classification of Disease and Related Health Problems-10.
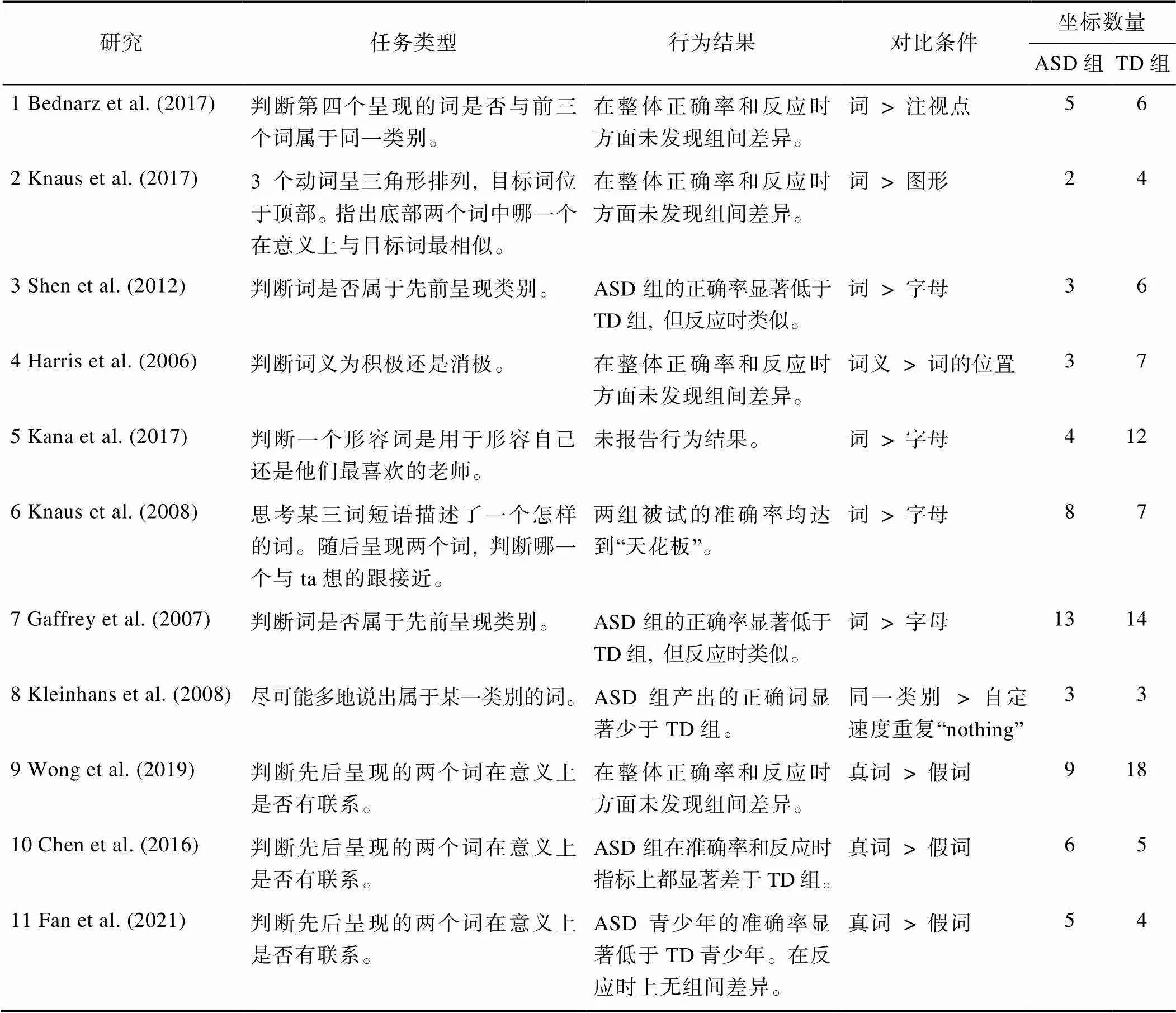
表2 纳入元分析研究的简要总结
3.2 ALE元分析结果
表3报告了ALE元分析结果和激活簇的相关信息。使用Mango 4.1(http:// ii.uthscsa.edu/mango/ mango.html)呈现结果图像。图2呈现了ALE元分析中激活簇的分布。
来自11项词义加工研究中的259名TD被试的元分析结果显示出4个激活簇。最大的激活簇位于左额叶(Left Frontal Lobe), 由97.5%的额下回(Inferior Frontal Gyrus)和2.5%的腹前回(Precentral Gyrus)组成。第二个激活簇大部分位于左脑(97%), 小部分位于右脑(3%), 由96.4%的额叶和3.6%的边缘叶(Limbic Lobe)构成, 其中额上回(Superior Frontal Gyrus)为68.3%, 额内回(Medial Frontal Gyrus)为28.1%, 扣带回(Cingulate Gyrus)为3.6%。第三个激活簇位于左脑颞中回(Left Middle Temporal Gyrus)。第四个激活簇位于左额叶,由54.2%的额中回(Middle Frontal Gyrus)和45.8%的额下回构成。来自241名ASD被试的元分析结果显示出3个激活簇。最大的激活簇位于左脑额叶, 其中额下回为86.2%, 额中回为13.8%。第二个激活簇位于左脑颞中回。第三个激活簇位于左脑额叶,由88.4%的额内回和11.6%的额上回构成。
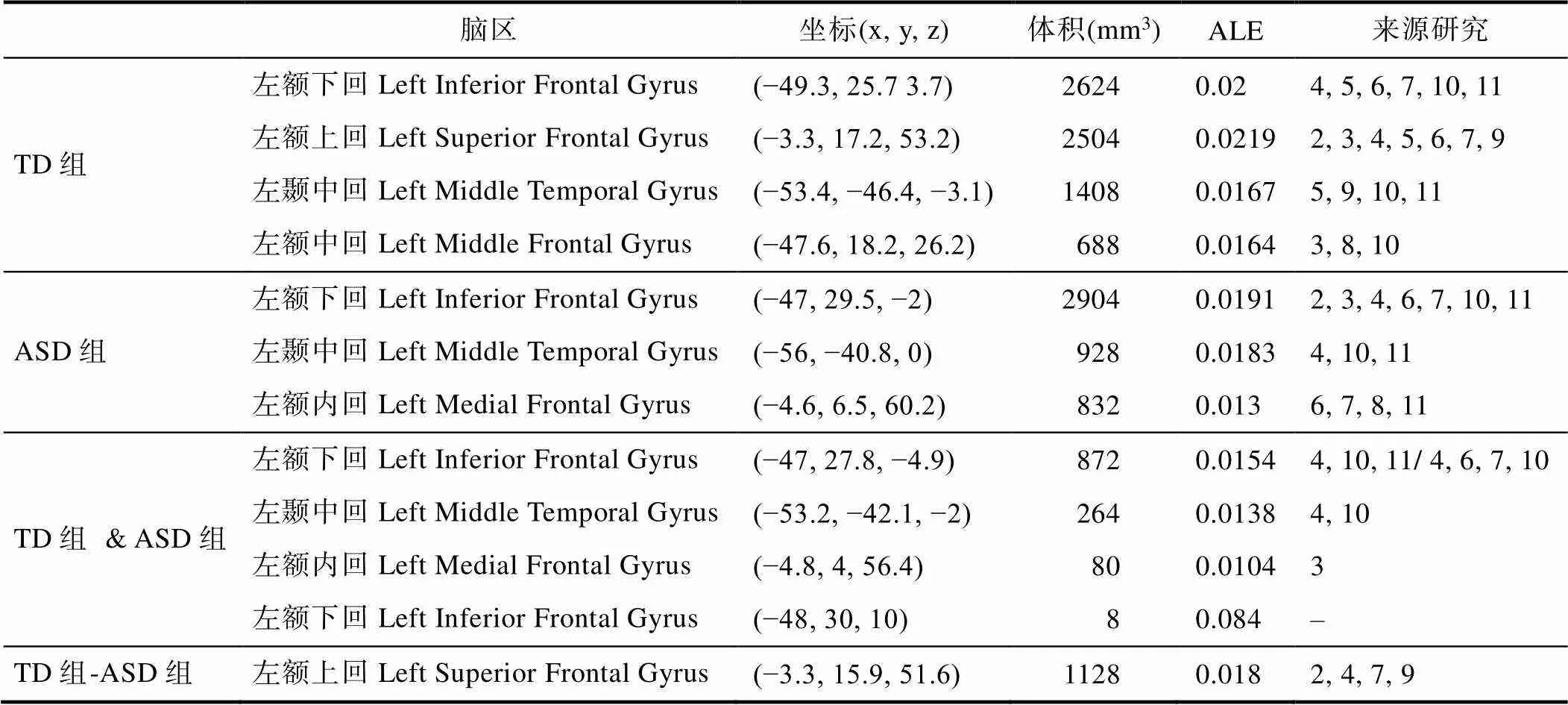
表3 所有纳入研究的ALE分析结果
注:(1)脑区呈现激活簇主要涉及的脑区(2)坐标为激活簇中心坐标; (3)ALE值为在该脑区内的最大激活似然值, 代表该脑区的激活概率; (4)TD组 & ASD组为联合分析结果, TD组–ASD组为差异分析结果。
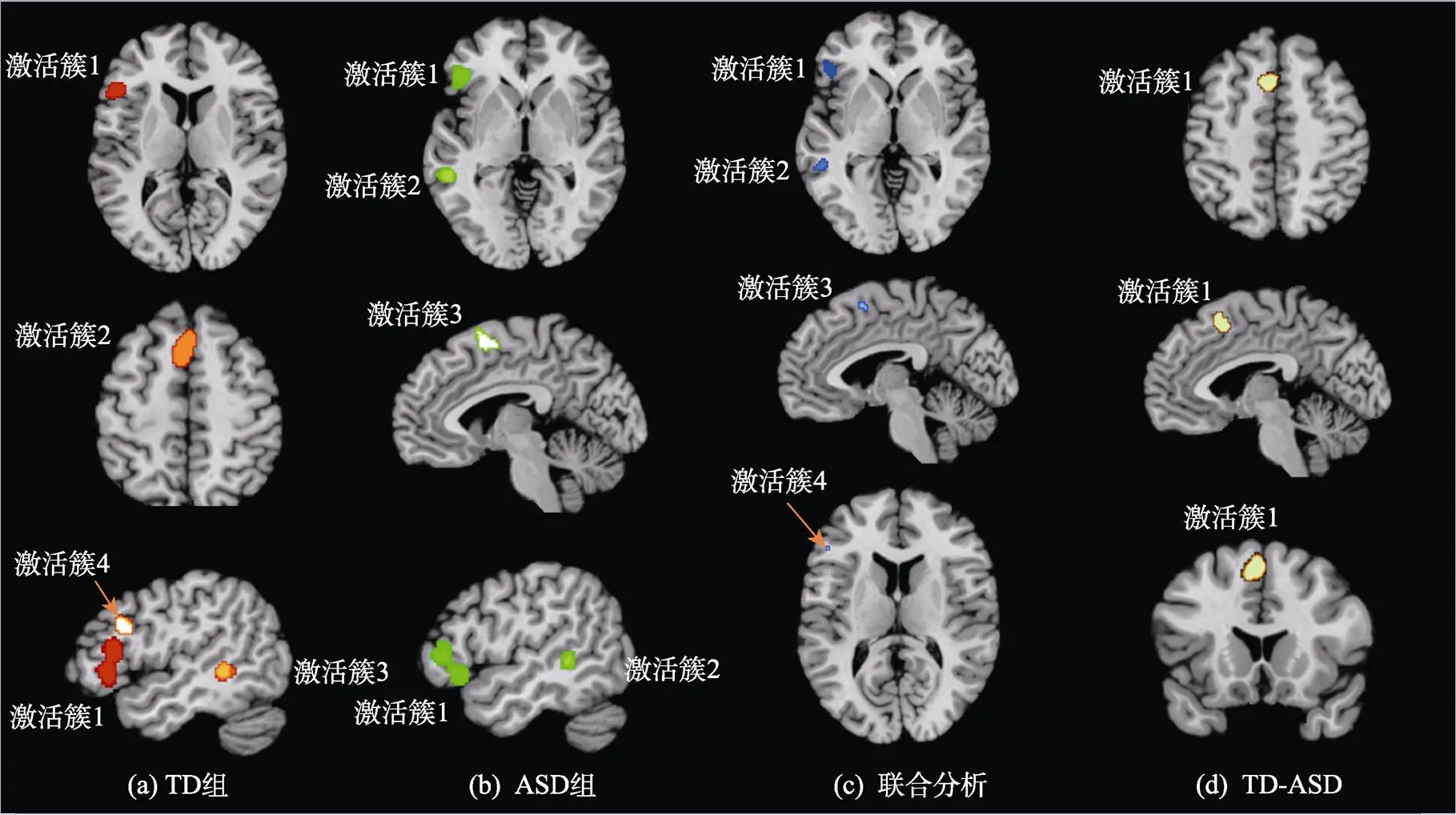
图2 ALE分析结果
TD组和ASD组的联合分析结果发现4个激活簇, 分布于左额下回, 左颞中回, 左额内回和左额下回。差异分析结果显示ASD组-TD组对比未发现激活簇, 而TD组-ASD组的对比则发现了一个激活簇。该激活簇大部分位于左脑(98.8%), 小部分位于右脑(1.2%), 92.9%位于额叶, 7.1%位于边缘叶, 其中额上回为63.5%, 额内回为29.4%, 扣带回为7.1%。
3.3 Neurosynth分析结果
通过Neurosynth (https://neurosynth.org/), 这一利用文本挖掘进行在线自动元分析工具(胡传鹏等, 2015), 本研究将TD组和ASD组ALE元分析结果与Neurosynth数据库中已发表的神经影像学论文中关键词进行比对。表4报告了在本元分析中ASD被试和TD被试词义加工图与Neurosynth的语义加工图(semantic processing map, 源于1031篇研究)比较后得到的前5个相关度最高的关键词。之所以选择“semantic processing map”, 首先是因为组成该图的来源文章数量较多, 更为可靠; 其次是因为有相当数量研究并没有特意区分“semantic processing”和“lexical processing”, 若将关键词选定为“lexical processing”可能错失部分研究。
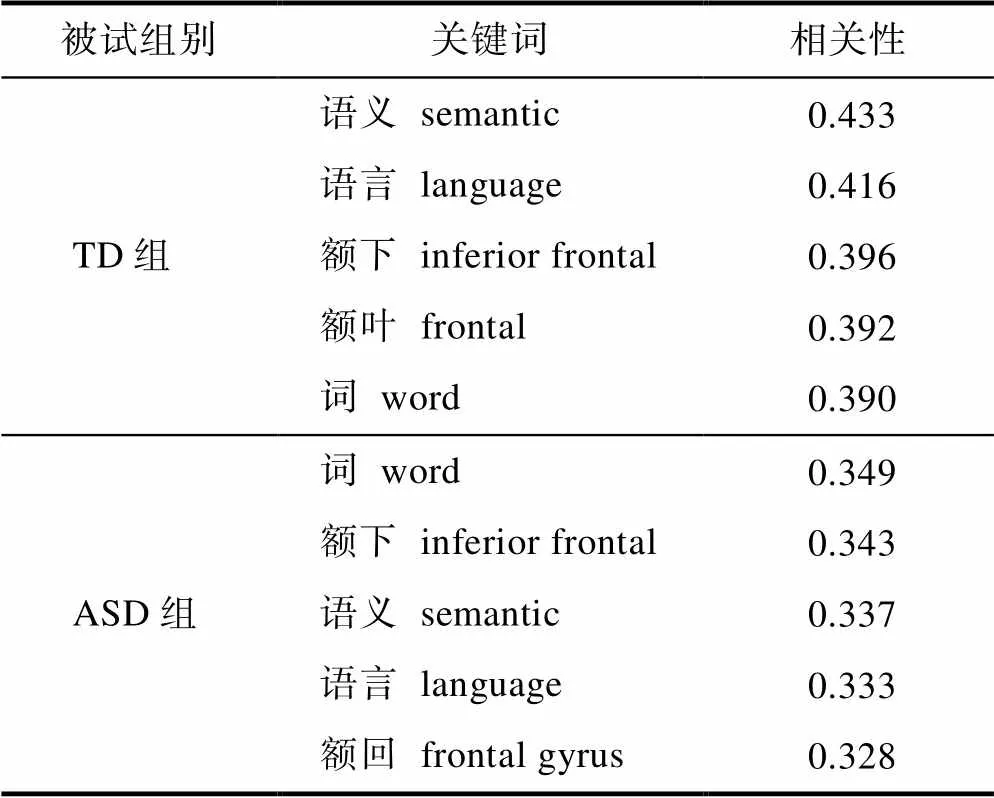
表4 Neurosynth分析结果
关键词对比分析表明, 对TD组而言, 相关度最高的5个词是“语义”、“语言”、“额下”、“额叶”和“词”。这表明本研究中汇集的TD对照组的3个激活簇涉及的脑区与“语义”、“语言”和“词”等关键词相关度较高, 在加工词义时表现出的跨研究激活脑区与大量探究语义加工的神经机制的前人研究结果一致。Neurosynth报告的5个相关度最高的ASD组的关键词为“词”、“额下”、“语义”、“语言”和“额回”。这同样表明本研究中汇集的ASD组的三个激活簇涉及的脑区与“词”、“语义”和“语言”等关键词高度相关, ASD组在加工词义时表现出的跨研究激活的脑区与探究语义加工的神经机制的前人研究有一致之处。
将本研究中TD组和ASD组的语义加工激活脑区图与Neurosynth中语义加工脑区图进行对比, 结果表明Neurosynth的语义加工图与本元分析中TD被试的词义加工图之间的重叠体素大小为3541, 约有48.7%的体素处于语义加工网络。而与ASD被试的词义加工图的重叠体素大小为887, 约有21.5%的体素处于语义加工网络。
3.4 探索性亚组分析
本研究对成人组和儿童及青少年组进行了探索性亚组分析。ALE分析结果表明, 来自5项研究的75名成人TD组有3个激活簇:最大的激活簇位于左额叶, 由77.2%的额上回和22.8%的额内回组成; 第二和第三个激活簇均位于左额下回。来自67名成人ASD组的元分析显示出2个激活簇:第一个激活簇位于左额下回; 第二个激活簇位于右枕叶(Right Occipital lobe), 其中60.6%位于楔叶(Cuneus), 39.4%位于舌回(Lingual Gyrus)。联合分析结果发现1个激活簇, 位于左额下回。差异分析则未发现激活簇。来自6项研究的184名儿童及青少年TD组的元分析结果显示出1个激活簇, 位于左颞中回。来自174名儿童及青少年ASD组的元分析结果显示出1个激活簇, 位于左额下回。联合分析结果未发现激活簇。差异分析结果表明, ASD组-TD组的对比未发现激活簇, 而TD组-ASD组的对比则发现了一个位于左颞中回的激活簇。
此外, 本研究对英语研究也开展了探索性亚组分析。来自8项研究中的119名英语TD组的元分析结果显示出2个激活簇:最大的激活簇位于左额叶, 由79.2%的额上回和27.8%的额内回组成; 第二个激活簇位于左额下回。112名英语ASD组的元分析显示出三个激活簇:最大的激活簇位于左额下回; 第二个激活簇位于左额内回; 第三个激活簇位于左额叶, 其中额下回为67.7%, 额中回为13.8%。联合分析结果发现2个激活簇:第一个位于左额内回, 第二个位于左额下回。差异分析结果表明, ASD组-TD组的对比未发现激活簇, 而TD组-ASD组的对比则发现了一个激活簇。该激活簇位于左额叶, 其中额上回为82.9%, 额内回为17.1%。
4 讨论
4.1 ASD人群和TD人群加工词义时跨研究的大脑激活模式及异同
本研究筛选了11项fMRI研究的结果, 探究了完成词义加工任务时, 言语ASD人群跨研究稳定激活脑区与TD人群的异同之处。ALE分析结果首先揭示了259名TD被试和241名ASD被试加工词义时跨研究稳定激活的具体脑区, 联合分析结果体现出TD人群和ASD人群共同激活的脑区, 而差异分析结果则体现出两组被试跨研究稳定激活脑区的不同之处。Neurosynth分析结果则体现了大量前人研究汇集而成的语义加工图与本研究汇集而成的TD组和ASD组的词义加工图之间关系。
首先, 针对TD组开展的ALE元分析结果显示, 最大的激活簇主要位于左额下回和腹前回。左额下回是与语义加工密切相关的典型脑区(Bookheimer, 2002; Poldrack et al., 1999)。元分析研究(Herringshaw et al., 2016; Phan et al., 2021)和综述研究(Price, 2012)都报告了在完成多种语义加工任务时, TD人群均在左额下回表现出激活。左侧腹前回则会在涉及阅读词汇的任务中表现出激活(Price, 2012)。TD组的第二个激活簇涉及脑区大部分位于左脑, 小部分位于右脑; 以额叶为主, 小部分涉及边缘叶; 额上回占比最大, 其次为额内回和扣带回。额上回与完成任务所需要的工作记忆密切相关(Leung et al., 2002; Petrides, 2005)。也有相当研究报告了在加工视觉呈现的词的意义时, 额上回会表现出激活(Price, 2012)。额内回包括前运动辅助区和运动辅助区, 与完成任务的领域一般认知能力有紧密联系(Scheller et al., 2013), 例如抉择能力(Nachev et al., 2007)。Price (2012)的综述提及了早期研究发现词语生成过程(word generalization)也与额内回有关(Buckner et al., 1995)。TD组的第二个激活簇有小部分位于扣带回的前部(Brodmann area 24)。该区域与词汇提取过程中抑制无关词的产出有关(Barch et al., 2000; Price, 2012)。TD组的第三个激活簇位于左颞中回。该脑区主要在获取语义和判断语义联系时表现出激活(Price, 2012), 同样在语言加工和语义加工的元分析结果中也有体现(Herringshaw et al., 2016; Phan et al., 2021)。TD组的第四个激活簇涉及左额中回和左额下回。前人研究总结发现左额中回会在涉及词汇提取(word retrieval)的语言产出任务中表现出激活(Price, 2010), 也会在词汇阅读任务中表现出激活(Cutting et al., 2006)。整体而言, ALE分析结果表明了TD组跨研究激活的4个激活簇所涉及的脑区均与加工以视觉方式呈现的词的意义紧密关联。Neurosynth分析结果表明本元分析的TD词义加工图与“语义”、“语言”、“词”和“词汇”关联度较高。该结果同样表明了本元分析中TD被试完成词义加工任务时表现出跨研究稳定激活的脑区与加工语义, 加工语言和加工词关系密切。
针对ASD组开展的ALE分析结果显示, 最大的激活簇位于左额叶, 主要涉及额下回和额中回。ASD组跨研究激活的第二大激活簇位于左颞中回。ASD组的第三个激活簇主要涉及左额内回和左额上回。以上脑区激活在TD组也有体现, 均与加工词义密切相关。该结果表明ASD组完成词义加工任务时, 跨研究稳定激活的脑区均为属于负责完成语言加工任务的典型脑区。Neurosynth分析结果表明本元分析的ASD词义加工图与“词”、“语义”和“语言”关联度较高, 同样表明了纳入元分析的ASD被试在加工词义时跨研究稳定激活的脑区与词加工, 语义加工或语言加工有较高相关度。
TD组和ASD组的ALE联合分析结果能够表明ASD组和TD组在加工词层面语义时大脑激活模式的相同之处。联合分析结果发现了4个激活簇, 主要涉及以下三个部分:左额下回, 左颞中回和左额内回。如上文所言, 这三个部分都负责完成词义加工任务。该联合分析结果进一步表明了ASD人群完成词义加工任务过程中, 跨研究稳定激活了与TD人群类似的脑区。
ASD人群与TD人群加工词义时跨研究激活脑区的差异主要由ALE差异分析结果体现。在ASD组-TD组的对比中未发现激活簇, 这表明, 与TD人群相比, ASD人群未有涉及其他脑区激活。与之相对, 在TD组-ASD组的对比中, 则发现了一个激活簇。该结果表明了TD人群加工词义过程中跨研究稳定激活的部分区域在ASD人群加工词义时未被激活。该激活簇大部分位于左脑, 小部分位于右脑, 涉及了额上回, 额内回和扣带回。正如上文所言, 这些脑区都与完成词义加工任务密切相关。尽管ASD组的ALE分析结果也显示了涉及左额上回和左额内回的跨研究稳定激活, 但差异分析结果表明了与TD组相比, ASD组在涉及左额上回和左额内回的脑区可能存在激活不足。除此之外, 与TD组相比, ASD组未发现涉及扣带回的激活, 这暗示了该人群在完成语义加工任务的过程中, 在抑制无关词的产出方面可能存在困难。结合该激活簇的来源研究, 可以发现尽管在多数情况下ASD被试并没有在准确率和反应时上表现出明显的困难, 但在一项词类判断任务中表现出了更多错误(Gaffrey et al., 2007)。据此, 我们推测, 言语ASD人群在完成部分词义加工任务时, 很有可能在抑制无关词的干扰方面存在一定困难。差异分析结果显示了TD组跨研究激活的脑区比ASD组跨研究激活的脑区在左额叶有更广的分布。这意味着, 加工词义时, 尽管ASD组跨研究稳定激活的脑区涉及左额上回和左额中回, 但与TD组相比, 存在激活不足的情况。总体来看, 差异结果表明了与TD组相比, ASD组主要表现出了涉及左额叶的激活不足。来自Neurosynth的分析结果发现ASD组与Neurosynth语义加工图重叠的体素大小约为TD组与Neurosynth语义加工图重叠体素大小的一半。该结果同样为ASD组词义加工过程中典型脑区激活不足提供了证据。
简要总结, 对言语ASD人群加工词义时跨研究稳定激活的脑区进行分析后, 本研究发现虽然ASD人群确实激活了左额下回, 左颞中回, 左额内回等与完成语言加工任务相关的典型脑区, 但与TD人群相比, 差异的脑激活表现稳定存在, 具体表现为主要涉及左额叶的典型脑区激活不足。该结果与前人元分析结果存在一致之处。Herringshaw等人(2016)发现ASD组完成语言加工任务时激活了颞上回, 额下回等与语言加工相关的脑区, 且与TD组跨研究稳定激活的脑区存在重合。类似的, 本元分析的结果也发现了ASD被试加工词义时激活了负责语言加工的典型脑区。在差异激活模式方面, Herringshaw等人(2016)的发现与本研究结果存在了较大差异。概括而言, 与ASD组相比, TD组额外激活了双侧颞中回, 左颞上回, 梭状回等脑区; 与TD组相比, ASD组额外激活了左舌回, 左额中回, 右颞上回等脑区。但Herringshaw等人(2016)包括了多种语言加工任务, 且研究结果表明了针对不同种类的语言加工任务开展对应的元分析研究的必要性, 因此, 与本研究发现存在差异并不意外。Phan等人(2021)研究主题与本研究联系紧密, 但在纳入研究, 分析方法和结果方面均存在差异。纳入研究方面, Phan等人分析了来自11篇期刊论文的200名TD儿童和195名ASD儿童完成语义加工任务的表现, 其中有9篇文章涉及单独的词义加工, 2篇文章涉及句子加工(Just et al., 2004; Tesink et al., 2011)。本研究纳入了11篇期刊论文, 分析了259名TD被试和241名ASD被试完成词义加工任务的表现。由于针对ASD人群词义加工的fMRI研究仍在发展阶段, 本元分析纳入的论文和Phan等人(2021)纳入的论文在涉及词义加工研究上存在重合。但本元分析更集中于ASD人群词义加工这一主题, 因此排除了涉及句子加工的研究, 并在检索过程中发现了其他符合本研究要求的文章, 包括了更多TD被试和ASD被试的数据。分析方法方面, Phan等人(2021)仅采用了ALE分析法, 而本研究还采用了Neurosynth分析了TD组和ASD组的ALE结果, 提高了对ALE分析结果解读的可靠性。结果方面, 本研究结果在一定程度上与Phan等人的研究结果一致, 主要体现在ASD组的ALE分析结果上。本研究和Phan等人的研究都发现了ASD被试涉及左额上回, 左额下回, 左额内回和左颞中回的激活。这一类似发现进一步表明了ASD人群在加工词义过程中确实激活了相关的典型脑区。在差异分析结果方面, Phan等人研究结果与本研究结果存在较大差异。首先, Phan等人发现与TD组相比, ASD组表现出了涉及左颞中回和左颞上回的激活, 而本研究未发现与TD组相比, ASD组有涉及其他脑区的激活。其次, Phan等人发现与ASD组相比, TD组表现出了涉及左额上回的激活, 而本研究结果则发现了与ASD组相比, TD组表现出了涉及更多额上回和额内回的激活。尽管Phan等人未明确表示他们的研究结果支持了ASD人群语言加工“减弱的额叶激活伴随增强的颞叶激活”的假说, 但他们的发现符合该假说的描述。然而, 本研究结果仅部分支持了该假说, 发现了ASD人群词义加工过程中表现出了稳定的“减弱的额叶激活”, 而并未发ASD人群在加工词义过程中激活了其他脑区。我们推测, 该差异产生的原因, 可能就是Phan等人的元分析纳入了与句义加工相关的研究。Just等人(2004)就发现了在完成句子加工过程中, 与TD对照组相比, ASD人群就表现出了涉及韦尼克区(左颞上区)的较强激活和布洛卡区的较弱激活(左额下回)。因此, 本研究发现的主要涉及左额叶的较弱激活, 对应于言语ASD人群词义加工, 支持“减弱的额叶激活伴随增强的颞叶激活”中“减弱的额叶激活”部分。本研究结果与针对语言加工和语义加工任务开展的元分析发现都存在一定程度的差异, 表明不同类型的语言加工任务中, 言语ASD人群表现出的差异激活模式不同。区分不同类别, 不同层次语言加工的元分析研究更有可能帮助研究者们确定ASD人群某类语言障碍的神经结构标记物。
本研究对成人组, 儿童及青少组和英语组分别开展了探索性亚组分析。针对成人组开始的探索性分析结果表明, TD成人激活了左额上回, 左额内回和左额下回等负责完成词义加工任务的典型脑区。除了左额下回这一典型脑区, ASD成人还激活了右楔叶和右舌回, 这两个与视觉加工密切相关的区域(Gaffrey et al., 2007; Shen et al., 2012)。尽管针对成人组开展的联合分析和差异分析的结果都未能发现激活簇, 但单独分析结果暗示了ASD成人加工词义时可能会更依赖视觉加工区域。儿童及青少年组的探索性分析结果表明, TD组的一个激活簇位于左颞中回, ASD组的一个激活簇位于左额下回。差异分析表明, TD组-ASD组的对比中发现一个位于左颞中回的激活簇。该结果表明在儿童和青少年组中, ASD被试表现出了涉及左颞中回的激活不足。针对不同年龄阶段开展的探索性亚组分析结果表明, 加工词义时跨研究的大脑激活模式可能存在发展性的差异, ASD成人更可能表现出“增强的视觉加工区域激活”, ASD儿童和青少年则表现出了涉及左颞中回的激活不足。针对英语被试开展的探索性亚组分析结果表明, 英语TD和ASD被试均稳定激活了左额上回, 左额内回和左额下回等典型脑区。差异分析结果表明, TD组-ASD组的对比中发现的一个激活簇涉及左额上回和左额内回。该结果表明英语ASD被试加工词义时表现出主要涉及左额叶的激活不足, 与本元分析的主要发现一致。
结合行为层面综述研究的发现(曹漱芹, 方俊明, 2008; 宋宜琪, 靳羽西, 2018), 以及纳入研究中ASD被试在部分词义加工任务中的表现与TD被试无显著差异, 本研究认为元分析的发现与行为研究的结果在某种程度上相互印证, 即在行为层面, ASD人群拥有一定的词汇语义能力, 但词汇组织方式异常, 在部分词义加工任务中表现出困难; 在神经层面, ASD人群加工词义时激活了负责语义加工的典型脑区, 但表现出了激活不足。然而, 由于本研究并未区别ASD人群表现出困难的词义加工任务和表现较好的词义加工任务, 仅是推测本元分析的结果在一定程度上能够解释ASD人群词义加工能力与障碍并存的面貌。同时, 由于纳入研究的ASD被试以青少年和成人为主, 普遍具有一定的语言能力, 我们推测这一稳定的词义加工差异激活模式可能是伴随该人群终生的核心语言加工特征, 这也与前人研究中的推测类似(Paul & Cohen, 1985)。
4.2 现有不足与展望
首先, 受限于现有研究数量, 本研究未能够区别不同类型的词义加工任务, 将理解任务和产出任务, 单个词的语义提取和词与词之间的语义关系的加工, 混杂在一起。基于对行为研究的分析, 我们发现言语ASD人群可能在加工单个词的基础语义上不存在困难, 而可能对词与词之间的关系, 或是词的范畴信息等不敏感。随着相关研究的丰富, 未来研究应集中于言语ASD人群更可能表现得弱于TD人群的某类或某几类词义加工任务, 明确与之对应的神经加工机制特点。
其次, 本研究将纳入研究限制在fMRI研究上, 这意味着对本研究结果的解读应限制在ASD人群加工词义时大脑激活模式与TD人群存在差异。除了fMRI研究之外, 还有相当数量的研究采用了其他脑成像技术(如正电子发射型计算机断层显像), 或是采用功能连通性分析, 或是事件相关电位技术探究该人群加工词义时的在线神经生理反应。今后研究可以考虑整合采用不同神经技术的研究结果, 不断完善对ASD人群词义加工神经机制的认识。
第三, 基于元分析结果, 本研究推测了言语ASD人群词义加工的大脑激活模式差异很可能是伴随终生的。然而, 在部分词义加工研究中, 言语ASD成人在行为层面与TD对照组表现类似, 但fMRI结果却发现两组被试大脑激活模式差异显著(Knaus et al., 2017)。换言之, 尽管词义加工过程中的大脑激活模式存在差异, 但部分言语ASD个体在行为层面有典型表现。今后研究可以考虑从ASD人群在词义加工任务中的行为层面和神经机制层面的不匹配出发, 探究该人群是否利用了补偿策略使其在行为层面顺利完成词义加工任务。
最后, 探索性亚组分析结果暗示了加工词义时, 成人和儿童及青少年的跨研究脑激活模式可能存在差异。这一发现与前人研究结果存在一致之处(Chen et al., 2016; Fan et al., 2021)。然而, 现有研究中ASD被试的年龄普遍跨度较大, 有时会同时包括儿童和成人被试。今后研究需要严格控制被试年龄, 更有针对性地明确不同年龄阶段ASD人群加工词义时的脑激活模式。由于纳入研究中的来自汉语被试的研究仅有3篇, 数量过少, 本研究未针对汉语人群开展亚组分析。考虑到英语和汉语在词形等方面的区别, 加工词义时跨研究的大脑激活模式可能存在语言特异的表现。随着针对汉语ASD人群语言加工研究的丰富, 今后研究需要整合汉语相关研究, 进一步明确汉语ASD人群加工词义的脑激活模式与英语ASD人群的异同。同时, 由于亚组分析中纳入研究数量较为有限, 结果可靠性需要后续更多实证研究的印证。
总之, 尽管多年来, 学界已经对ASD人群的词义加工能力进行了多层面、多角度的探究, 但由于该人群内部的异质性和词义加工的复杂性, 仍有很多问题尚待探究。区分不同年龄, 语言背景, 语言能力, 认知能力, 乃至干预经历的ASD人群, 区分不同类型, 或是不同语境下的词义加工, 更可能是下一阶段ASD人群词义加工能力研究的重点所在。
5 结论
本研究筛选了11项使用fMRI探究言语ASD人群词义加工的研究, 采用了ALE元分析并发现尽管在词义加工过程中, 该人群跨研究稳定激活了左额下回、左颞下回等负责语言加工的典型脑区, 但与TD人群相比, 差异的大脑激活模式稳定存在, 具体表现为主要涉及左额叶的典型脑区激活不足。
*标识进入元分析的文献
曹漱芹, 方俊明. (2008). 自闭症谱系障碍语义加工特点与认知神经机制的研究综述., (9), 27–34.
胡传鹏, 邸新, 李佳蔚, 隋洁, 彭凯平. (2015). 神经成像数据的元分析.,(7), 1118–1129.
黄静, 梁丹丹. (2013). 自闭症个体语义加工障碍综述.,(3), 349–358+378.
宋宜琪, 靳羽西. (2018). 具身理论:自闭症个体词汇语义加工研究的新视角., (3), 26–32.
Barch, D. M., Braver, T. S., Sabb, F. W., & Noll, D. C. (2000). Anterior cingulate and the monitoring of response conflict: Evidence from an fMRI study of overt verb generation.,(2), 298–309.
* Bednarz, H. M., Maximo, J. O., Murdaugh, D. L., O'Kelley, S., & Kana, R. K. (2017). "Decoding versus comprehension": Brain responses underlying reading comprehension in children with autism.,, 39–47.
Bookheimer, S. (2002). Functional MRI of language: New approaches to understanding the cortical organization of semantic processing.,, 151–188. https://doi.org/10.1146/annurev.neuro.25.112701. 142946
Bowler, D. M., Gardiner, J. M., Grice, S., & Saavalainen, P. (2000). Memory illusions: False recall and recognition in adults with Asperger's syndrome.,(4), 663–672.
Buckner, R. L., Raichle, M. E., & Petersen, S. E. (1995). Dissociation of human prefrontal cortical areas across different speech production tasks and gender groups.,(5), 2163–2173.
* Chen, P.-J., Gau, S. S., Lee, S.-H., & Chou, T.-L. (2016). Differences in age-dependent neural correlates of semantic processing between youths with autism spectrum disorder and typically developing youths.,(12), 1263–1273.
Cheung, M.-c., Chan, A. S., Sze, S. L., Leung, W. W., & To, C. y. (2010). Verbal memory deficits in relation to organization strategy in high-and low-functioning autistic children.,(4), 764–771.
Cutting, L. E., Clements, A. M., Courtney, S., Rimrodt, S. L., Schafer, J. G., Bisesi, J., Pekar, J. J., & Pugh, K. R. (2006). Differential components of sentence comprehension: Beyond single word reading and memory.,(2), 429–438.
. (2013). American Psychiatric Association.
Dunn, M., Gomes, H., & Sebastian, M. J. (1996). Prototypicality of responses of autistic, language disordered, and normal children in a word fluency task.,(2), 99–108.
Eigsti, I.-M., de Marchena, A. B., Schuh, J. M., & Kelley, E. (2011). Language acquisition in autism spectrum disorders: A developmental review.,(2), 681–691.
Eskes, G. A., Bryson, S. E., & McCormick, T. A. (1990). Comprehension of concrete and abstract words in autistic children.,(1), 61–73.
* Fan, L.-Y., Booth, J. R., Liu, M., Chou, T.-L., & Gau, S. S. (2021). Developmental differences in neural connectivity for semantic processing in youths with autism.,(9), 1090–1099.
* Gaffrey, M. S., Kleinhans, N. M., Haist, F., Akshoomoff, N., Campbell, A., Courchesne, E., & Muller, R.-A. (2007). A typical participation of visual cortex during word processing in autism: An fMRI study of semantic decision.,(8), 1672–1684.
Gaigg, S. B., Gardiner, J. M., & Bowler, D. M. (2008). Free recall in autism spectrum disorder: The role of relational and item-specific encoding.,(4), 983–992.
* Harris, G. J., Chabris, C. F., Clark, J., Urban, T., Aharon, I., Steele, S., McGrath, L., Condouris, K., & Tager-Flusberg, H. (2006). Brain activation during semantic processing in autism spectrum disorders via functional magnetic resonance imaging.,(1), 54–68.
Herringshaw, A. J., Ammons, C. J., DeRamus, T. P., & Kana, R. K. (2016). Hemispheric differences in language processing in autism spectrum disorders: A meta-analysis of neuroimaging studies.,(10), 1046– 1057.
Just, M. A., Cherkassky, V. L., Keller, T. A., & Minshew, N. J. (2004). Cortical activation and synchronization during sentence comprehension in high-functioning autism:Evidence of underconnectivity.,(Pt 8), 1811–1821.
Kana, R. K., Keller, T. A., Cherkassky, V. L., Minshew, N. J., & Just, M. A. (2006). Sentence comprehension in autism: Thinking in pictures with decreased functional connectivity.,(Pt 9), 2484–2493.
* Kana, R. K., Sartin, E. B., Jr Stevens, C., Deshpande, H. D., Klein, C., Klinger, M. R., & Klinger, L. G. (2017). Neural networks underlying language and social cognition during self-other processing in autism spectrum disorders.,, 116–123.
Kanner, L. (1943). Autistic disturbances of affective contact.,(3), 217–250.
* Kleinhans, N. M., Muller, R.-A., Cohen, D. N., & Courchesne, E. (2008). Atypical functional lateralization of language in autism spectrum disorders.,, 115–125.
* Knaus, T. A., Burns, C., Kamps, J., & Foundas, A. L. (2017). Atypical activation of action-semantic network in adolescents with autism spectrum disorder.,, 57–64.
* Knaus, T. A., Silver, A. M., Lindgren, K. A., Hadjikhani, N., & Tager-Flusberg, H. (2008). fMRI activation during a language task in adolescents with ASD.,(6), 967–979.
Leung, H.-C., Gore, J. C., & Goldman-Rakic, P. S. (2002). Sustained mnemonic response in the human middle frontal gyrus during on-line storage of spatial memoranda.,(4), 659–671.
López, B., & Leekam, S. R. (2003). Do children with autism fail to process information in context?,(2), 285–300.
Minshew, N. J., Meyer, J., & Goldstein, G. (2002). Abstract reasoning in autism: A dissociation between concept formation and concept identification.,(3), 327–334.
Nachev, P., Wydell, H., O'Neill, K., Husain, M., & Kennard, C. (2007). The role of the pre-supplementary motor area in the control of action.,(3-3), T155–163.
Naigles, L. R., & Tek, S. (2017). 'Form is easy, meaning is hard' revisited: (re) characterizing the strengths and weaknesses of language in children with autism spectrum disorder.,(4), e1438.
Paul, R., & Cohen, D. J. (1985). Comprehension of indirect requests in adults with autistic disorders and mental retardation.,(4), 475–479.
Petrides, M. (2005). Lateral prefrontal cortex: Architectonic and functional organization.,(1456), 781–795.
Phan, L., Tariq, A., Lam, G., Pang, E. W., & Alain, C. (2021). The neurobiology of semantic processing in autism spectrum disorder: An activation likelihood estimation analysis.,(9), 3266–3279.
Poldrack, R. A., Wagner, A. D., Prull, M. W., Desmond, J. E., Glover, G. H., & Gabrieli, J. D. (1999). Functional specialization for semantic and phonological processing in the left inferior prefrontal cortex.,(1), 15–35.
Price, C. J. (2010). The anatomy of language: A review of 100 fMRI studies published in 2009.,(1), 62–88. https://doi.org/ 10.1111/j.1749-6632.2010.05444.x
Price, C. J. (2012). A review and synthesis of the first 20 years of PET and fMRI studies of heard speech, spoken language and reading.,(2), 816–847.
Scheller, E., Abdulkadir, A., Peter, J., Tabrizi, S. J., Frackowiak, R. S., & Klöppel, S. (2013). Interregional compensatory mechanisms of motor functioning in progressing preclinical neurodegeneration.,, 146–154.
* Shen, M. D., Shih, P., Ottl, B., Keehn, B., Leyden, K. M., Gaffrey, M. S., & Muller, R.-A. (2012). Atypical lexicosemantic function of extrastriate cortex in autism spectrum disorder: Evidence from functional and effective connectivity.,(3), 1780–1791.
Smith, B. J., Gardiner, J. M., & Bowler, D. M. (2007). Deficits in free recall persist in Asperger’s syndrome despite training in the use of list-appropriate learning strategies.,(3), 445–454.
Tager-Flusberg, H. (1985). The conceptual basis for referential word meaning in children with autism.,(5), 1167–1178.
Tager‐Flusberg, H. (1991). Semantic processing in the free recall of autistic children: Further evidence for a cognitive deficit.,(3), 417–430.
Tager-Flusberg, H., Paul, R., & Lord, C. (2005). Language and Communication in Autism. In(Vol. 1, 3rd ed., pp. 335–364). John Wiley & Sons Inc.
Tesink, C., Buitelaar, J. K., Petersson, K. M., van der Gaag, R. J., Teunisse, J.-P., & Hagoort, P. (2011). Neural correlates of language comprehension in autism spectrum disorders: When language conflicts with world knowledge.,(5), 1095–1104.
Toichi, M., & Kamio, Y. (2001). Verbal association for simple common words in high-functioning autism.,(5), 483–490.
* Wong, C.-H., Gau, S. S., & Chou, T.-L. (2019). Neural correlates of association strength and categorical relatedness in youths with autism spectrum disorder.,(10), 1484–1494.
Brain activation differences in lexical-semantics processing in autistic population: A meta-analysis of fMRI studies
YU Jiayu1, JIN Yuxi2, LIANG Dandan2,3
(1Department of Chinese and Bilingual Studies, The Hong Kong Polytechnic University, Hong Kong 999077, China)(2School of Chinese Language and Culture, Nanjing Normal University, Nanjing 210097, China)(3Interdisciplinary Research Center for Linguistic Science, University of Science and Technology of China, Hefei 230026, China)
The current study identified 11 published journal articles that used fMRI to investigate lexical- semantic processing in individuals with ASD. Activation likelihood estimation analysis was adopted to investigate whether atypical brain activation patterns in individuals with ASD were stable across studies and how the atypical performance manifested. The results revealed that although the ASD group activated typical lexical-semantics processing brain regions, differential brain activation patterns were steadily present between the ASD and TD groups, manifested as hypoactivation in the left superior frontal gyrus in the ASD group. These findings provided evidence for the atypical brain responses to lexical-semantics processing in individuals with ASD from a cross-study perspective. Their atypical brain activation activities when processing meanings of words were consistent with the "decreased frontal lobe activation" hypothesis. The current study highlighted that distinguishing between different levels of language processing can help researchers identify the corresponding neural markers of certain types of language impairments in autistic populations.
Autism Spectrum Disorder, lexical-semantic, fMRI, meta-analysis
2021-10-24
梁丹丹, E-mail: ldd233@sina.com
B845
