依托咪酯通过调控MAPK/ERK信号通路对阿尔茨海默病小鼠认知功能和氧化应激的影响
2022-11-15王冰艳刘爱芬孙凤仙
王冰艳 刘爱芬 孙凤仙
天津医科大学第二医院麻醉科,天津 300211
阿尔茨海默病是中枢神经系统常见疾病,也是老年期常见疾病,主要表现为记忆障碍、失语、视空间能力损害、认知功能障碍等,据调查数据显示,阿尔茨海默病发病率与年龄有关,年龄每增加6 岁,发病率可升高1 倍,且85 岁以后病发率高达30%[1-2]。阿尔茨海默病发病原因尚不明确,研究认为,可能与神经细胞炎性反应、氧化应激、β-淀粉样蛋白沉积等有关[3]。依托咪酯是静脉麻醉药,因具有镇痛好、起效快等特点用于临床麻醉,研究显示,依托咪酯对老年术后认知功能障碍无影响[4]。还有研究发现,依托咪酯呈剂量依赖性抑制大鼠脊髓神经兴奋,并降低烟碱型乙酰胆碱受体表达,但目前关于依托咪酯对阿尔茨海默病的动物研究还不明确[5]。丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)信号通路是经典信号通路,可通过降低相关通路蛋白表达发挥保护脑神经元的作用,从而有效减轻阿尔茨海默病发展[6]。关于依托咪酯与MAPK/ERK 信号通路调控作用目前尚无明确报道,鉴于此,本研究主要探究依托咪酯可能通过调控MAPK/ERK 信号通路对阿尔茨海默病小鼠认知功能、氧化应激和炎性反应的影响。
资料与方法
1、实验动物
50 只SPF 级APP/PS1 转基因雌雄各半小鼠购于北京华阜康生物科技股份有限公司,许可证号为SCXK(京)2014-0004,12 月龄。10 只 SPF 级 C57BL/6 雌雄各半小鼠购于北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016-0006,12月龄。实验动物饲养于天津医科大学第二医院,自由进食饮水,昼夜交替各12 h,适应2周后可进行实验。本研究于2020年5月至2021年9月进行。
2、主要试剂
依托咪酯购于江苏恒瑞医药股份有限公司(国药准字H32022379,规格10 ml∶20 mg);盐酸多奈哌齐购于植恩生物技术股份有限公司(国药准字H32022379,规格10 mg);肿瘤坏死因子-α(TNF-α)抗体(ab183218)、白细胞介素(IL)-1β 抗体(ab254360)、IL-10 抗体(ab133575)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(ab8245)、磷酸化细胞外信号调节激酶(p-ERK)1/2 抗体(ab278538)、ERK1/2 抗体(ab184699)、磷 酸 化 p-p38 抗 体(ab178867)、p38 抗 体(ab170099)购于美国Abcam 公司;辣根过氧化物酶(HRP)标记的二抗购于上海研卉生物;放射免疫沉淀法(RIPA)裂解液、二喹啉甲酸(BCA)试剂盒、化学发光液购于北京索莱宝公司;超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)试剂盒购于上海广锐生物。
3、动物分组
将 50 只 SPF 级 APP/PS1 转基因小鼠分为 5 组:模型组、依托咪酯低、中、高剂量组、阳性对照组,SPF 级C57BL/6 小鼠作为对照组。其中依托咪酯低、中、高剂量组分别给予1.0、2.5、5.0 mg/kg 依托咪酯灌胃,阳性对照组给予10 mg/kg盐酸多奈哌齐灌胃,模型组、对照组给予等体积生理盐水灌胃,1次/d,灌胃30 d。
4、Morris水迷宫实验
采用Morris 水迷宫实验观察检测小鼠学习、记忆能力。Morris 水迷宫装置,直径180 cm、高55 cm 圆形黑色水池,水深30 cm,距水池壁35 cm 放置一个高29 cm、直径10 cm 的圆台。定位导航实验:将小鼠放置4 个不同位点,背对水池壁放入水池中,让小鼠自由游泳寻找平台,记录小鼠找到平台时间,即为逃避潜伏期,若在120 s内未找到平台,需将小鼠引至平台停留10 s,连续进行5 d。空间探索实验:第5 天小鼠训练结束后撤出平台,小鼠放在同一入水点,观察检测120 s内跨平台次数、平台区停留距离。
5、神经损伤评分测定
各组小鼠灌胃4 周后进行神经损伤评分,参考Zea-Longa's 评分标准[7]。分数为 0~4 分,4 分:不能自主行走,且存在意识障碍;3 分:小鼠躯体左侧瘫痪,行走时向左侧倾倒;2 分:行走时小鼠躯体向左侧(瘫痪)转圈;1 分:小鼠左侧前爪不能完全伸展;0 分:行为正常,无神经功能缺损。
6、脑组织含水量测定
各组小鼠喂养30 d 后断头处死小鼠脑组织,通过干湿法检测小鼠脑组织含水量。取小鼠脑组织100 mg 称重,即湿重;110 ℃烘箱放置24 h,取出脑组织称重,即干重。计算脑组织含水量(%)=(湿重-干重)/湿重×100%。
7、蛋白免疫印迹法(Western blot)检测TNF-α、IL-10、IL-1β、p-ERK1/2、ERK1/2、p-p38、p38蛋白的表达
取小鼠脑组织,加入RIPA 裂解液进行裂解,12 000×g离心15 min,经BCA 法检测蛋白浓度,取上样蛋白添加至上样槽内,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,湿转法转膜,用5%脱脂牛奶封闭90 min,加入TNF-α(稀释 1∶500)、IL-10(稀释 1∶800)、IL-1β(稀释 1∶500)、p-ERK1/2(稀释 1∶600)、ERK1/2(稀释1∶600)、p-p38(稀释1∶600)、p38(稀释1∶600)和GAPDH(稀释1∶2000)抗体稀释液,4 ℃过夜孵育,于次日HRP 标记的二抗(稀释1∶5 000)37 ℃孵育90 min。最后加入化学发光液显色、曝光,使用Image J软件分析蛋白条带,以GAPDH作为内参。
8、酶联免疫吸附法(ELISA)检测氧化应激指标
取小鼠脑组织,制备成匀浆液,3 000 r/min 离心10 min(离心半径10 cm)后取上清,按照ELISA 试剂盒说明书步骤检测SOD活性、CAT活性、GSH-Px活性、MDA含量。
9、统计学方法
采用统计学软件SPSS 23.0 分析实验数据,符合正态分布的计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,进一步组内间比较用LSD-t检验,以P<0.05表示差异有统计学意义。
结 果
1、各组小鼠Morris水迷宫试验比较
与对照组相比,模型组的逃避潜伏期均明显延长,跨平台次数、平台区停留距离均降低(均P<0.05);与模型组比较,依托咪酯低、中、高剂量组及阳性对照组的逃避潜伏期均明显缩短,跨平台次数、平台区停留距离均升高(均P<0.05)。具体见表1、表2。
表1 各组小鼠逃避潜伏期比较(s,)
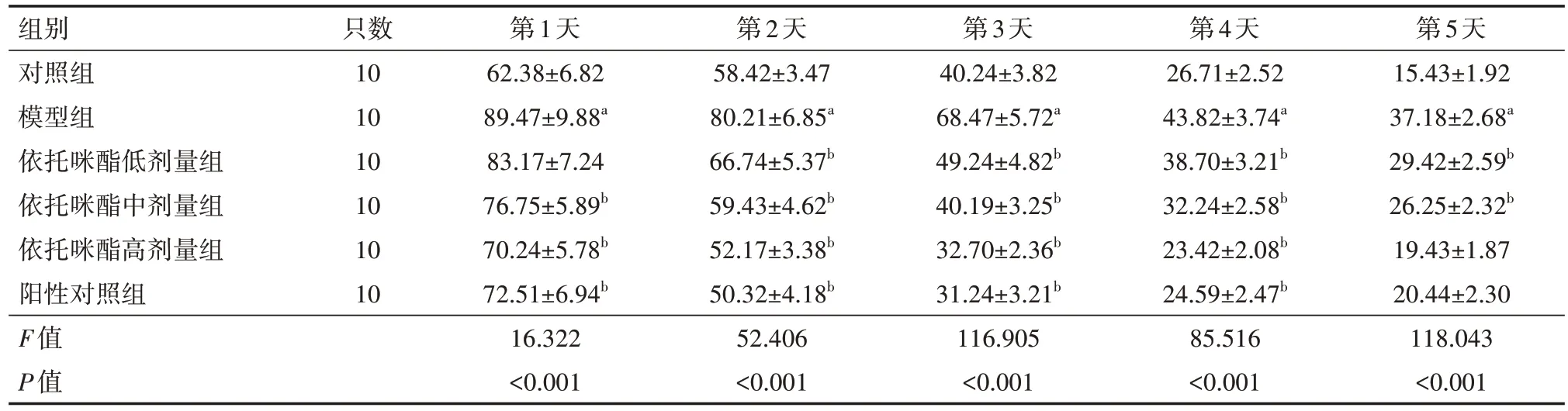
表1 各组小鼠逃避潜伏期比较(s,)
注:模型组,依托咪酯低、中、高剂量组,阳性对照组均为APP/PS1转基因小鼠;对照组为SPF级C57BL/6小鼠;依托咪酯低、中、高剂量组分别给予1.0、2.5、5.0 mg/kg 依托咪酯灌胃,阳性对照组给予10 mg/kg 盐酸多奈哌齐灌胃,模型组、对照组给予等体积生理盐水灌胃;与对照组比较,aP<0.05;与模型组比较,bP<0.05
第5天15.43±1.92 37.18±2.68a 29.42±2.59b 26.25±2.32b 19.43±1.87 20.44±2.30 118.043<0.001组别对照组模型组依托咪酯低剂量组依托咪酯中剂量组依托咪酯高剂量组阳性对照组F值P值只数10 10 10 10 10 10第1天62.38±6.82 89.47±9.88a 83.17±7.24 76.75±5.89b 70.24±5.78b 72.51±6.94b 16.322<0.001第2天58.42±3.47 80.21±6.85a 66.74±5.37b 59.43±4.62b 52.17±3.38b 50.32±4.18b 52.406<0.001第3天40.24±3.82 68.47±5.72a 49.24±4.82b 40.19±3.25b 32.70±2.36b 31.24±3.21b 116.905<0.001第4天26.71±2.52 43.82±3.74a 38.70±3.21b 32.24±2.58b 23.42±2.08b 24.59±2.47b 85.516<0.001
表2 各组小鼠空间探索能力比较(s,)
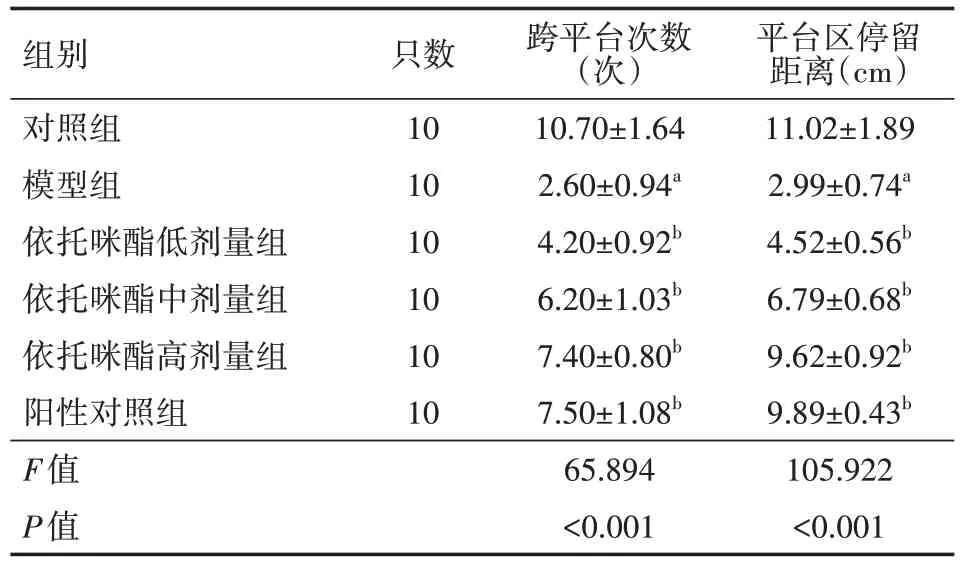
表2 各组小鼠空间探索能力比较(s,)
注:模型组,依托咪酯低、中、高剂量组,阳性对照组均为APP/PS1 转基因小鼠;对照组为SPF 级C57BL/6 小鼠;依托咪酯低、中、高剂量组分别给予1.0、2.5、5.0 mg/kg 依托咪酯灌胃,阳性对照组给予10 mg/kg 盐酸多奈哌齐灌胃,模型组、对照组给予等体积生理盐水灌胃;与对照组比较,aP<0.05;与模型组比较,bP<0.05
平台区停留距离(cm)11.02±1.89 2.99±0.74a 4.52±0.56b 6.79±0.68b 9.62±0.92b 9.89±0.43b 105.922<0.001组别对照组模型组依托咪酯低剂量组依托咪酯中剂量组依托咪酯高剂量组阳性对照组F值P值只数10 10 10 10 10 10跨平台次数(次)10.70±1.64 2.60±0.94a 4.20±0.92b 6.20±1.03b 7.40±0.80b 7.50±1.08b 65.894<0.001
2、各组小鼠神经损伤评分、脑组织含水量的比较
与对照组相比,模型组的神经损伤评分、脑组织含水量均增加(均P<0.05);与模型组比较,依托咪酯中、高剂量组及阳性对照组的神经损伤评分、脑组织含水量均降低(均P<0.05)。具体见表3。
表3 各组小鼠神经损伤评分、脑组织含水量比较()
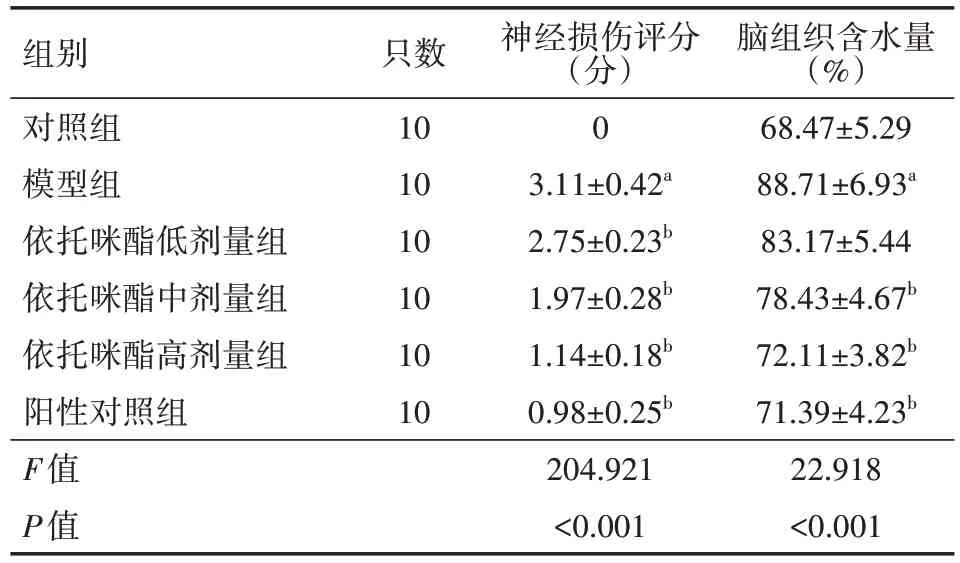
表3 各组小鼠神经损伤评分、脑组织含水量比较()
注:模型组,依托咪酯低、中、高剂量组,阳性对照组均为APP/PS1 转基因小鼠;对照组为SPF 级C57BL/6 小鼠;依托咪酯低、中、高剂量组分别给予1.0、2.5、5.0 mg/kg 依托咪酯灌胃,阳性对照组给予10 mg/kg 盐酸多奈哌齐灌胃,模型组、对照组给予等体积生理盐水灌胃;与对照组比较,aP<0.05;与模型组比较,bP<0.05
脑组织含水量(%)68.47±5.29 88.71±6.93a 83.17±5.44 78.43±4.67b 72.11±3.82b 71.39±4.23b 22.918<0.001组别对照组模型组依托咪酯低剂量组依托咪酯中剂量组依托咪酯高剂量组阳性对照组F值P值只数10 10 10 10 10 10神经损伤评分(分)0 3.11±0.42a 2.75±0.23b 1.97±0.28b 1.14±0.18b 0.98±0.25b 204.921<0.001
3、各组小鼠脑组织氧化应激指标比较
与对照组相比,模型组的SOD、CAT、GSH-Px 活性均降低,MDA 含量增加(均P<0.05);与模型组比较,依托咪酯低、中、高剂量组及阳性对照组的SOD、CAT、GSH-Px 活性均增加,MDA含量均降低(均P<0.05)。具体见表4。
表4 各组小鼠氧化应激水平比较()

表4 各组小鼠氧化应激水平比较()
注:模型组,依托咪酯低、中、高剂量组,阳性对照组均为APP/PS1转基因小鼠;对照组为SPF级C57BL/6小鼠;依托咪酯低、中、高剂量组分别给予1.0、2.5、5.0 mg/kg 依托咪酯灌胃,阳性对照组给予10 mg/kg 盐酸多奈哌齐灌胃,模型组、对照组给予等体积生理盐水灌胃;与对照组比较,aP<0.05;与模型组比较,bP<0.05
丙二醛含量(nmol/mg)2.17±0.34 8.42±0.87a 6.52±0.49b 5.19±0.44b 3.73±0.45b 3.27±0.38b 192.917<0.001组别对照组模型组依托咪酯低剂量组依托咪酯中剂量组依托咪酯高剂量组阳性对照组F值P值只数10 10 10 10 10 10超氧化物歧化酶活性(U/mg)92.35±10.24 43.12±3.64a 50.22±4.85b 65.37±6.71b 81.46±7.30b 73.14±8.89b 65.522<0.001过氧化氢酶活性(U/mg)16.77±2.08 4.26±0.42a 7.20±0.74b 11.94±1.12b 14.87±1.50b 13.42±1.67b 120.457<0.001谷胱甘肽过氧化物酶活性(U/mg)78.46±7.88 30.14±3.32a 38.59±3.63b 53.12±4.89b 67.67±5.82b 70.21±7.38b 110.078<0.001
4、各组小鼠脑组织炎性反应比较
与对照组相比,模型组的TNF-α、IL-10、IL-1β 蛋白表达均增加(P<0.05);与模型组比较,依托咪酯低、中、高剂量组及阳性对照组的TNF-α、IL-10、IL-1β 蛋白表达均降低(P<0.05)。具体见图1、表5。
表5 各组小鼠炎性反应比较()
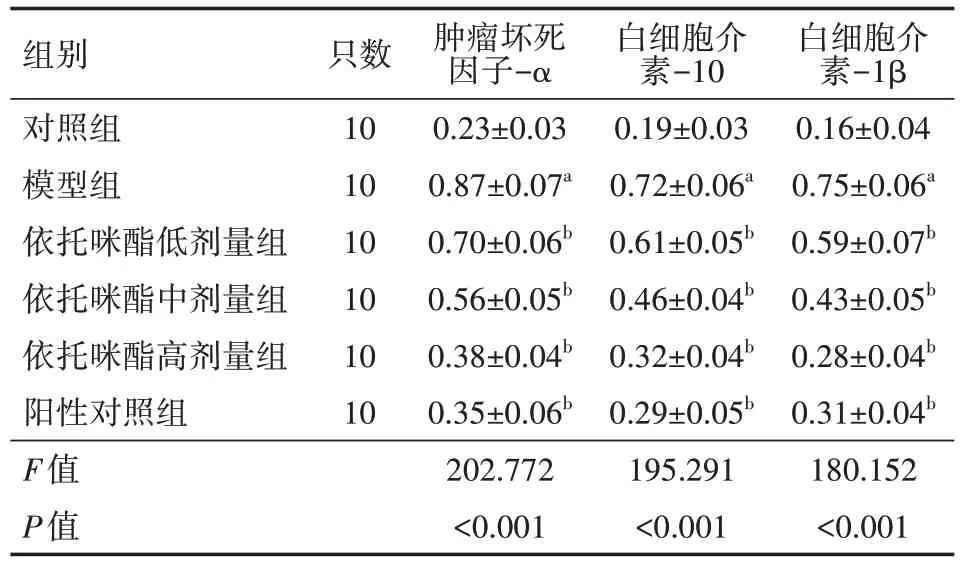
表5 各组小鼠炎性反应比较()
注:模型组,依托咪酯低、中、高剂量组,阳性对照组均为APP/PS1 转基因小鼠;对照组为SPF 级C57BL/6 小鼠;依托咪酯低、中、高剂量组分别给予1.0、2.5、5.0 mg/kg 依托咪酯灌胃,阳性对照组给予10 mg/kg 盐酸多奈哌齐灌胃,模型组、对照组给予等体积生理盐水灌胃;与对照组比较,aP<0.05;与模型组比较,bP<0.05
白细胞介素-1β 0.16±0.04 0.75±0.06a 0.59±0.07b 0.43±0.05b 0.28±0.04b 0.31±0.04b 180.152<0.001组别对照组模型组依托咪酯低剂量组依托咪酯中剂量组依托咪酯高剂量组阳性对照组F值P值只数10 10 10 10 10 10肿瘤坏死因子-α 0.23±0.03 0.87±0.07a 0.70±0.06b 0.56±0.05b 0.38±0.04b 0.35±0.06b 202.772<0.001白细胞介素-10 0.19±0.03 0.72±0.06a 0.61±0.05b 0.46±0.04b 0.32±0.04b 0.29±0.05b 195.291<0.001
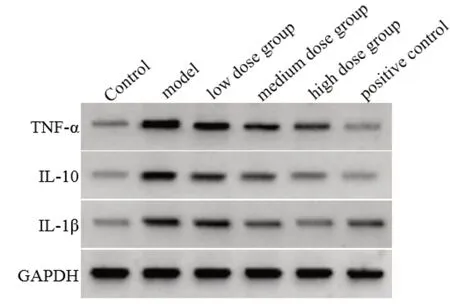
图1 蛋白免疫印迹法(Western blot)检测各组小鼠TNF-α、IL-10、IL-1β蛋白表达
5、各组小鼠脑组织MAPK/ERK 信号通路相关蛋白表达比较
与对照组相比,模型组的p-ERK1/2、p-p38蛋白表达均降低(均P<0.05);与模型组比较,依托咪酯低、中、高剂量组及阳性对照组的p-ERK1/2、p-p38 蛋白表达均增加(均P<0.05)。具体见图2、表6。
表6 各组小鼠MAPK/ERK信号通路相关蛋白表达比较()
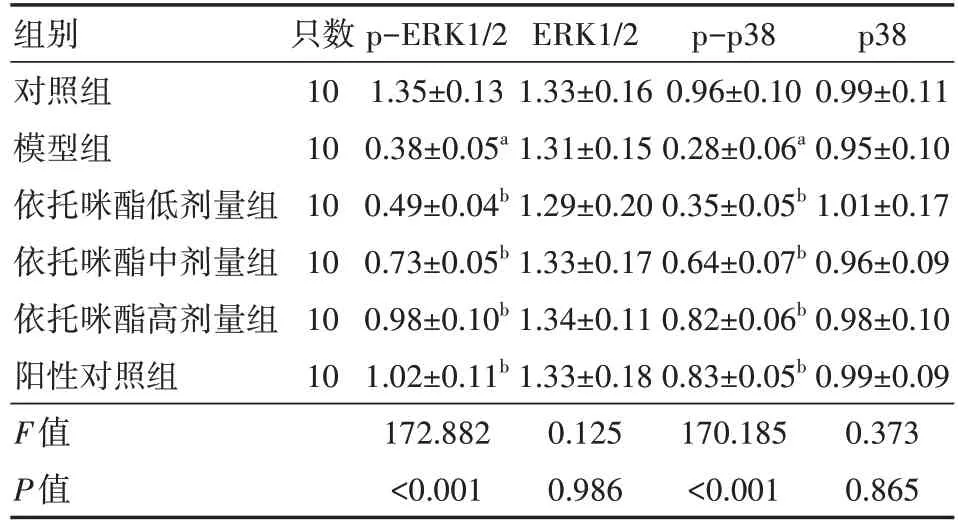
表6 各组小鼠MAPK/ERK信号通路相关蛋白表达比较()
注:模型组,依托咪酯低、中、高剂量组,阳性对照组均为APP/PS1 转基因小鼠;对照组为SPF 级C57BL/6 小鼠;依托咪酯低、中、高剂量组分别给予1.0、2.5、5.0 mg/kg 依托咪酯灌胃,阳性对照组给予10 mg/kg 盐酸多奈哌齐灌胃,模型组、对照组给予等体积生理盐水灌胃;p-ERK 为磷酸化细胞外信号调节激酶,ERK 为细胞外信号调节激酶;与对照组比较,aP<0.05;与模型组比较,bP<0.05
p38 0.99±0.11 0.95±0.10 1.01±0.17 0.96±0.09 0.98±0.10 0.99±0.09 0.373 0.865组别对照组模型组依托咪酯低剂量组依托咪酯中剂量组依托咪酯高剂量组阳性对照组F值P值只数10 10 10 10 10 10 p-ERK1/2 1.35±0.13 0.38±0.05a 0.49±0.04b 0.73±0.05b 0.98±0.10b 1.02±0.11b 172.882<0.001 ERK1/2 1.33±0.16 1.31±0.15 1.29±0.20 1.33±0.17 1.34±0.11 1.33±0.18 0.125 0.986 p-p38 0.96±0.10 0.28±0.06a 0.35±0.05b 0.64±0.07b 0.82±0.06b 0.83±0.05b 170.185<0.001

图2 蛋白免疫印迹法(Western blot)检测各组小鼠p-ERK1/2、ERK1/2、p-p38、p38蛋白表达
讨 论
阿尔茨海默病是一种不可逆的神经退行性疾病,越来越多研究结果显示,其病理特征与β-淀粉样蛋白聚集、神经细胞损伤等有关[8-10]。目前关于阿尔茨海默病体内、体外研究多种多样,APP/PS1 转基因小鼠能更好地模拟体内阿尔茨海默病病理特征,近年被广泛应用[11]。APP/PS1 转基因小鼠是利用突变或野生APP、PS1 基因将其导入小鼠体内,当小鼠体内双基因表达过多时可引起β-淀粉样蛋白沉积,导致小鼠脑组织神经元出现病理性损害[12]。本研究为了更好地模拟体内阿尔茨海默病,使用APP/PS1 转基因小鼠进行实验,选择同月龄C57BL/6 小鼠作为对照,用Morris水迷宫实验观察小鼠的学习、记忆能力,发现模型组小鼠逃避潜伏期均明显延长,且跨平台次数、平台区停留距离也均降低,脑组织含水量升高,且神经损伤评分表现出重度神经功能损害,这与Ou等[12]研究一致。
研究认为,脑组织神经元与认知功能、记忆能力等有关,正常情况下神经元可替换凋亡的神经元,但阿尔茨海默病患者因脑组织海马区神经元萎缩,导致神经元释放发生氧化应激和炎性反应,造成神经元细胞异常凋亡,可加重疾病发展[13-14]。SOD、CAT、GSH-Px 是机体内抗氧化物酶,可有效清除体内氧化产物,从而提高机体抗氧化能力;MDA是脂质过氧化物的最终产物,可作为氧化应激指标[15]。神经元发生氧化应激后还促进细胞释放更多TNF-α、IL-10、IL-1β 等因子,从而激活炎性反应发生,导致神经元细胞损伤加重[16]。本研究结果显示,模型组小鼠脑组织中SOD、CAT、GSH-Px 活性降低,MDA 含量增加,且TNF-α、IL-10、IL-1β蛋白表达上调,这与Meng、Qiu等[15-16]研究结果一致。
依托咪酯是临床常用静脉麻醉药物,具有作用时间短等特点,且对循环系统、血流动力学、认知功能影响小,临床可用于老年术后、危重症患者[17]。研究发现,依托咪酯可用于治疗老年脊柱手术患者,可保证患者血流动力学稳定,并减轻氧化应激、提高术后认知功能[18]。还有研究发现,依托咪酯可提高新生大鼠认知功能,并增加烟碱型乙酰胆碱受体表达[19]。本研究结果显示,不同剂量依托咪酯灌胃小鼠后,呈剂量依赖性改善小鼠脑组织认知功能,并增加SOD、CAT、GSH-Px 活性,降低MDA 含量及下调TNF-α、IL-10、IL-1β 蛋白表达,可见,依托咪酯可改善阿尔茨海默病小鼠认知功能,这与杨青青等[19]研究结果相似,且本研究还发现其还可提高小鼠抗炎、抗氧化能力。MAPK/ERK 信号通路是近年来在疾病研究中使用比较广泛,研究显示,MAPK/ERK 信号通路被激活对阿尔茨海默病大鼠脑组神经元具有保护作用[20]。研究结果显示,黄芪甲苷可能通过激活ERK 信号通路抑制阿尔茨海默病大鼠脑组织炎性损伤,并减少神经元细胞凋亡[21]。本研究以MAPK/ERK信号通路为切入点,并探究依托咪酯与MAPK/ERK 信号通路对阿尔茨海默病的作用机制,结果显示,模型组内p-ERK1/2、p-p38蛋白表达上调,给予小鼠灌胃不同剂量依托咪酯可增加p-ERK1/2、p-p38 蛋白表达,表明依托咪酯可通过激活MAPK/ERK信号通路参与阿尔茨海默病的发展。
综上所述,本研究证实依托咪酯能改善阿尔茨海默病小鼠认知功能,并减轻小鼠脑组织氧化应激和炎性反应,作用机制可能与激活MAPK/ERK 信号通路相关蛋白表达有关,但关于依托咪酯对阿尔茨海默病小鼠具体机制研究需要后续探讨。
利益冲突所有作者均声明不存在利益冲突
