饲粮添加粪肠球菌对生长期乌苏里貉生长性能、氮代谢、血清生化指标及粪便菌群的影响
2022-11-15白银龙牛一兵张海华巩文洋曲毅程王夕国巩元芳赵惠媛李素芬冯敏山
白银龙 牛一兵* 张海华 巩文洋 曲毅程 龙 娟 王夕国 巩元芳 赵惠媛 李素芬** 冯敏山,3**
(1.河北科技师范学院,秦皇岛 066004;2.秦皇岛市三晶新农饲料有限公司,昌黎 066600;3.河北省碣石皮毛产业研究院,昌黎 066600)
粪肠球菌(Enterococcusfaecalis)是人和动物肠道中的共生乳酸菌,具有较强的产酸和抑菌能力[1],作为抗生素替代品在畜禽养殖中具有广泛的应用前景。研究发现,粪肠球菌可以提高断奶仔猪生长性能,促进营养物质的消化吸收,维持肠道菌群平衡,且以5×108~1×1010CFU/kg添加水平效果较好[2-4]。粪肠球菌对育成期蓝狐[5]和生长期水貂[6]也能起到提高生长性能和营养物质消化率以及减少氮排放的作用,且以1×108CFU/kg添加水平效果较理想。益生菌通常被认为是通过调节肠道菌群促进动物生长和健康,但益生菌对动物的使用效果不仅与菌株和添加水平有关,还受到动物本身固有的肠道菌群组成的影响[7]。乌苏里貉属杂食性毛皮动物,研究发现采食相同饲粮的乌苏里貉与蓝狐粪便菌群组成和相对丰度有显著差异[8]。但是,至今尚未见到粪肠球菌对乌苏里貉生长性能及肠道菌群影响的研究报道。因此,本试验旨在研究饲粮添加不同水平粪肠球菌对生长期乌苏里貉生长性能、氮代谢、血清生化指标及粪便菌群的影响,以确定其适量添加水平,并探讨粪肠球菌与肠道菌群和貉健康的关系,为其在貉养殖中的合理应用提供依据。
1 材料与方法
1.1 试验材料
1.1.1 试验粪肠球菌
试验用粪肠球菌购自山东某生物工程股份有限公司,其有效活菌数量≥1×1010CFU/g。
1.1.2 试验动物和饲粮
试验动物为健康、体重[(2.44±0.24) kg]相近的70日龄乌苏里貉公貉。由于目前我国没有统一的乌苏里貉饲养标准,因此参照本实验室前期研究结果[9]配制粗蛋白质水平为22%的生长期貉基础饲粮,其组成及营养水平见表1。
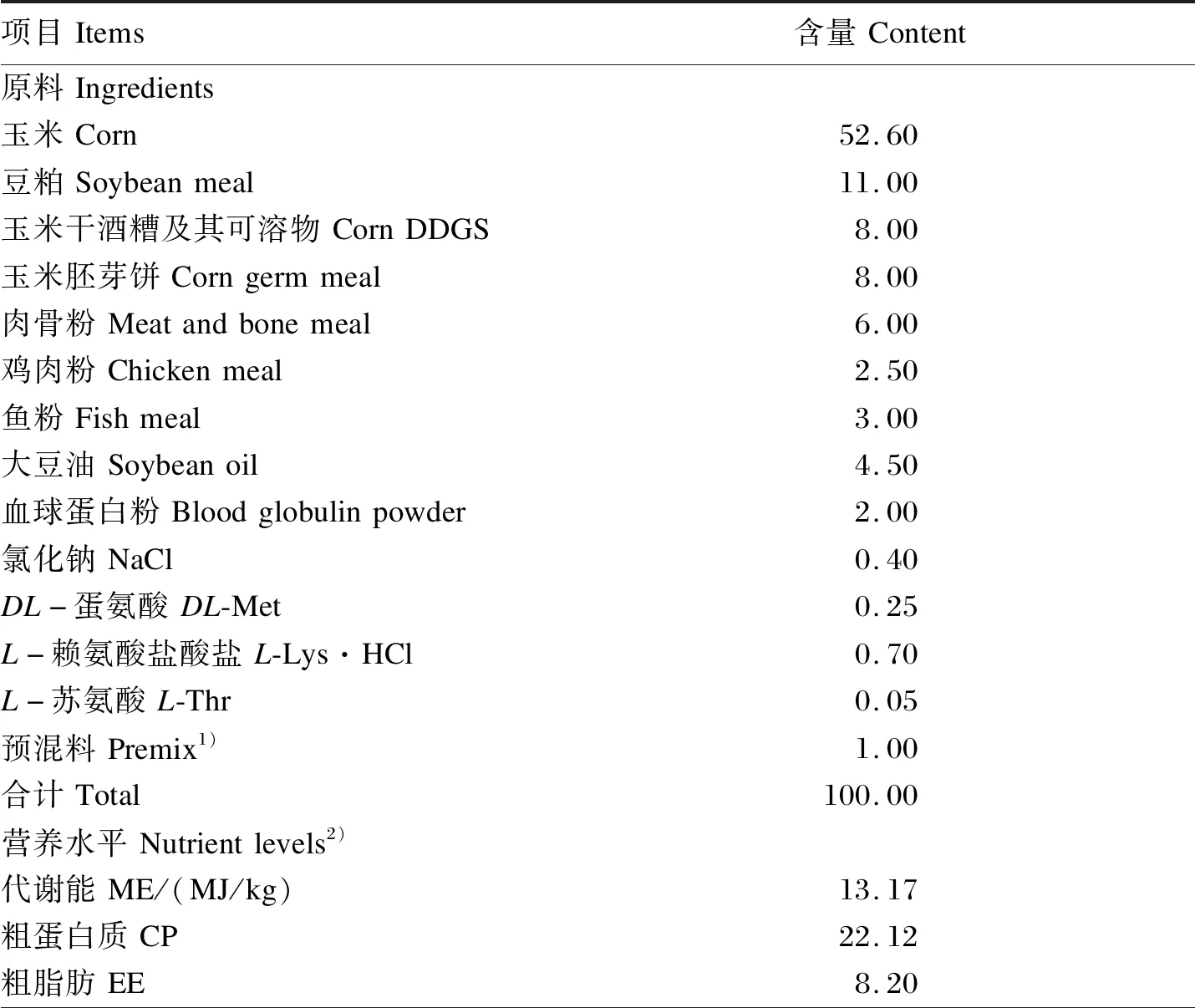
表1 基础饲粮组成及营养水平(饲喂基础)Table 1 Composition and nutrient levels of the basal diet (as fed-basis) %

续表1项目Items含量Content赖氨酸Lys1.58蛋氨酸Met0.61苏氨酸Thr0.85钙Ca0.97总磷TP0.78
1.2 试验方法
1.2.1 试验设计和饲养管理
采用单因素完全随机试验设计,粪肠球菌添加水平分别为0(对照组)、1×108(Ⅰ组)、1×109(Ⅱ组)和1×1010CFU/kg(Ⅲ组)。
将40只公貉随机分为4个组,每组10只,单笼饲养,每笼为1个重复。对照组饲喂不添加粪肠球菌的基础饲粮,其他3组分别饲喂按上述试验设计添加粪肠球菌的试验饲粮。试验预试期7 d,正试期70 d。试验在河北科技师范学院动物养殖试验场进行。
试验期间,以貉自由采食为原则,每天按只称料,以料∶水为1∶3加水搅拌均匀后,每天08:00、15:00饲喂2次,自由饮水,采用自然光照。试验结束时称重,计算平均日增重、平均日采食量和料重比。
1.2.2 样品采集和制备
基础饲粮配制现场采样,放入自封袋中备测。于112日龄采用全收粪法进行消化代谢试验。每天在尿桶中加入20 mL 10%盐酸固氮,用量筒量取尿液体积,按1/20收集3 d的尿液,-20 ℃冻存。每天收集的粪便按鲜重的10%加入10%盐酸溶液进行固氮,80 ℃下杀菌2 h,再在65 ℃烘干至恒重,制备风干样品。
在消化代谢试验结束后次日晨饲前2 h采集新鲜粪便。参照陈双双[10]报道的收粪方法,待貉排出粪便后立即用无菌分装袋收集,防止落地被污染。将2只貉的粪便混合后作为1个样品,放入3 mL灭菌管中,液氮速冻,-80 ℃冻存,以备进行菌群分析。为探讨粪肠球菌是否通过调节肠道菌群促进动物生长和健康,综合各组生长性能、氮代谢和血清生化指标,选择上述指标表现最好的Ⅰ组和对照组貉粪样送检。
试验结束时,后肢静脉采血5 mL,4 000 r/min离心10 min制备血清,-20 ℃保存,以备分析血清生化指标。
1.2.3 指标测定及分析
饲粮、粪样和尿样中粗蛋白质含量的测定参照GB/T 6432—2018凯氏定氮法。
采用日立7600全自动生化仪测定血清总蛋白(TP)、白蛋白(ALB)、葡萄糖(GLU)、尿素氮(UN)、总胆固醇(TC)和甘油三酯(TG)含量,试剂购自南京建成生物工程研究所。
粪便总DNA的提取、16s rDNA V3~V4区扩增、测序文库构建及Illumina NovaSeq平台高通量测序由北京百迈客生物科技有限公司完成。利用Illumina NovaSeq 6000系统对原始数据进行alpha多样性和菌群分析。
1.3 数据处理
采用SAS 6.12软件中的ANOVA过程对所有生长性能、氮代谢和血清生化指标数据进行单因素方差分析,方差分析差异显著者,以LSD法比较平均值间的差异显著性。采用t检验比较对照组和Ⅰ组之间粪便菌群结构的差异显著性。以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 饲粮添加粪肠球菌对生长期乌苏里貉生长性能的影响
由表2可知,Ⅰ组和Ⅱ组生长期乌苏里貉平均日增重显著高于对照组和Ⅲ组(P<0.05),且Ⅰ组显著高于Ⅱ组(P<0.05);Ⅰ组和Ⅱ组料重比显著低于对照组和Ⅲ组(P<0.05);Ⅲ组上述2项指标与对照组相比无显著差异(P>0.05)。饲粮添加粪肠球菌对生长期乌苏里貉平均日采食量无显著影响(P>0.05)。

表2 饲粮添加粪肠球菌对生长期乌苏里貉生长性能的影响Table 2 Effects of dietary Enterococcus faecalis on growth performance of growing Ussuri raccoon dogs
2.2 饲粮添加粪肠球菌对生长期乌苏里貉氮代谢的影响
由表3可知,与对照组相比,3个粪肠球菌添加组氮沉积量显著提高(P<0.05),但3个粪肠球菌添加组之间无显著差异(P>0.05);Ⅰ组和Ⅱ组蛋白质生物学价值显著提高(P<0.05),Ⅲ组无显著差异(P>0.05)。饲粮添加粪肠球菌对粗蛋白质消化率和净蛋白质利用率无显著影响(P>0.05)。
2.3 饲粮添加粪肠球菌对生长期乌苏里貉血清生化指标的影响
由表4可知,与对照组相比,Ⅰ组和Ⅱ组生长期乌苏里貉血清ALB含量显著提高(P<0.05),Ⅲ组无显著差异(P>0.05);3个粪肠球菌添加组血清UN含量均显著提高(P<0.05)。饲粮添加粪肠球菌对其他血清生化指标无显著影响(P>0.05)。
2.4 饲粮添加粪肠球菌对生长期乌苏里貉粪便菌群的影响
由表5可知,与对照组相比,Ⅰ组生长期乌苏里貉粪便菌群ACE指数和Chao1指数显著提高(P<0.05),香农指数和辛普森指数无显著差异(P>0.05)。由表6可知,生长期乌苏里貉粪便菌群相对丰度在1%以上的门为厚壁菌门、拟杆菌门、变形菌门和放线菌门;与对照组相比,Ⅰ组拟杆菌门相对丰度显著提高(P<0.05),其他3个门相对丰度无显著差异(P>0.05)。由表7可知,生长期乌苏里貉粪便菌群属水平的优势菌群为普雷沃氏菌属、粪杆菌属、光冈菌属、Catenisphaera和小杆菌属等;与对照组相比,Ⅰ组巨球型菌属相对丰度显著提高(P<0.05),小杆菌属、Catenisphaera和光冈菌属相对丰度显著降低(P<0.05)。
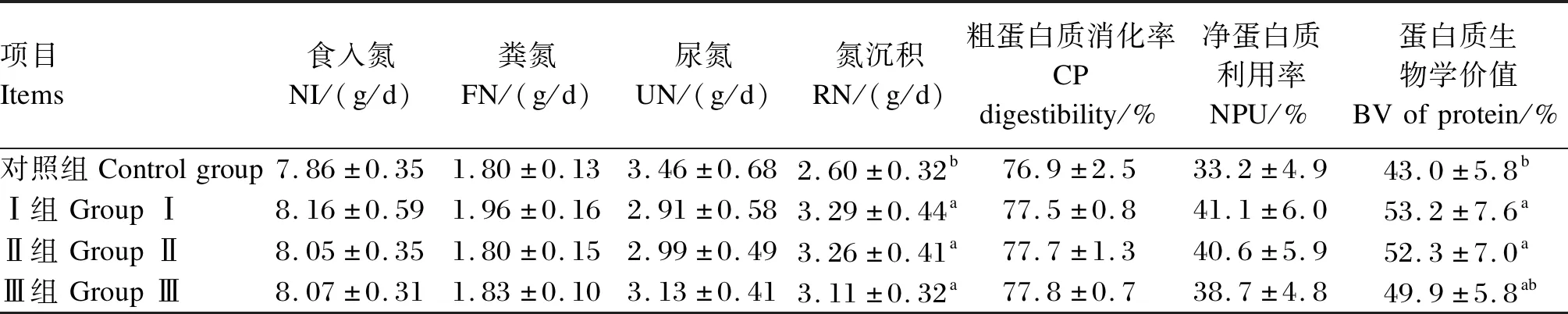
表3 饲粮添加粪肠球菌对生长期乌苏里貉氮代谢的影响Table 3 Effects of dietary Enterococcus faecalis on nitrogen metabolism of growing Ussuri raccoon dogs

表4 饲粮添加粪肠球菌对生长期乌苏里貉血清生化指标的影响Table 4 Effects of dietary Enterococcus faecalis on serum biochemical indices of growing Ussuri raccoon dogs
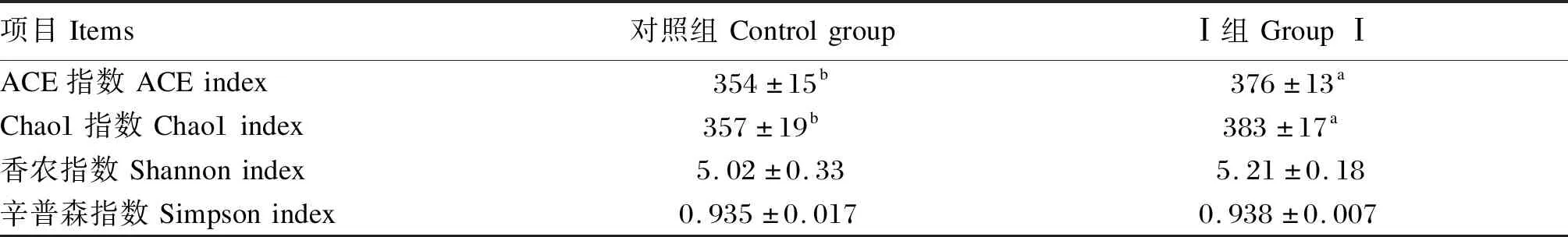
表5 饲粮添加粪肠球菌对生长期乌苏里貉粪便菌群物种多样性的影响Table 5 Effects of dietary Enterococcus faecalis on species diversity of fecal microbiota of growing Ussuri raccoon dogs

表6 饲粮添加粪肠球菌对生长期乌苏里貉粪便优势菌群门水平相对丰度的影响Table 6 Effects of dietary Enterococcus faecalis on relative abundance of fecal dominant microbiota at phylum level of growing Ussuri raccoon dogs %
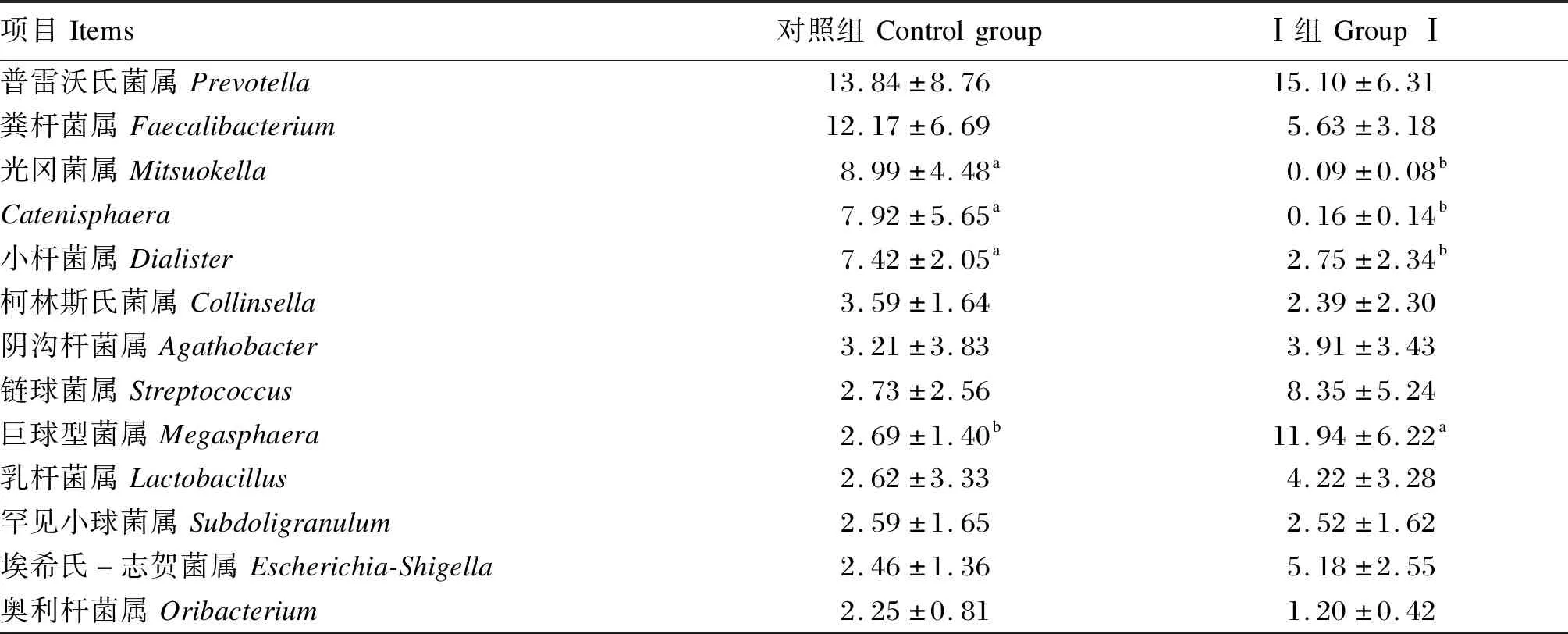
表7 饲粮添加粪肠球菌对生长期乌苏里貉粪便优势菌群属水平相对丰度的影响Table 7 Effects of dietary Enterococcus faecalis on relative abundance of fecal dominant microbiota at genus level of growing Ussuri raccoon dogs %
3 讨 论
3.1 饲粮添加粪肠球菌对生长期乌苏里貉生长性能的影响
粪肠球菌对断奶仔猪生长性能的影响并不一致。一些研究表明,粪肠球菌可以改善断奶仔猪生长性能[11],其他研究则认为没有影响仔猪生长性能指标[12]。这些差异可能是由于粪肠球菌的菌株和添加水平不同。研究表明,育成期蓝狐[5]和生长期水貂[6]饲粮中均以添加1×108CFU/kg粪肠球菌时生长性能最高,继续提高粪肠球菌添加水平,生长性能并未进一步提高,反而有所降低。本试验中,以饲粮添加1×108CFU/kg粪肠球菌时貉的生长性能指标表现最好,过量添加则可能破坏了肠道菌群平衡。
3.2 饲粮添加粪肠球菌对生长期乌苏里貉氮代谢的影响
粪肠球菌能够提高饲粮中干物质、粗蛋白质和能量的消化率[3],净蛋白质利用率也得到提高[5-6]。有研究表明,乳酸菌参与机体包括胆汁酸的肝肠循环、脂类的吸收、糖异生和蛋白质合成[13]。本试验中,3个粪肠球菌添加组粗蛋白质消化率虽未显著提高,但尿氮排泄量趋于降低,氮沉积量和蛋白质生物学价值升高,说明粪肠球菌促进了貉体内蛋白质的合成和利用。
3.3 饲粮添加粪肠球菌对生长期乌苏里貉血清生化指标的影响
目前,关于粪肠球菌对血清生化指标影响的报道不多。粪肠球菌使哺乳仔猪血清免疫球蛋白G(IgG)、免疫球蛋白A(IgA)含量显著升高,但对血清UN含量无显著影响[14];粪肠球菌使生长猪血清肌酐含量降低,对血清GLU、UN和TC含量也无显著影响[2]。本试验中,与对照组相比,Ⅰ组和Ⅱ组血清ALB含量提高,反映了机体合成蛋白质的能力增强,这与本试验中2组氮沉积量提高的结果相一致;3个粪肠球菌添加组血清UN含量提高,可能与其采食量提高,导致食入氮量增加有关。
3.4 饲粮添加粪肠球菌对生长期乌苏里貉粪便菌群的影响
ACE指数和Chao1指数表示菌群的丰富度,香农指数表示菌群的多样性。多数研究表明,粪肠球菌能够提高粪便菌群的丰富度和多样性[4,15];但也有试验表明粪肠球菌降低了粪便菌群的丰富度和多样性[16]。本试验中,与对照组相比,Ⅰ组生长期乌苏里貉粪便菌群ACE指数和Chao1指数显著提高,而香农指数和辛普森指数无显著差异,说明2组菌群结构相似,但粪肠球菌提高了菌群的丰富度。此外,与Pajarillo等[15]报道的粪肠球菌使断奶仔猪粪便中拟杆菌门相对丰度升高的结果一致,本研究中Ⅰ组拟杆菌门相对丰度较对照组显著提高,可能与其生长性能提高有关。乳酸杆菌作为肠道有益菌,在采用菌落培养方法研究益生菌对肠道菌群的影响中受到广泛关注,并有研究发现粪肠球菌可以提高粪便乳酸杆菌菌落数[2-3]。菌落培养方法只检测特定的微生物群落,导致研究范围有限。以细菌群落分析为目标的16S rRNA基因测序技术的出现,使大量不能培养的菌种被检出,从而能够更广泛地了解益生菌对微生物群落结构的影响。研究表明,采用16S rRNA基因测序技术发现粪肠球菌可增加粪便中乳杆菌属的相对丰度[14],但也有试验表明粪肠球菌并未使粪便菌群中乳杆菌属的相对丰度提高[17]。Hu等[11]利用RT-PCR技术发现粪肠球菌不影响粪便中细菌总数,但能提高乳杆菌属的相对丰度,而利用16S rRNA基因测序技术却未发现乳杆菌属组成和多样性出现差异。本研究与Hu等[11]一致,也未观察到粪肠球菌对乳杆菌属的影响,这可能与16S rRNA基因测序技术鉴定出的大多数不能培养的菌种均属于厚壁菌门有关[15]。巨球型菌属是肠道乳酸和糖发酵菌种,可产生短链脂肪酸,对营养物质消化和肠道健康具有重要作用[18]。目前对小杆菌属、Catenisphaera和光冈菌属的作用研究很少,但通过16S rRNA基因测序技术在猪粪中发现了潜在致病性的小杆菌属菌种[19]。Pajarillo等[15]报道,粪肠球菌使断奶仔猪粪便中大肠杆菌和小杆菌属相对丰度降低。本试验中,与对照组相比,Ⅰ组巨球型菌属相对丰度显著提高,小杆菌属相对丰度显著降低,这提示粪肠球菌可能通过促进有益菌的增殖和抑制潜在病原菌的生长来改善生长期乌苏里貉的生长性能和肠道菌群的平衡。
4 结 论
饲粮添加粪肠球菌能够提高生长期乌苏里貉生长性能,改善氮利用率,促进有益菌增殖,抑制潜在病原菌生长,添加水平以1×108CFU/kg较为适宜。
