羊肉多不饱和脂肪酸组成的影响因素及其营养调控
2022-11-15闫素梅孟凡珠刘树林
闫素梅 孟凡珠 刘树林
(内蒙古农业大学动物科学学院,内蒙古自治区高校动物营养与饲料科学重点实验室,呼和浩特 010018)
随着人们健康意识的提高,消费者对优质羊肉的需求与日俱增。羊肉的多不饱和脂肪酸(PUFA)组成与人类健康紧密相关,其中过高的饱和脂肪酸(SFA)和n-6 PUFA沉积会影响机体的胆固醇代谢,导致患心血管疾病的风险增加;n-3PUFA是激活脂质分解代谢和抑制脂肪生成的代谢转换器,尤其是C20∶5n3和C22∶6n3具有降低血脂、减少心脏疾病的发生并降低动脉粥样硬化的作用,防止肥胖症发生[1]。哺乳动物体内C20∶5n3和C22∶6n3的前体物C18∶3n3及C20∶4n6的前体物C18∶2n6均不能自身合成,而且C18∶3n3、C18∶2n6的延长和去饱和过程需要相同的酶,因此存在竞争关系[2]。体内n-6PUFA/n-3PUFA比值(n-6/n-3)的失衡可能导致生理功能失调甚至产生疾病[3],当人类膳食的不饱和脂肪酸(UFA)中,n-6/n-3小于5时,可有效预防癌症的发生[4-5];但目前人类的多数膳食中n-6PUFA充足,n-3PUFA缺乏,n-6/n-3较高,对人体健康不利[6]。因此,提高羊肉产品中的n-3PUFA含量、降低n-6/n-3对改进羊肉品质、优化人类膳食的PUFA组成具有重要的意义。本文主要从羊肉的PUFA组成特点和影响因素、提高羊肉n-3PUFA组成的营养措施及其调控机制等方面进行综述,为通过营养途径优化羊肉的PUFA组成进而提高营养价值提供理论参考。
1 羊肉的PUFA组成特点
尽管不同种类的羊肉脂肪酸(FA)组成存在显著差异,但其组成特点具有相似性,羊肉中主要的SFA、单不饱和脂肪酸(MUFA)、n-3PUFA、n-6PUFA分别是C16∶0和C18∶0、C18∶1c9、C18∶3n3、C18∶2n6,C18∶3n3的含量较高,为0.60%~2.69%(表1)。与其他动物肌肉相比,羊肉的n-6/n-3最低,C18∶3n3与n-3PUFA比例仅次于鸡肉和鱼肉(表2)。
2 羊肉PUFA组成的影响因素
2.1 动物因素
羊肉的PUFA组成因品种不同而异[8,14-15],并随着年龄的增加而降低,SFA含量及与膻味有关的FA则呈增加趋势[16-17]。羊肉的PUFA含量因性别不同而异,但研究结果不尽相同。如苏尼特羊羯羔的背最长肌、股二头肌和臂三头肌中C18∶3n3、C20∶5n3、n-3PUFA和n-3长链多不饱和脂肪酸(n-3LCPUFA)、n-6PUFA、n-6LCPUFA含量高于母羔[18],De Araújo等[19]、Lind等[20]的研究也得出了相似的结果。然而,绒山羊羯羊背最长肌n-3PUFA、C20∶5n3的含量均低于母羔,而皮下脂肪组织内的n-6/n-3则与之相反[21]。此外,羊肉的PUFA组成也存在部位的差异性[16,22]。
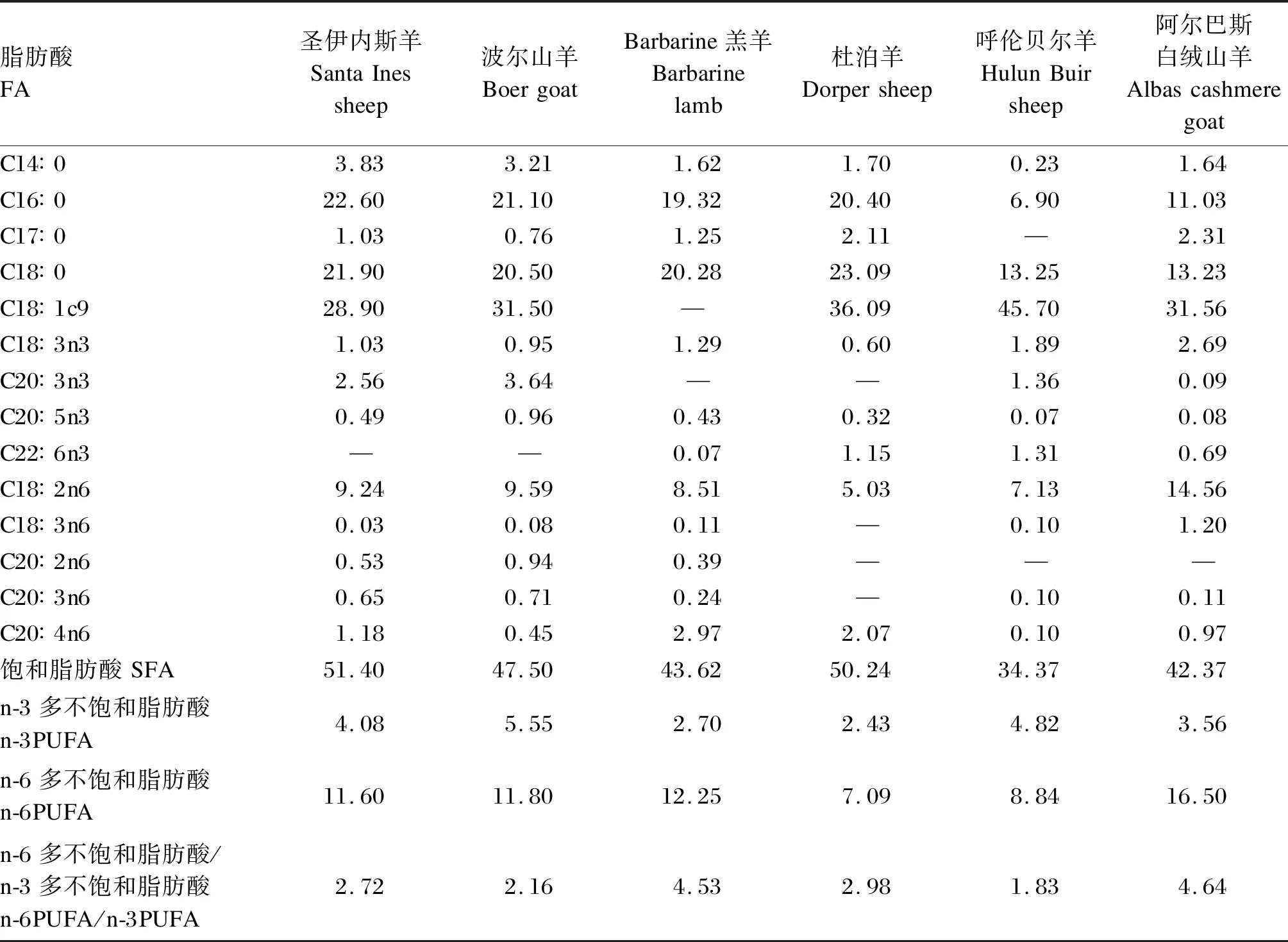
表1 羊肉的FA组成Table 1 FA composition of mutton[7] g/100 g
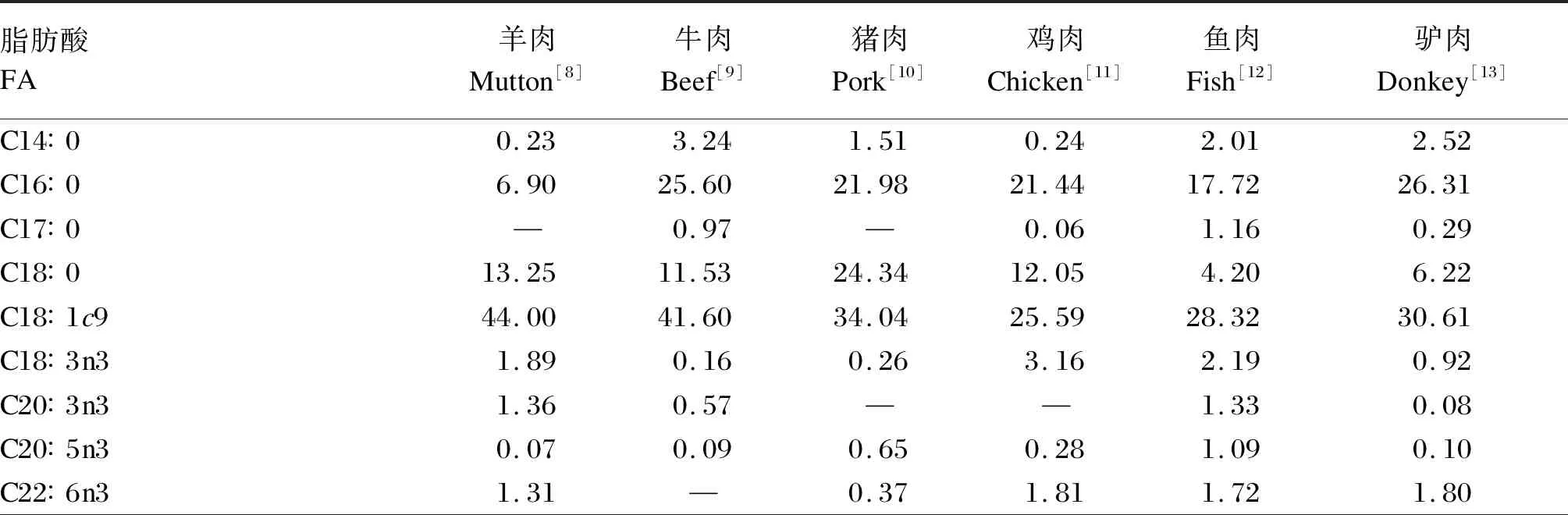
表2 不同动物肌肉中FA的组成(占总脂肪酸的百分比)Table 2 Composition of FA in muscle of different animals(percentage of total fatty acids) %
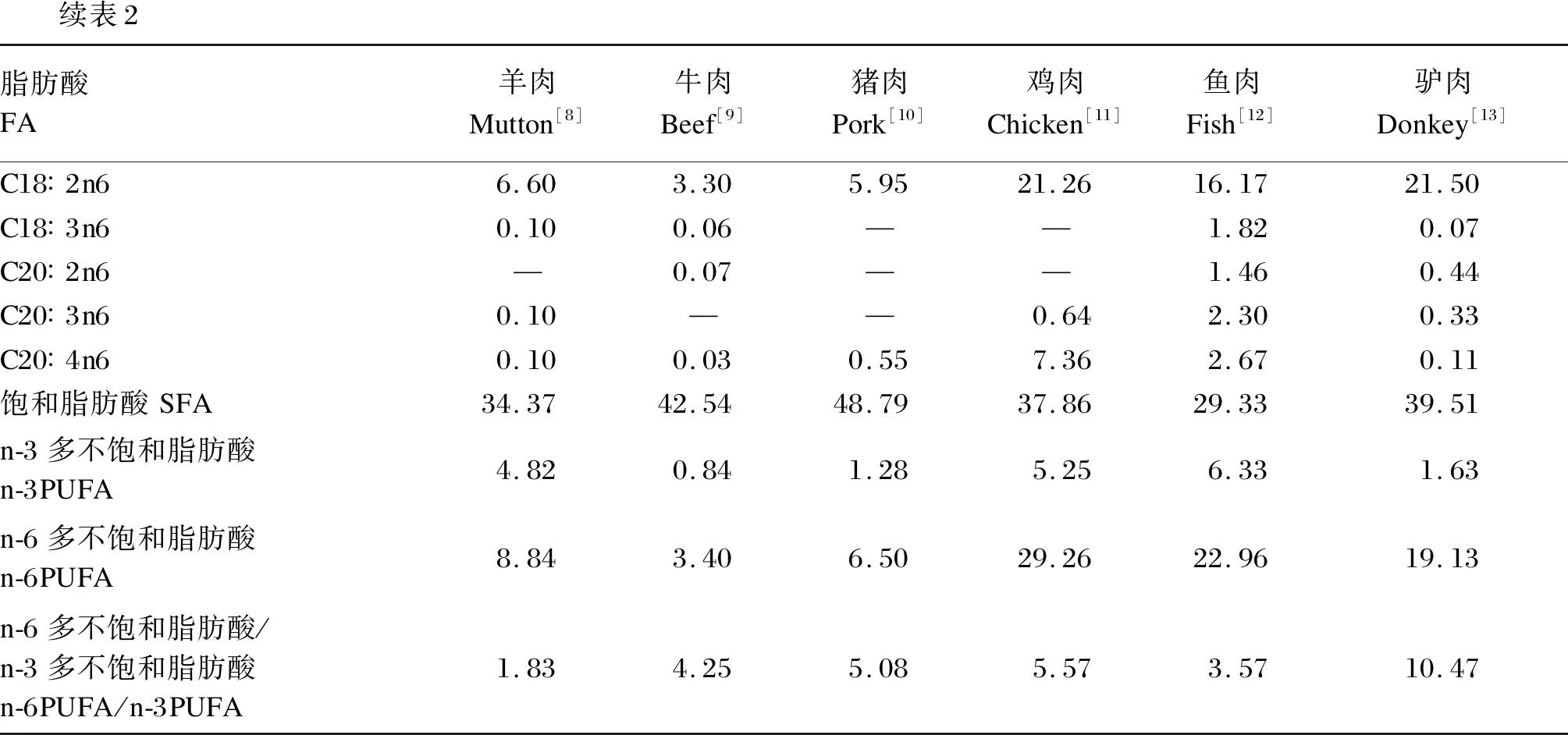
续表2脂肪酸FA羊肉Mutton[8]牛肉Beef[9]猪肉Pork[10]鸡肉Chicken[11]鱼肉Fish[12]驴肉Donkey[13]C18∶2n66.603.305.9521.2616.1721.50C18∶3n60.100.06——1.820.07C20∶2n6—0.07——1.460.44C20∶3n60.10——0.642.300.33C20∶4n60.100.030.557.362.670.11饱和脂肪酸SFA34.3742.5448.7937.8629.3339.51n-3多不饱和脂肪酸n-3PUFA4.820.841.285.256.331.63n-6多不饱和脂肪酸n-6PUFA8.843.406.5029.2622.9619.13n-6多不饱和脂肪酸/n-3多不饱和脂肪酸n-6PUFA/n-3PUFA1.834.255.085.573.5710.47
2.2 饲养方式
自然放牧饲养模式下的羊肉n-3PUFA含量高于放牧补饲及舍饲模式,这是由于天然牧草富含C20∶5n3和C22∶6n3的前体物C18∶3n3,放牧羊可摄取更多的C18∶3n3。Scerra等[23]的研究得出,与自然放牧相比,舍饲降低了意大利美利奴羔羊肉的PUFA含量,尤其是n-3PUFA含量;自然放牧组的滩羊羊肉n-3PUFA组成和含量都优于舍饲羊肉[24];与放牧补饲组相比,自然放牧组呼伦贝尔羔羊肉和绒山羊羔羊肉中有更多的n-3LCPUFA沉积[8,25]。
2.3 饲粮精粗比
国内外的多数研究结果显示,提高饲粮的精粗比,增加了羊肉的n-6PUFA含量,降低了n-3PUFA含量,引起n-6/n-3增加。Santos-silva等[26]研究发现,高精料育肥的羊肉中n-6/n-3显著高于放牧羊。卢盛勇等[27]研究也发现,精粗比为6∶4组的贵州白山羊羊肉中C18∶3n3含量低于精粗比为3∶7、4∶6和5∶5组,周力等[28]针对高原型藏公羊的研究也得出了相似的结果。高精料饲粮引起的羊肉n-3PUFA含量降低与其饲粮能量水平的增加有关。Wang等[29]研究发现,分别给湖羊饲喂5种不同能量水平的饲粮,背最长肌中C18∶1t9、C18∶3n3、n-3PUFA的比例随饲粮能量水平的升高而降低,n-6/n-3与之相反。然而,Jiao等[30]的研究表明,在低蛋白质(7%)条件下,随着饲粮能量水平由8.33 MJ/kg增加到11.57 MJ/kg,藏羊背最长肌中的n-3PUFA含量增加,n-6/n-3降低;但当饲粮能量水平由8.33 MJ/kg增加到9.33 MJ/kg时,小尾寒羊肌肉的n-3PUFA含量与n-6/n-3的变化规律与藏羊相似,当能量水平进一步增加到10.45和11.57 MJ/kg时,上述指标反而呈相反规律变化,这说明羊肉的n-3PUFA组成不仅与品种有关,还与饲粮的能量水平高低有关。目前相关的研究报道甚少,确切的原因需要进一步探讨。
2.4 冷应激与热应激
目前关于冷应激与热应激对肉羊生理指标、肌肉理化特性和生产性能影响的研究较多,但对羊肉PUFA组成的影响及其机理研究极其有限,需要深入探讨。Chauhan等[31]的研究发现,为期1周的热应激显著增加了羊肉中C18∶2n6和n-6PUFA的含量,但对C18∶3n3、C20∶5n3和C22∶6n3等n-3PUFA含量及n-6/n-3无显著的影响。汪骁轩等[32]的研究表明,冷应激增加了阿勒泰羊与杂交羊胸部脂肪中脂肪酸合成酶与脂蛋白脂酶的基因表达,对FA代谢和脂肪沉积产生了影响,但对羊肉FA组成产生的影响需进一步探讨。
3 羊肉PUFA组成的营养调控措施及其作用机制
天然放牧条件下生产的羊肉n-6/n-3低,且富含益于人体健康的n-3PUFA[33],备受人们青睐,然而,受产肉效率低、草原生态环境恶化和草场载畜力急剧下降的限制,使得产肉效率高、育肥周期短的舍饲育肥成为了主要的羊肉生产方式,但由此也引起了羊肉中C18∶3n3、C20∶5n3和C22∶6n3等n-3PUFA含量的下降和n-6/n-3的增加[25],降低了羊肉品质。因此,如何通过营养措施优化舍饲羊肉的PUFA组成是肉羊营养研究领域的焦点。体组织中沉积的PUFA来源于血液和组织自身合成2部分,饲粮的C18∶3n3经过瘤胃、肠道代谢吸收入血,运送至体组织和肝脏进行合成和转化;运送至肝脏合成的C20∶5n3和C22∶6n3等n-3PUFA可再次分泌入血运送到体组织进行转化和沉积[7,25,34]。因此,舍饲饲粮的C18∶3n3含量低于天然牧草是引起舍饲羊肉n-3PUFA含量低于放牧羊肉的主要原因之一。而且,饲粮中的C18∶3n3因在瘤胃中发生氢化作用以及在机体代谢过程中发生的脂质过氧化,不仅会降低其在组织中的沉积效率,还会导致C20∶5n3和C22∶6n3的合成减弱,因此如何提高肉羊对C18∶3n3的摄取量、增加C18∶3n3的过瘤胃保护、降低其脂质过氧化是增加羊肉n-3PUFA含量和优化PUFA组成的主要营养措施。
3.1 饲喂富含C18∶3n3的全粗料饲粮
在舍饲育肥条件下选择性地饲喂富含C18∶3n3的全粗料饲粮,增加C18∶3n3摄取量是优化羊肉n-3PUFA组成的主要营养措施之一。研究发现,饲喂全粗料饲粮的加勒比山羊虽然其产肉效率较补饲精饲料组降低,但肌内n-3PUFA的沉积增加[35]。与放牧补饲和全混合日粮舍饲相比,绒山羊采食富含C18∶3n3的全粗料饲粮,肌肉和脂肪组织中C20∶5n3和C18∶3n3等n-3PUFA的含量增加,SFA的含量与n-6/n-3降低;其影响机制是采食全粗料饲粮的肉羊增加了C18∶3n3的进食量与过瘤胃保护后进入小肠的量,进而增加了吸收入血的C18∶3n3量;并上调了肌肉与脂肪组织中与n-3PUFA合成、延长、去饱和相关的酶和转录因子的mRNA表达,如肝X受体α、过氧化物酶体增殖物激活受体α(PPARα)、脂肪酸去饱和酶1(FADS1)、FADS2、长链脂肪酸延长酶5(ELOVL5)、ELOVL2、脂肪酸转运蛋白4(SLC27A4)、酰基辅酶A氧化酶1(ACOX1)、L-双功能蛋白和固醇载体蛋白2(SCP2)等[34],促进了n-3PUFA在体组织的转化与沉积。
3.2 添加富含C18∶3n3的亚麻油
亚麻油富含C20∶5n3、C22∶6n3的前体C18∶3n3,含量高达50%。亚麻油可增加牛羊肉中C18∶3n3、C20∶5n3、C22∶6n3等n-3PUFA的含量,降低C20∶4n6、n-6 PUFA含量和n-6/n-3[36];Miltko等[37]及课题组前期研究也得出了类似的结果[38-40];其调节机制是亚麻油增加了肉羊对C18∶3n3的摄取量与血液吸收的量,上调了肝脏内参与n-3LCPUFA合成的部分脂类代谢相关酶活性及其基因FADS1、ELOVL2、ELOVL5、SLC27A4、肉毒碱棕榈酰转移酶1β(CPT1β)的表达,增加了肝脏合成分泌入血的n-3LCPUFA,促进了肌肉和脂肪组织对n-3LCPUFA的吸收。将瘤胃宏基因组、肠道微生物多样性、代谢组学、肝脏与肌肉的转录组学等结果进行多组学联合分析进一步得出,亚麻油改变了主要长链UFA氢化的瘤胃细菌属丰度和氢化途径,通过降低羊瘤胃中拟杆菌属_sp_CAG_1060(Bacteroides_sp_CAG_1060)、另枝菌属_sp_CAG_831(Alistipes_sp_CAG_831)和Flexilinea_flocculi的相对丰度和糖酵解代谢中酶1.2.7.11(2-氧戊二酸氧化还原酶亚单位)的活性,降低了C18∶3n3的氢化和脂质过氧化,促进了其过瘤胃保护效果;通过下调小肠中有害菌抗口臭致病菌属(Solobacterium)、醋肠菌属(Acetitomaculum)和假支杆菌属(Pseudoramibacter)的相对丰度,促进吸收入血的C18∶3n3;通过增加血液中的关键差异代谢物甘氨酸、谷氨酸和半胱氨酸的浓度促进C18∶3n3和C20∶5n3在小肠的吸收,通过上调谷胱甘肽代谢通路减少其脂质过氧化,增加血液中C18∶3n3、n-3PUFA和n-3LCPUFA的含量;通过LEPR/AMPK/SREBP1-L信号轴调节肝脏内C20∶5n3的合成;PPAR信号通路是亚麻油促进背最长肌组织中C18∶3n3的转运和沉积的关键代谢通路[7,41]。
3.3 添加富含C18∶3n3的亚麻籽
C18∶3n3容易氧化,且在瘤胃内易于被微生物大量氢化,因此反刍动物饲粮中直接添加富含C18∶3n3的油脂,会降低C18∶3n3的过瘤胃效果及其在肌肉和脂肪等体组织内的沉积效率和n-3LCPUFA的合成[40,42-43];过多的n-3PUFA会增加氧化应激的易感性[44],而氧化应激可引起肝脏内FADS5和FADS6等LCPUFA合成酶的基因表达下调,抑制了肝脏及体组织内LCPUFA的合成与沉积[45]。因此,减缓动物因摄取富含PUFA饲粮引起的氧化应激可优化体组织的PUFA组成。研究表明,饲粮中添加亚麻籽可以上调湖羊睾丸组织的抗氧化能力,使谷胱甘肽过氧化物酶4和铜锌超氧化物歧化酶的基因表达量增加[46]。饲粮中添加热处理的亚麻籽比添加生亚麻籽更易促进肉羊体组织内C18∶3n3及n-3LCPUFA的沉积,原因是热亚麻籽起到了抑制脂质过氧化的作用,增加了过瘤胃保护效果[38]。亚麻油和亚麻籽在饲粮中提供相同量的C18∶3n3,但亚麻籽对C18∶3n3和n-3PUFA在绒山羊体组织沉积的促进效果优于亚麻油,且只有亚麻籽能促进C22∶6n3的沉积[39-40]。通过对添加亚麻油和亚麻籽的肉羊体内代谢进行比较研究,并利用多组学技术进行联合分析阐明了其影响机制:1)亚麻籽通过增加瘤胃内C18∶2n6的氢化,降低C18∶3n3的氢化,对C18∶3n3起到了过瘤胃保护效果[40];通过降低C18∶3n3氢化参与菌的相对丰度,增加C20∶5n3、C20∶4n6和C22∶6n3氢化参与菌瘤胃球菌属_sp_CAG_177(Ruminococcus_sp_CAG_177)、瘤胃球菌属_sp_CAG_488(Ruminococcus_sp_CAG_488) 和瘤胃球菌属_sp_CAG_563(Ruminococcus_sp_CAG_563) 的相对丰度,增加了C18∶3n3的过瘤胃保护[7];2)亚麻籽通过上调小肠中有益菌粪杆菌真核菌属群(Eubacterium_coprostanoligenes_group)的定植,促进了C18∶3n3的吸收入血[41];亚麻籽通过PPAR信号通路上调了肌肉中参与n-3PUFA转运的相关因子PPARα、脂肪酸结合蛋白5和脂肪酸移位酶的基因表达量,增加了C18∶3n3和C22∶6n3的转运和吸收[7];3)亚麻籽通过上调肝脏中CPT1β的表达,增加了经肝脏合成分泌入血的C22∶6n3等n-3LCPUFA,并促进了体组织内参与n-3LCPUFA合成相关酶与转录因子的基因表达,促进了肌肉和脂肪组织内n-3LCPUFA的沉积[7,39];4)亚麻籽通过AMPK/PPARα信号通路促进UFA生物合成通路中与C22∶6n3的合成相关基因的表达,如超长链3-氧酰基辅酶A还原酶、ACOX1、超长链羟脂酰CoA脱水酶1(HACD1)、HACD2和SCP2的表达,进而促进了C22∶6n3的合成[7]。
3.4 棕榈油与富含C18∶3n3的油脂混合添加
棕榈油富含C18∶1c9,有限的研究指出,棕榈油与亚麻油等不同油脂的混合添加有利于优化产品的FA组成。如山羊饲粮中以棕榈油替代饲粮中20%的菜籽油,引起羊肉中的C16∶0、C14∶0和C18∶2n6含量降低,C18∶1c9、C18∶3n3和C20∶5n3含量增加[47]。体外研究指出,棕榈油替代亚麻油的1/3可显著提高亚麻油的抗氧化能力[48];利用富含C18∶1c9的油脂部分替换亚麻油,降低了C18∶3n3在瘤胃内的氢化[49],这些可能是棕榈油与其他油脂混合添加可优化产品PUFA组成的主要原因。课题组前期研究结果显示,绒山羊饲粮中以6∶4的比例添加亚麻油与棕榈油,可增加瘤胃内与脂类代谢相关的酶活性,减少瘤胃氢化菌的数量,增加瘤胃中C18∶3n3的含量,但进一步增加混合油组中亚麻油的比例时,瘤胃内C18∶3n3含量会逐渐降低[50-51]。Wang等[52]进一步比较研究发现,利用棕榈油替代饲粮中亚麻油的1/3,与单独添加亚麻油相比更易促进绒山羊体内C18∶3n3、C20∶5n3、C22∶6n3、n-3PUFA和n-3LCPUFA的沉积,其机制是:棕榈油富含的C18∶1c9增加了瘤胃内C18∶1c9氢化参与菌琥珀酸弧菌属(Succinivibrio)、琥珀酸弧菌科UCG-002(Succinivibrionaceae UCG-002)和未分类的拟杆菌科(unclassified_f_ Bacteroidetes)的相对丰度;降低了C18∶3n3氢化参与菌假丁酸弧菌属(Pseudobutyrivibrio)的相对丰度,即棕榈油部分替代亚麻油后,通过改变瘤胃菌群结构增加C18∶1c9的氢化,降低C18∶3n3的氢化及组织内C18∶3n3的氧化,进而对C18∶3n3起到了过瘤胃保护效果;通过提高肝脏、肌肉等体组织内与n-3LCPUFA合成相关的转录因子与酶的活性和基因表达,进而促进C18∶3n3与n-3LCPUFA的吸收及其在体内的沉积。此外,Muío等[53]研究表明,富含n-3PUFA的羔羊饲粮中补饲维生素E,其羊肉具有较低水平的脂质氧化且有更稳定的n-3PUFA比例。随着波尔山羊饲粮维生素E添加水平的升高,肉中C18∶1c9、C18∶3n3含量有增加趋势[54]。
综上所述,饲喂富含C18∶3n3的全粗料饲粮与油脂增加C18∶3n3供给、添加全油料籽实和保护剂降低C18∶3n3的脂质过氧化、增加C18∶3n3过瘤胃保护是优化羊肉中PUFA组成的主要途径,其调控机制主要与降低C18∶3n3的瘤胃氢化、减少其脂质过氧化、促进其吸收转运和合成有关,并解析得到了与这些调节过程有关的标志代谢物、信号通路和瘤胃氢化菌。今后还需进一步挖掘瘤胃氢化菌的功能、揭示C18∶3n3作为前体物促进n-3LCPUFA合成的分子调控机制,挖掘新的C18∶3n3保护剂,并从PUFA的氧化与抗氧化途径进一步探究其对体组织n-3PUFA沉积的营养调控机制,为通过营养调控手段优化羊肉的PUFA组成提供新思路。
4 小 结
本文主要从增加饲粮C18∶3n3供给、降低C18∶3n3的脂质过氧化、增加C18∶3n3过瘤胃保护的角度总结了提高羊肉PUFA组成的营养措施及其调控机制,为优化羊肉的PUFA组成提供了理论依据。进一步还需从PUFA的瘤胃氢化、氧化与抗氧化途径深入探讨其对体组织n-3PUFA沉积的调控机制,揭示其代谢路径,为通过营养措施优化羊肉PUFA组成提供新的视角。
