基于生信数据的Toll样受体4泛癌分析
2022-11-12华浩铭王凡璐黄江妮彭慧丁浩钟浩华马晶王居平
华浩铭,王凡璐,黄江妮,彭慧,丁浩,钟浩华,马晶,王居平
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院检验科,广西 百色 533000)
TLR4是人类发现的第一个TLR相关蛋白[1],它定位在9号染色体上。TLR4在接受包括脂多糖(lipopolysaccharide,LPS)在内的刺激后,形成CD14/TLR4/MD-2异质三聚体而活化,活化的TLR4经过一系列的信号传导发挥转录调控作用,从而参与炎症反应、抗病毒感染、调节免疫应答、促进免疫细胞活化等重要环节[2-4]。泛癌分析通过多组学系统整合分析,目的在于检查在不同肿瘤类型中已发现的基因组或蛋白质表达变化之间的相似性和差异[5]。本课题组一直在对TLRs蛋白进行研究,并报道了TLR4、宫颈癌和免疫球蛋白G之间的功能联系[6]。现有的研究结果尽管支持TLR4与不同类型的癌症之间存在联系,然而目前没有关于TLR4与各种癌症类型之间的具体关系的泛癌分析报道。本研究使用癌症基因组图谱(the cancer genome atlas,TCGA)和基因表达综合数据库(gene expression omnibus,GEO)分析了TLR4在肿瘤中的表达、生存预后的相关性、基因突变、CAFs和TLR4相关的生物学功能途径,为TLR4在不同癌症中的发病机制以及临床预后中的潜在分子机制提供了更加全面的理解。
1 资料和方法
1.1基因表达分析 检索HPA数据库获得了正常组织和细胞TLR4蛋白水平表达柱状图、TLR4在不同免疫细胞中的分布柱状图、单核细胞中TLR4 mRNA主要表达柱状图,其中单核细胞中TLR4 mRNA主要表达柱状图来源于Schmiedel数据集。检索Oncomine数据库和TIMER数据库分别得到不同癌症或特异性癌症亚型的肿瘤组织与邻近正常组织之间TLR4的表达差异。在数据库中没有正常对照组织或没有肿瘤组织的情况下如肾上腺皮质癌(TCGA-ACC)、脑低级别胶质瘤(TCGA-LGG)等,使用GEPIA2(gene expression profiling interactive analysis,version 2)网站和GTEx(genotype-tissue expression)数据库分别获得这些肿瘤组织与相应正常组织表达差异的箱线图。参数设置为:P-value cutoff=0.05,log2FC cutoff=1。使用UALCAN数据库根据临床参数(性别、癌症阶段、转移)评估并计算每百万转录本的值,用Log2(TPM+1)表示,绘制了在TCGA数据库中不同癌症患者中TLR4表达水平的箱线图。
1.2生存预后分析 用卡普兰-梅尔数据库(Kaplan-Meier Plotter)分析上述TCGA数据库的所有肿瘤,选择合适的表达阈值以区分高表达人群和低表达人群(Cutoff-High=50;Cutoff-Low=50),假设检验采用 Mentel-Cox检验,绘制单基因生存分析图(Kaplan-Meier曲线)。
1.3免疫浸润分析 TIMER是一个对不同免疫细胞的浸润水平进行全面的分析的公共网站,我们通过TIMER检索了TCGA数据库所有肿瘤中TLR4的表达与免疫浸润的关系,着重选择了CAFs进行详细分析,应用EP- IC、MCPCOUNTER、XCLL和TIDE算法进行免疫浸润评估。肿瘤纯度是本分析中主要的混杂因素[7],根据纯度调整后的Spearman’s等级相关检验得到P值和偏相关系(partialcorrelation,COR)值。数据以热图和散点图的形式展现。
1.4基因改变分析 使用cBioPortal工具收集所有TCGA肿瘤TLR4基因结构的突变频率、突变类型、突变位点信息和拷贝数改变。比较TLR4基因突变是否导致TCGA癌症病例中的总体生存率(overall survival,OS)、无病生存期(disease-free survival,DFS)、无进展生存期(progression-free survival,PFS)和疾病特异生存率(disease-specific survival,DSS)发生改变。
1.5TLR4相关基因富集分析 利用String数据库查询并选择蛋白质名称和物种,这里选择的是TLR4和人,然后最低关系分数设置为高可信度0.700,显示的交互对象的最大数量不超过50个,交互来源为实验。最后筛选得到了50个实验确定的与TLR4相互作用蛋白。随后使用GEPIA2基于TCGA+GTEx联合数据库筛选出与TLR4相关的前100个基因,并从中选取相关性高的基因与TLR4基因进行成对基因的 Pearson相关分析。散点图采用 log2TPM,给出P值和相关系数R。然后绘制所选基因的热图,图中包含R值和P值。为了进一步筛选基因,使用交互式韦恩图(Venn diagram)查看器Jvenn将以上100个基因与能和TLR4发生相互作用的50个基因进行交集分析,比较TLR4结合基因和相互作用基因。此外,把两组数据合并上传仙桃学术网站(www.xiantao.love)进行GO(gene ontoligy)/KEGG(kyoto encyclopedia of genes and genomes)通路分析,绘制相关气泡图和柱状图。
1.6统计学方法 使用SPSS 21.0软件进行统计学分析。成正态分布的两组计量资料比较用t检验,相关分析用Pearson相关分析。检验水准:α=0.05。
2 结果
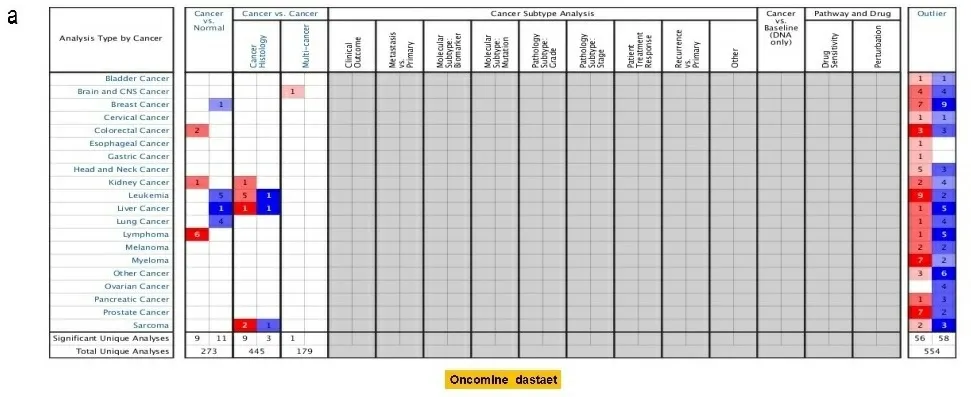
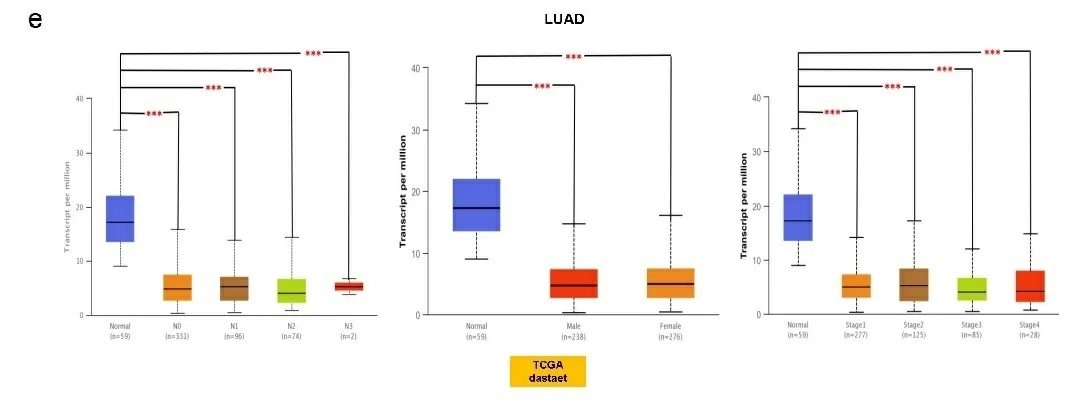
2.1基因表达分析结果 首先分析TLR4在不同细胞系和正常组织中的表达,根据HPA数据库显示,TLR4在骨髓中表达最高;其次是脾脏、淋巴结组织;大脑皮质、肾上腺、唾液腺食管、扁桃体呈现中等程度的表达。但是TLR4在除上述以外的组织几乎不表达,显示出了较高的组织特异性(见图1a)。在单核细胞中TLR4 mRNA主要表达在血细胞和部分器官的免疫细胞(如肝巨噬细胞)以及间质细胞中(见图1b)。此外,在分析HPA数据库中Schmiedel数据集时发现,TLR4 mRNA在不同血细胞中表达分布有相似的富集现象:即大多数在经典的单核细胞和非经典的单核细胞中表达较高,极少量在幼稚B细胞中,其他血细胞几乎没有(见图1c),这表明TLR4分布区域化的特性与它的生物功能密切相关。接下来,检索TIMER数据库和Oncomine数据库发现,TLR4在膀胱尿路上皮癌(bladder urothelial carcinoma,BLCA)、乳腺浸润癌(breast invasive carcinoma,BRCA)、胆管癌(cholangiocarcinoma,CHOL)、肾嫌色细胞癌(kidney Chromophobe,KICH)、肾乳头状细胞癌(kidney renal papillary cell carcinoma,KIRP)、肝细胞肝癌(liver hepatocellular carcinoma,LIHC)、肺腺癌(lung adenocarcinoma,LUAD)、肺鳞癌(lung squamous cell carcinoma,LUSC)、前列腺癌(prostate adenocarcinoma,PRAD)、甲状腺癌(thyroid carcinoma,THCA)、子宫内膜癌(uterine corpus endometrial carcinoma,UCEC)组织中的表达水平显著低于正常组织(P<0.05),在肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)、胃癌(stomach adenocarcinoma,STAD)组织中的表达显著高于正常组织(P<0.05)(见图2a和图2b)。将TCGA数据库中缺少正常组织对照的肿瘤联合GTEx数据库进一步评估分析发现,TLR4在肾上腺皮质癌(adrenocortical carcinoma,ACC)、宫颈癌(cervical squamous cell carcinoma and endocervical adenocarcinoma,CESC)、弥漫性大B细胞淋巴瘤(lymphoid neoplasm diffuse large b-cell lymphoma,DLBC)、胸腺癌(thymoma,THYM)、子宫肉瘤(uterine carcinosarcoma,UCS)表达水平显著低于正常组织(P<0.05)(见图2c)。TLR4在多形成性胶质细胞瘤(glioblastoma multiforme,GBM)、急性髓细胞样白血病(acute myeloid leukemia,LAML)、脑低级别胶质瘤(brain lower grade glioma,LGG)、胰腺癌(pancreatic adenocarcinoma,PAAD)中表达水平显著高于正常组织(P<0.05)(见图2d)。TLR4在卵巢浆液性囊腺癌(ovarian serous cystadenocarcinoma,OV)、嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma,PCPG)、肉瘤(sarcoma,SARC)、睾丸癌(testicular germ cell tumors,TGCT)中表达水平与正常组织相比没有显著性差异。此外在UALCAN数据库中,根据不同的临床参数研究了LUAD患者组间TLR4的表达。根据性别的不同,与相应的正常对照组相比,男性和女性肺腺癌患者都显著下降(P<0.05)。从肿瘤分期来看,在1、2、3、4期中TLR4表达也显著下降(P<0.05)。最后根据转移分期来看,LUAD患者在N0、N1、N2、N3阶段的TLR4表达也相应的下降(P<0.05)(见图2e)。其他肿瘤则没有发现差异。
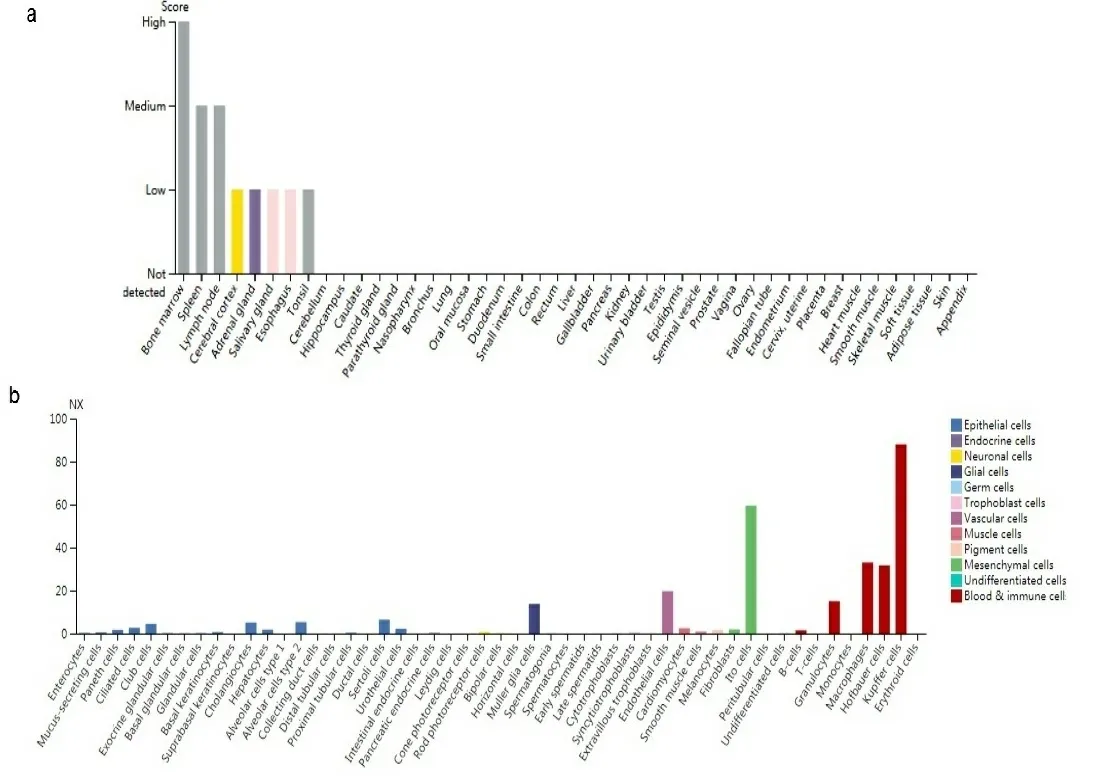
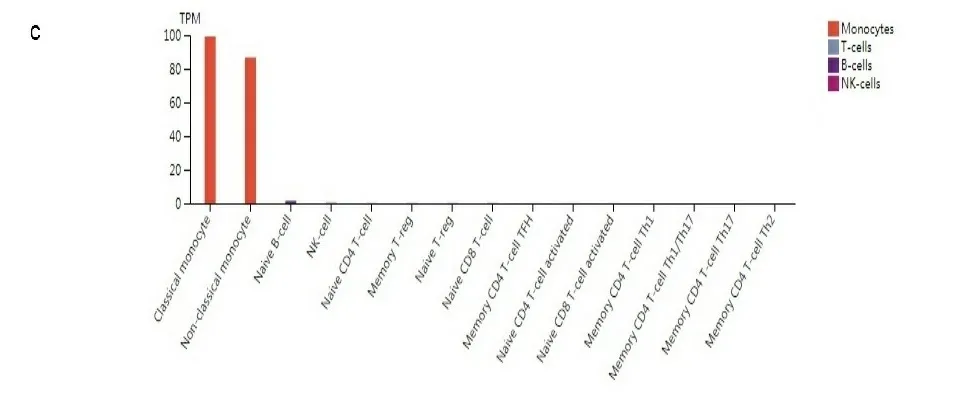
a:TLR4基因在不同组织中的表达;b:不同单核细胞中TLR4基因的表达;c:不同血细胞中TLR4基因的表达。数据基于HPA、GTEx和FANTOM5转录组学数据库。
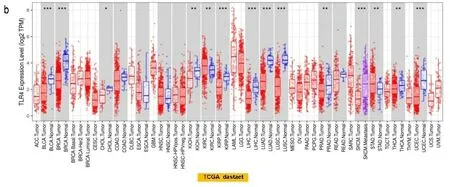
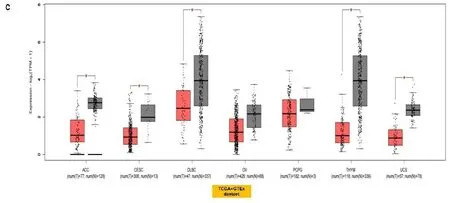
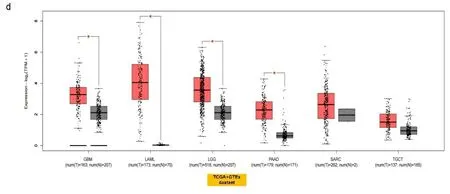
a:Oncomine数据库的肿瘤与邻近组织中TLR4的表达水平,*P<0.05;**P<0.01;***P<0.001;b:TIMER
2.2生存预后分析结果 由于TLR4的表达水平与癌症的发生发展密切相关,为了评估TLR4与肿瘤预后的关系,通过Kaplan-Meier Plotter数据库绘制了单基因生存分析图(见图3a),TLR4高表达会降低THCA、LUSC患者的OS,LUAD、UCEC患者的OS降低与TLR4低表达有关,与PCPG患者则无关。此外,从DFS数据来看,TLR4高表达与PAAD患者的DFS有关,BLCA、LIHC、UCEC患者的DFS与TLR4低表达有关,直肠腺癌(rectum adenocarcinoma,READ)患者的DFS则与TLR4表达无关(见图3b)。UCEC患者的TLR4低表达显示出总生存率和无病生存率降低的一致性。
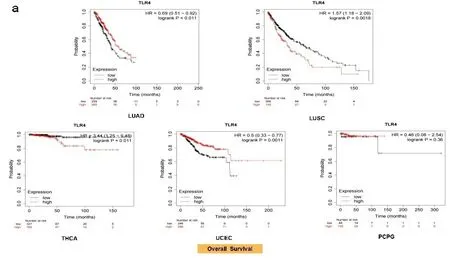
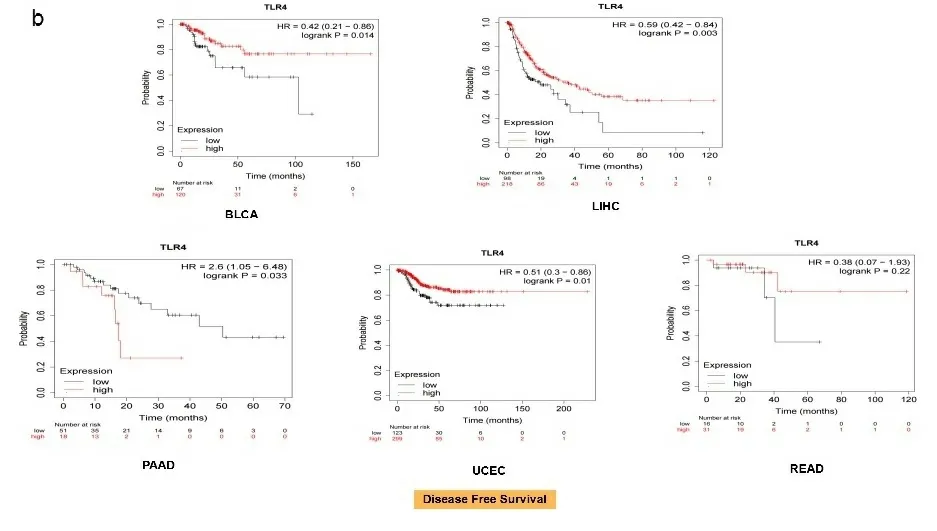
注:使用Kaplan-Meier Plotter数据库评估了所有TCGA肿瘤中TLR4基因表达与OS(a)、DFS(b)之间的关系,列出了Kaplan-Meier曲线结果。
2.3免疫浸润分析结果 TLR4通过激活下游通路Myd88/NF-κB/MMP2是经典的肿瘤转移通路[8],因此TLR4表达水平或基因突变可能影响肿瘤浸润性免疫细胞反应。肿瘤浸润性免疫细胞作为肿瘤微环境的重要组成部分,与癌症的发生发展密切相关。本研究应用EP- IC、MCPCOUNTER、XCLL、TIDE算法,探讨了不同肿瘤与CAFs之间的相关性(见图4a)。下面仅将TIDE算法的结果进行展示,如图4b所示,BRCA、BRCA-LumA、ESCA、HNSC、HNSC-HPV-、LIHC、LUAD、PAAD、PRAD、THYM中TLR4的表达与CAFs浸润都呈现正相关。
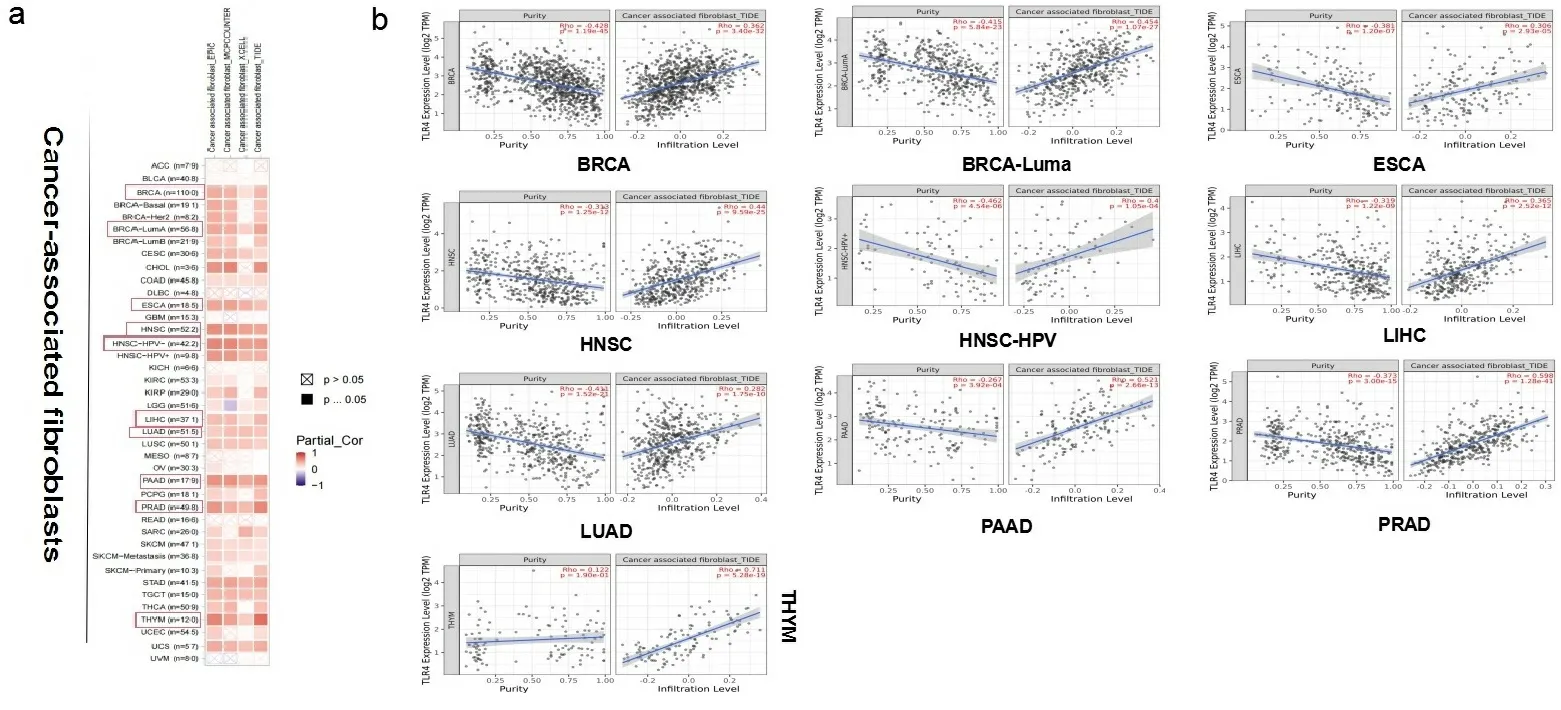
注:采用EP- IC、MCPCOUNTER、XCLL、TIDE算法分析TCGA中所有肿瘤中TLR4基因的表达水平与成纤维细胞浸润水平的相关性热图(a)和散点图(b)。
2.4基因改变分析结果 癌症的发展是由于基因突变的积累,在TCGA数据库的不同肿瘤样本中分析到了TLR4的基因变异情况。如图5a所示,大部分癌症都以TLR4基因突变为主要变异类型,在SKCM中TLR4基因突变占到了总突变的14%,LUAD同样占到了11%,值得关注的是KICH和KIRP则全部是TLR4扩增突变,1%胰腺癌则是TLR4拷贝数缺失导致。进一步分析显示,TLR4遗传变异类型大多数是错义突变,在8号锌指结构域中,有1例LUSC和2例SKCM检测出第111位点鸟嘌呤发生了错义突变(G111-missense)(见图5b)。进一步评估TLR4的某些基因突变对LUSC肿瘤患者的临床生存预后的影响,结果发现,有TLR4基因突变的LUSC患者的OS、DFS以及DSS与健康人相比无明显差别(见图5c)。
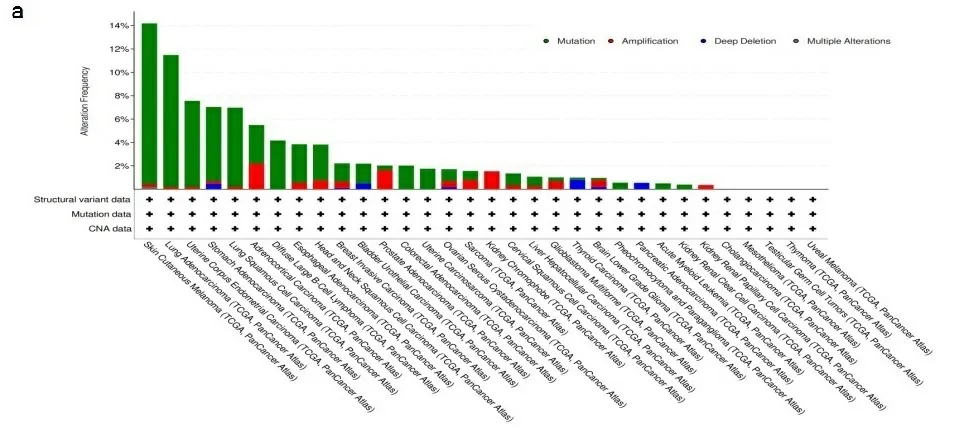

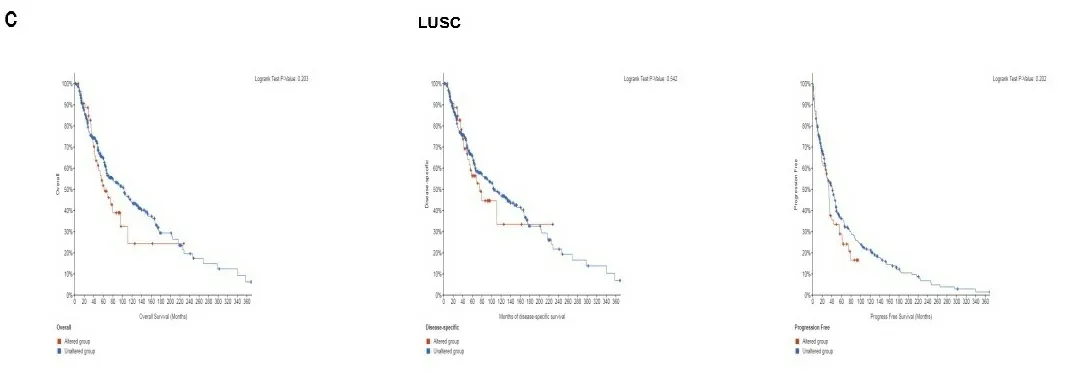
注:使用cBioPortal工具分析TCGA肿瘤中TLR4的突变状态,显示了突变类型(a)和突变位点(b)的变化频率;展示了突变位点(G111-missense)以及该突变位点与LUSC的OS、DSS和DFS之间的相关性(c)。
2.5富集分析结果 为了研究TLR4在肿瘤发生发展中的分子机制,筛选出已知的与TLR4相互作用蛋白和TLR4表达相关基因。使用String数据库,总共获得了50个与TLR4相互作用的蛋白质,图6a显示了这50个蛋白质的相互作用网络。然后利用GEPIA 2工具结合TCGA的所有肿瘤表达数据,获得与TLR4相关的前100位基因。本研究分析表明,TLR4与补体成分3a受体1(C3AR1)(R=0.66)、细胞色素B-β链(CYBB)(R=0.67)、线粒体E3泛素连接酶1(MARCH1)(R=0.68)、炎症小体4(NLRC4)(R=0.69)和胞外核苷酸ADP受体(P2RY13)(R=0.69)的表达水平呈正相关(P<0.001)(见图6b)。此外,热图数据显示,在大多数癌症类型中,TLR4与上述5个基因成正相关(见图6c)。进一步将TOP前100基因与前50个互作蛋白的基因做交集分析,最终筛选出了一位共同成员淋巴细胞抗原86(LY86)(见图6d)。进一步将上述两组数据合并进行GO和KEGG分析。KEGG分析显示TLR4在肿瘤发病机制中的作用可能与Toll样受体信号通路、人类免疫缺陷病毒1感染、MAPK信号通路、癌症中PD-L1的表达和PD-1检查点通路有关。GO分析显示,这些基因大多数参与免疫应答、DNA转录调控、翻译后修饰,肿瘤增殖、凋亡和自噬(见图6e和图6f)。
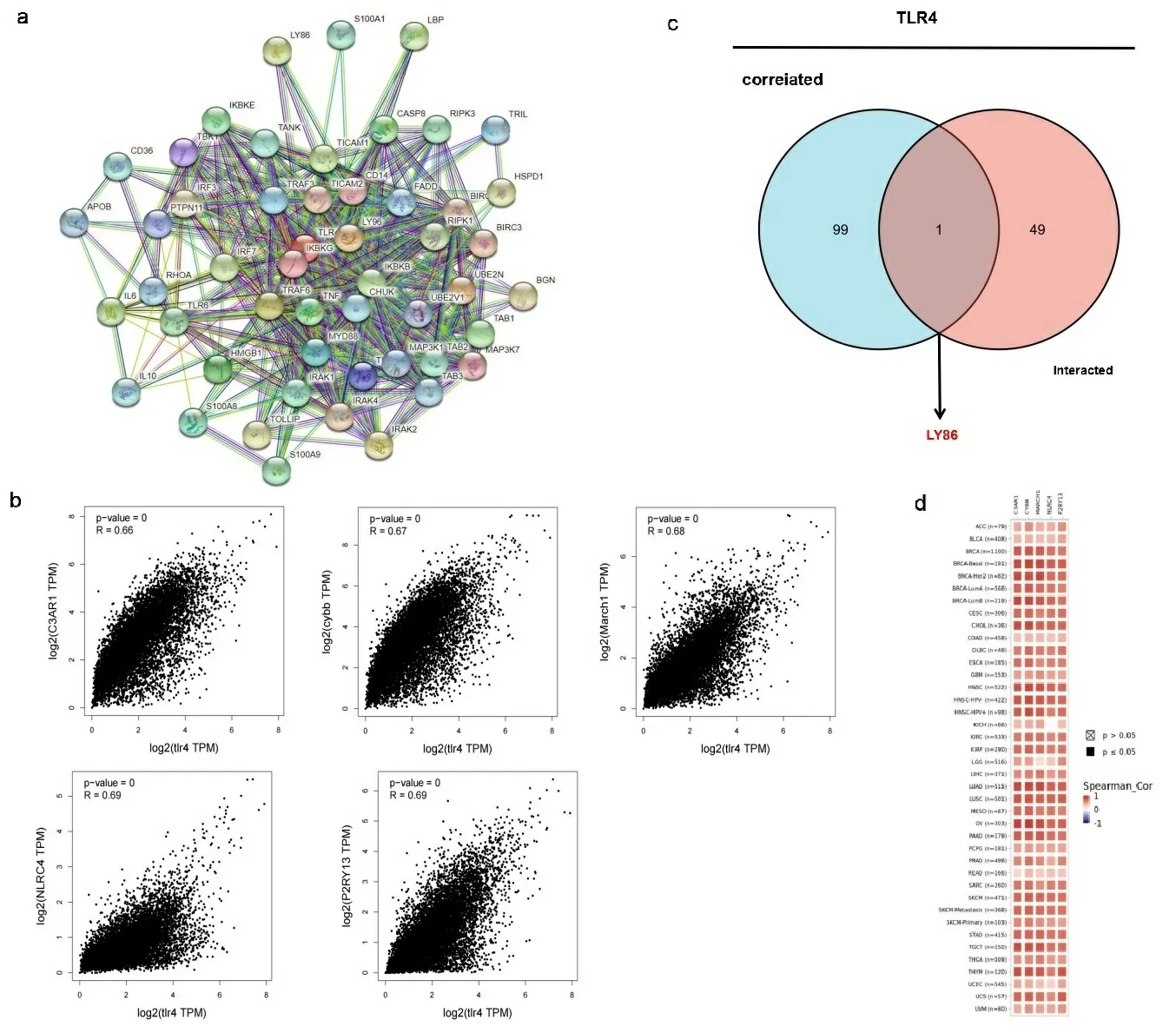
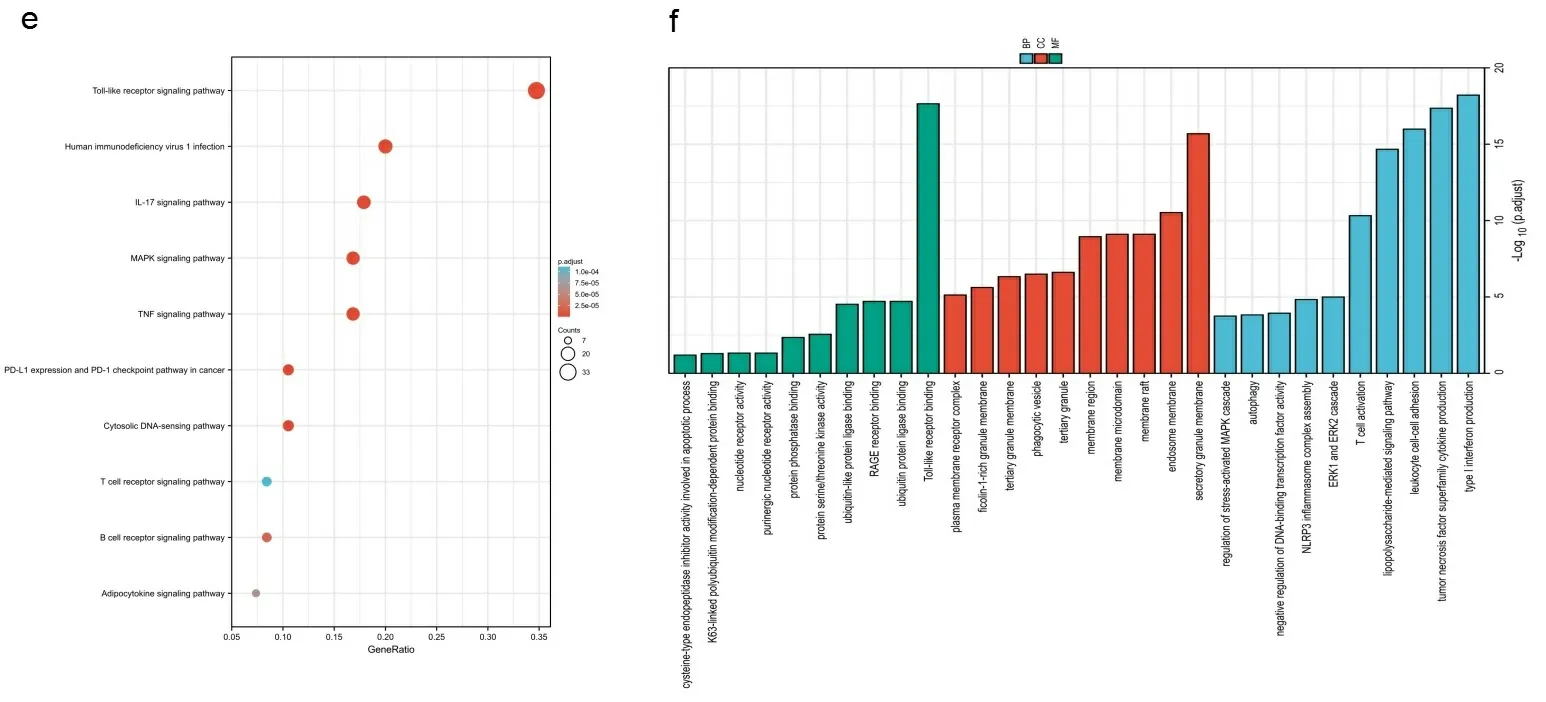
注:TLR4相互作用蛋白网络图;彩色节点表示已识别的单个蛋白质(a);通过GEPIA2检测的TCGA项目中TLR4与代表性基因(C3AR1、CYBB、MARCH1、NLRC4和P2RY13)的表达相关性(b),并绘制了相应的热图(c);TLR4相互作用蛋白的基因和相关基因的交叉分析图(d);TLR4相互作用和相关性基因的KEGG通路分析(e)和GO分析(f)。
3 讨论
自20世纪末TLR4发现之日起,关于TLR4的研究就从未停歇,先前的研究表明,TLR4是人体天然免疫重要组成部分,对机体免疫自稳有着不可替代的重要作用。随着研究的深入,越来越多的证据表明,TLR4在癌症中起着双刃剑的作用,TLR4一方面监视和杀灭肿瘤细胞,另一方面也“帮助”肿瘤细胞增殖、分化和转移。目前少有关于从整体角度对TLR4进行泛癌分析的报道,由此本研究基于HPA、TCGA、Kaplan-Meier Plotter等数据库从基因表达、基因变异等角度对不同肿瘤中的TLR4进行全面的分析[9]。
TLR4在人体组织中的表达呈现出了独特的组织特异性,即固有免疫器官和细胞的组织特异性,这与它的主要生物功能密不可分。同时,分析了TCGA数据库肿瘤组织中的TLR4表达水平,由于TCGA数据库缺失了部分正常组织的数据信息,因此补充了GTEx数据库中的正常组织作为参照一同分析。本研究分析表明,大多数癌组织(BLCA、BRCA、CHOL、KICH、KIRP、LIHC、LUAD、LUSC、PRAD、THCA、UCEC、ACC、CESC、DLBC、THYM、UCS)的TLR4表达水平显著低于正常组织,根据以往相关文献报道,结肠癌细胞表面表达TLR4,当被LPS激活时可诱导活性白细胞介素12p70(IL-12p70)的合成,IL-12p70对肿瘤诱导的细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的产生具有抑制作用。IL-12p70还可以激活体内NK细胞,诱导T细胞增殖,并促进对肿瘤的特异性CTL细胞的杀伤作用[10-12]。此外,牛分枝杆菌(卡介苗)通过TLR4促进树突状细胞成熟,增强对肿瘤细胞的识别,产生特异性活化诱导的细胞死亡反应,目前正用于治疗非肌肉浸润性膀胱癌[13];TLR4过表达抑制人皮肤鳞状细胞癌的体外增殖和迁移,延缓肿瘤在体内的生长[14]。但是也有文献报道,LPS通过TLR4/MD-2信号通路诱导胃癌细胞株SGC 7901的CXC趋化因子受体7表达,促进胃癌细胞的增殖和迁移[15];TLR4的表达与胰腺癌肿瘤大小和淋巴结转移呈常正相关,并且与HIF-1α信号通路协同促进胰腺癌的发展[16]。这些有争议的结果表明,TLR4在不同癌症类型或者癌症亚型中发挥着不同的作用。虽然在CPTAC数据库中没有检索到TLR4总蛋白和磷酸化数据结果,但这不意味着TLR4不能发生翻译后修饰,以往的文献表明TLR4可以发生磷酸化修饰[17],本课题组先前也发现TLR4可发生乙酰化修饰,该修饰正向调控NF-κB促进IL-6的产生[18]。
LANKI M A等[19]发现食管鳞状细胞癌组织中TLR4蛋白表达上调,其表达强度与预后不良及发育不良程度有关;在胰管腺癌中,TLR4可作为早期肿瘤患者预后的预测因子[20];在滤泡性甲状腺肿瘤中,TLR4与肿瘤的原发转移和侵袭性有关[21]。本研究对TLR4在癌症患者中的预后情况分析后也证实了TLR4高表达与THCA患者的预后不良有关(P=0.011)。此外,在子宫内膜癌患者中TLR4低表达显示了OS和DFS降低的一致性,为预测子宫内膜癌患者的整体生存提供了一个可能的临床生物标志物。Kaplan-Meier分析发现,不管TLR4基因是否突变都不直接影响肺鳞癌患者生存差异,以8号锌指结构域中第111号位点鸟嘌呤发生了错义突变为例,LUSC患者的OS、DFS、DSS无明显统计学意义,其主要原因可能是基因突变是随机的,其相同位点突变的病例数太少,因此需要更多的病例数来确定TLR4基因突变是否增加预后风险。
CAFs是肿瘤微环境中一类重要的非造血类基质细胞群体,某些炎症因子可促进CAFs活化,如白细胞介素-1通过NF-κB作用于JAK-STAT信号通路促进CAFs的激活[22]。CAFs能够调节肿瘤转移、细胞外基质和生长因子的产生、影响血管生成和对药物治疗产生耐药反应等,因此CAFs的活化与大部分癌症患者淋巴结转移和肿瘤分化不良密切相关。TLR4在绝大多数肿瘤中表达水平都与CAFs浸润呈明显正相关,这表明TLR4与CAFs浸润之间的相关性是癌症依赖性的,因此在CAFs介导的肿瘤转移中,肿瘤细胞可能会干扰TLR4正常功能进行免疫逃逸。TLR4除了参与经典的Toll样受体通路,还参与了B细胞和T细胞的适应性免疫应答通路。ARORA H等[23]研究表明,泛素化修饰也可以调控TLR4信号通路抑制脓毒血症导致的休克。KEGG和GO分析结果也显示,TLR4不仅仅局限在天然免疫信号通路调节中,还广泛的参与除上述以外的自噬、DNA转录水平调控、翻译后修饰和各种囊泡活动中,这表明TLR4具有广泛生物学活性和作为治疗靶点的价值。
综上所述,本研究通过多种生物信息学分析方法对TLR4进行泛癌分析。分析结果表明,TLR4在癌症中广泛低表达,与临床预后、CAFs浸润之间存在统计学相关性,这有助于人们从临床角度认识TLR4在肿瘤发生发展中所扮演的角色,至于TLR4基因突变与肿瘤患者的临床生存预后相关性还有待进一步探究。
