Balb/c裸鼠LNCaP细胞前列腺癌原位移植模型的建立及超声造影在肿瘤血管生成中的作用
2022-11-12王雨豪叶成坤刘卫勇
王雨豪,叶成坤,刘卫勇
(1. 皖南医学院,安徽 芜湖 241002;2. 中国科学技术大学附属第一医院神经外科,安徽 合肥 230001;3. 中国科学技术大学附属第一医院超声科,安徽 合肥 230001)
前列腺癌目前位于全球男性恶性肿瘤发病率第二位[1]。在中国肿瘤登记地区中,前列腺癌是中国男性泌尿生殖系统最常见恶性肿瘤之一[2]。据2020年全球癌症估计,男性前列腺癌发病率将高于肺癌,上升为第一位[3]。当前,前列腺癌已经成为严重影响男性生命健康的肿瘤之一。前列腺癌动物模型是研究前列腺癌发生发展不可或缺的重要工具,目前常用的有皮下移植模型和原位移植模型两种类型[4]。由于原位移植模型能更准确地模拟人类前列腺癌的自然发展过程,因而更常用于实验研究[5]。然而原位移植模型中,裸鼠前列腺体积小、解剖结构复杂,对操作者要求较高。PC-3、DU-145及LNCaP细胞是研究前列腺癌最常用的3种人类前列腺癌细胞,LNCaP细胞作为高表达雄激素受体(androgen receptor,AR)的细胞,常用于前列腺癌动物模型的构建,但成瘤率相对较低。因此,建立Balb/c裸鼠LNCaP细胞前列腺癌原位移植模型相对较困难。此外,原位肿瘤内血管生成与肿瘤侵袭性密切相关[6]。超声作为一种无创检查工具而被广泛用于观察肿瘤发生及相关血管分布情况,超声造影(contrast-enhanced ultrasound,CEUS)可对肿瘤微循环灌注进一步评估。本研究通过注射LNCaP细胞悬液构建前列腺癌原位移植模型,并采用超声对肿瘤模型中的血管分布进行监测,同时对肿瘤进行血管相关标志物分析、病理学检查,分析超声造影相关参数到达时间(arrival time,Atm)、到达峰值时间(time to peak,TtoPk)、造影曲线下面积(area under the curve,AuC)与肿瘤内血管生成之间的相关性,旨在为前列腺癌动物模型建立中血管分布及肿瘤侵袭提供依据。
1 材料与方法
1.1材料 LNCaP细胞购自中国科学院典型培养物保藏委员会细胞库,用体积配比为RPMI 1640培养基(90%+10%胎牛血清+双抗)进行培养。实验使用的动物为5周龄Balb/c雄性裸鼠,体重(16±0.5) g,购自上海斯莱克实验动物中心,动物合格证号为:20170005051694,动物级别为无特定病原体(specific pathogen free,SPF)级实验动物,饲养于中国科学技术大学生命科学学院动物实验中心,SPF条件下超净层流架内饲料及饮水自由摄入,在术前适应性喂养1周。RPMI 1640培养基购自美国Gibco公司,基质胶购自美国Corning BD biocoat公司,血小板内皮细胞粘附分子(platelet endothelial cell adhesion molecule-1,PECAM-1/CD31)抗体、血管内皮生长因子A(vascular endothelial growth factor,VEGF-A)抗体及AR抗体均购自美国Abcam公司,本研究已通过中国科学技术大学附属第一医院实验动物伦理委员会批准,伦理审批文书批号为:2021-N(A)-76。
1.2方法
1.2.1Balb/c裸鼠LNCaP细胞前列腺癌原位移植模型的建立 ①雄性Balb/c裸鼠用1%的戊巴比妥钠(10 mL/kg)腹腔内注射麻醉;②将麻醉好的裸鼠固定,用75%的酒精消毒下腹部皮肤,在下腹腹正中线处用外科手术剪切开腹膜后,打开裸鼠腹腔;缓慢推开大网膜及肠管后,可见淡黄色、球形膀胱,先使膀胱显露出来;向膀胱颈部两侧继续探查,可见一侧白色牛角形精囊腺,将精囊腺挤压出腹壁之外,继而探查对侧精囊腺,并将对侧精囊腺挤压出腹壁之外;将双侧精囊腺及膀胱向尾侧推压,在精囊腺根部的背侧、直肠前方可以发现粉红色的前列腺背侧叶,每侧左右径约1.4 mm;③取对数生长期细胞,用胰酶消化成单细胞悬液,细胞离心后,弃上清,加入500 μL无血清培养液,然后在冰上再加入500 μL基质胶,混匀制成约1 mL(3×108/mL)的LNCaP细胞悬液,采用50 μL可更换针头、30G的Hamilton微量进液器,吸取20 μL的细胞悬液(细胞计数5×106个)进行接种,轻轻将针头插入前列腺背侧叶包膜内,将细胞悬液推入,可见前列腺包膜隆起、透明,液体无明显外渗,退出针头;将精囊腺返回腹膜,用5-0编织可吸收缝线分别缝合腹壁和皮肤层。伤口用70%乙醇消毒。术后观察1 h,直至裸鼠完全苏醒。
1.2.2超声数据采集和分析 从构建模型后的第15天开始,用超声监测肿瘤的生长情况,每5天测量1次,直至第50天。采用GE BOOK便携式彩色超声诊断仪,使用8L-RS型超声探头,频率为5~20 MHz。首先超声探头涂抹适量预热的耦合剂,将探头置于裸鼠下腹壁,在裸鼠正中矢状面进行观察,找到无回声的膀胱后,轻微移动超声探头,在膀胱背侧找到低回声肿瘤结构,待图像稳定后,保存肿瘤的图像并测量肿瘤上下径及前后径然后轻微旋转探头至肿瘤横断面,测量肿瘤的左右径。肿瘤体积计算公式为:肿瘤体积(mm3)=瘤体上下径(mm)×前后径(mm)×左右径(mm)×0.52。
1.2.3CEUS检查 构建肿瘤模型后第50天,行CEUS检查评价肿瘤内血管灌注情况。首先采用灰阶超声对肿瘤进行观察并测量,然后用1 mL注射器给予裸鼠尾静脉注射(100 μL)造影剂SonoVue(意大利Bracco公司,25 mg冻干粉5 mL 0.9%生理盐水稀释)。保存120 s生成的原始数据,并使用量化软件(VueBox)对成像数据集进行分析。人工勾画一个感兴趣区域(region of interest,ROI),以在纵向平面上覆盖整个肿瘤。根据单个ROI中的信号强度仪器自动生成时间强度曲线(time intensity curve,TIC),测量并记录造影剂Atm、TtoPk、AuC等超声造影参数。
1.2.4病理学检查 裸鼠行二氧化碳窒息死亡,打开腹腔,切除原位肿瘤,用10%中性缓冲福尔马林固定,石蜡包埋,4 μM连续切片。组织病理学检查采用标准的苏木精-伊红(hematoxylin-eosin,HE)染色。免疫组化染色:切片在磷酸缓冲盐溶液中冷却并冲洗,在室温下在封闭液中孵育至少30 min,并与CD31、VEGF-A、AR抗体在4 ℃下过夜孵育。切片与适当的二级抗山羊、抗小鼠免疫球蛋白在室温下孵育常温摇床30 min,显色剂显色3~15 min;苏木精复染,脱水后中性树胶封片。利用Image J软件对免疫组织化学结果进行结果分析并计算出相应的平均光密度值(average optical density,AOD)。
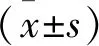
2 结果
2.1Balb/c裸鼠前列腺癌原位移植模型的建立及超声监测 术后24 h内,21只裸鼠全部苏醒,术后72 h观察裸鼠健康状态良好,2周后伤口愈合。如图1所示,原位前列腺肿瘤在接种后的第15天开始检测到,超声显示肿瘤位于膀胱后方,呈圆形均质低回声,边界清晰,与周围高回声的盆壁组织容易区别。随着肿瘤生长,肿瘤的回声结构、形状和位置发生变化。接种第28天,可观察到肿瘤突向膀胱。在随后的时间内,肿瘤由低回声逐步发展为椭圆形等回声结构,并有将膀胱推进腹腔前部的趋势。接种第50天时,原位肿瘤成瘤率为71.43%(15/21),平均体积为(288.81±76.49) mm3。见图1。
A和B:接种第15天和第50天,肿瘤从膀胱后方的一个低回声圆形结构发展为
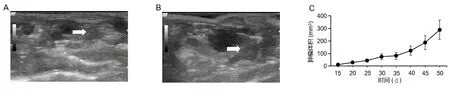
2.2CEUS检查 如图2所示,CEUS显示肿瘤呈早增强及高增强,1 s肿瘤周边开始增强,3 s肿瘤大部分区域增强,仅肿瘤中央少许未增强,10 s肿瘤完全增强,60 s肿瘤内部造影剂开始消退,90 s肿瘤大部分区域造影剂已消退。TIC造影曲线分析显示,平均Atm为(1.59±0.65) s,平均TtoPk为(11.59±3.68) s,平均AuC为(1933.91±454.38) dB。
A:原位前列腺肿瘤的CEUS图,早期肿瘤边缘比肿瘤组织内部增强更快,边缘呈环状征,随后逐渐减低;B:根据CEUS TIC曲线,绘制各个CEUS参数图(n=15)。
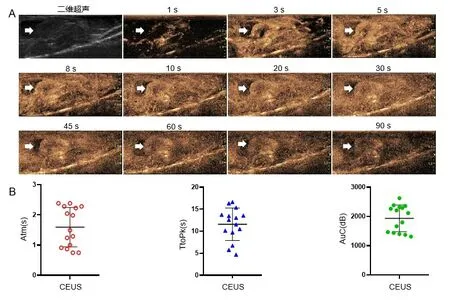
2.3肿瘤的病理及免疫组化特征分析 如图3所示,大体标本观察肿瘤呈椭圆形;肿瘤与周围组织边界清楚,局限于裸鼠单侧的前列腺背侧叶,圆形,棕黑色,有光泽而对侧背叶保持完整。HE染色显示肿瘤细胞体积较大,核大浓染,呈多形性,并有大量中性粒细胞浸润;肿瘤的边缘被较厚的纤维组织包裹。AR抗体染色结果显示肿瘤细胞强阳性,AR定位于细胞核内。如图4A所示,使用CD31抗体与VEGF-A抗体对原位前列腺肿瘤进行免疫组化染色,结果显示肿瘤内部有丰富的毛细血管。如图4B所示,利用Image J软件对免疫组织化学结果进行分析得出CD31和VEGF-A抗体染色的AOD值为0.39 0.06、0.45 0.05,并分别计算其与TIC中Atm、Ttopk及AuC相关性,结果如表1所示,CD31和VEGF-A与Atm、Ttopk及AuC具有正相关(P<0.05),提示CEUS可对肿瘤内血管分布进行无创检查。
3 讨论
为了建立接近于人前列腺癌体内自然生长过程的动物模型,利用裸鼠进行原位移植肿瘤模型的建立成为研究的热点[7],然而如何有效地建立前列腺癌裸鼠原位移植模型是模型建立的难点。一方面,由于不同品系的裸鼠前列腺形态上有所不同[8],因此需要将不同裸鼠的前列腺加以区分。另一方面,由于裸鼠前列腺较小[9],直径为3 mm左右,对手术者的操作要求较高。既往研究多采用组织插块法进行前列腺癌原位移植模型的建立[10],操作步骤是先将前列腺癌细胞接种至裸鼠皮下,6~8周形成皮下肿瘤后,再将瘤组织取出,切成1 mm3大小等体积组织块后,将裸鼠前列腺包膜切开,然后将组织块插入到裸鼠的前列腺内。这些研究操作上相对简单易行、成瘤率高,但存在一定的不足。一方面,由于肿瘤种植在皮下与原位的微环境不同,其肿瘤的基因及相关蛋白的表达存在明显差异[11],从皮下生长到裸鼠的前列腺内生长,肿瘤生长的微环境发生了较大的改变,肿瘤的基因会发生如甲基化等修饰,不能真实模拟人类前列腺癌的发生过程[12]。另一方面,组织插块法需要对裸鼠前列腺包膜切开,部分肿瘤可能会生长于裸鼠前列腺包膜之外。相比而言,肿瘤细胞注射法可能较好地避免这些问题。
A:左侧白色箭头所示原位肿瘤位置,肿瘤呈棕黑色,右侧白色三角箭头示牛角形精囊腺;B:(×20)上方红色三角箭头示肿瘤内见坏死区,下方红色箭头肿瘤边缘被均匀的纤维细胞覆盖;C:(×40)肿瘤细胞呈明显的异型性,细胞核大小不一,伴中性粒细胞浸润;D:(×40)人AR抗体免疫组化染色图。
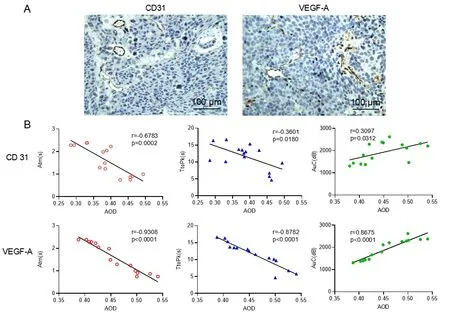
A:(×20)CD31和VEGF-A染色示意图;B:CD31和VEGF-A染色的AOD与Atm、Ttopk及AuC的相关性分析。

表1 CD31和VEGF-A与Atm、Ttopk及AuC的相关性分析
LNCaP细胞裸鼠移植模型的成瘤率较低,LNCaP细胞皮下移植模型在加入促进肿瘤生长的基质胶后,成瘤率也仅为44%~67%[13],而Balb/c裸鼠LNCaP细胞前列腺癌原位移植模型的成瘤率仅为60%[14-15]。本研究采用LNCaP细胞与基质胶混匀制成细胞悬液注入Balb/c裸鼠前列腺内,成瘤率达到71.43%,与以往研究结果相比肿瘤成瘤率有所提高。此外,裸鼠前列腺背叶与人类前列腺癌好发部位的周缘区相似[16],因此,本研究将肿瘤细胞悬液精准注入前列腺背叶内,能更好地模拟人类前列腺癌发生发展过程。
与皮下肿瘤可触及、易测量相比,原位肿瘤的监测是研究肿瘤生长的难题。以往研究多采用荧光生物医学光学成像监测肿瘤生长。然而,该检查方法较昂贵、费时,且原位肿瘤相对于皮下肿瘤位置较深,荧光成像的空间分辨率会随着组织厚度的增加而显著降低,不利于肿瘤显示。超声因具有便捷、无辐射、分辨率高等优点,能够实时监测原位前列腺肿瘤生长情况。本研究采用超声监测肿瘤生长,发现肿瘤细胞接种后第50天时,原位前列腺肿瘤体积为(288.81±76.49) mm3。既往研究表明,LNCaP细胞皮下移植肿瘤模型在肿瘤细胞接种后第56天时,肿瘤体积为(234.94±101.99) mm3[17]。本研究中原位肿瘤的体积大于皮下移植肿瘤体积,表明LNCaP细胞更适合于含有雄激素的裸鼠前列腺微环境内生长。
由于肿瘤血管生成与前列腺癌进展呈密切相关[18],CEUS恰恰可以观察到达微米级肿瘤微循环灌注情况。本研究发现,注射SonoVue造影剂后,原位前列腺肿瘤呈明显的早增强及高增强,造影剂自肿瘤周围向中央区域迅速灌注。TIC造影曲线分析显示,原位前列腺肿瘤的Atm为(1.59±0.65) s,TtoPk为(11.59±3.68) s,AuC为(1933.91±454.38) dB。有研究表明,Atm与肿瘤血管内径相关,反映肿瘤组织中微血管血流速度[19];TtoPk与内皮细胞通透性有关,反映肿瘤组织的微血管密度[19];AuC与区域血容量成正比,而血容量的增加是由于新血管形成[20]。本研究结果提示,LNCaP细胞在适宜的裸鼠前列腺内生长,肿瘤的血管化程度较高,这是肿瘤侵袭和转移的标志之一。
肿瘤的血管新生伴随着内皮细胞活化、增殖和迁移。VEGF作为一种有效的肿瘤血管生成因子[21],主要作用于与血管侵袭相关的血管内皮细胞[22],而VEGF-A与血管新生密切相关,能够刺激肿瘤血管的生长,为肿瘤提供所需的氧气和营养[6]。本研究中,通过原位前列腺肿瘤免疫组织化学染色,发现VEGF-A的AOD与Atm、Ttopk、AuC之间相关性为r=-0.931、r=-0.878、r=0.868,提示VEGF与CEUS之间具有显著相关性。血管生成常常导致内皮细胞蛋白表达的改变,CD31作为一种内皮细胞表达蛋白,通过激活肿瘤细胞与血管内皮细胞的结合,促进肿瘤血管生成[23]。通过实验,本研究发现CD31的AOD与Atm、Ttopk、AuC之间相关性为r=-0.678、r=-0.360、r=0.310,提示CD31蛋白表达与CEUS之间具有相关性;有研究发现[24],通过内皮细胞免疫组织化学染色来计算肿瘤内血管化程度有预后价值。因此,本研究结果提示,通过CEUS可评估前列腺肿瘤的血管新生程度,为监测肿瘤抗血管治疗的预后提供了新的思路。
综上所述,本研究采用细胞悬液注射法成功建立了LNCaP细胞原位移植模型,并提高了成瘤率。超声可以用于前列腺原位移植模型的肿瘤生长监测。在适宜的裸鼠前列腺微环境内,雄激素依赖的LNCaP肿瘤细胞形成丰富的微循环结构,较为真实地模拟了人类前列腺癌生长过程。以前列腺肿瘤的血管生成这一靶点,本研究可以为研究雄激素依赖的前列腺癌中涉及血管生成的生物学过程以及新型抗血管生成疗法的临床前评估提供动物模型依据。
