壳聚糖复合纳米载药体系的构建及其释药性能
2022-11-12李映璐王晓冉
赵 婧,崔 潞,李映璐,王晓冉,张 勇
(西安工程大学 环境与化学工程学院,陕西 西安 710048)
0 引 言
癌症是严重危害人类健康的疾病之一,也是最具挑战性的医学问题之一[1]。化疗是目前最主要的癌症治疗方式[2]。5-氟尿嘧啶(5-FU)作为常用的化疗药物,在体内先转化为氟尿嘧啶脱氧核苷酸,与还原型四氢叶酸及胸腺嘧啶核苷酸合成酶(TS)结合,干扰肿瘤细胞的核酸代谢,从而达到抑制恶性肿瘤细胞增殖的目的[3];丹参素钠(SAS)是从丹参根中提取的一类抗癌药物,具有抗氧化、抗炎、抗肿瘤等多效作用,已证实其具有抑制癌症恶性细胞的行为[4]。传统的化疗药物对正常细胞及组织毒副作用大、易分解,对癌细胞无特异性和排泄,半衰期短、生物利用率低、水溶性较差,静脉注射后可能导致栓塞和局部毒性,且面临多重耐药性等挑战[5-7]。因此,迫切需要寻找理想的药物输送体系,以克服上述存在的问题。纳米技术对生物医学和疾病诊断/治疗产生了极其重要的影响[8-10]。纳米药物载体凭借其小尺寸效应和独特的表面性质,增溶疏水药物的同时保护药物免受过早降解;消除体内生物屏障对药物的阻隔,提高其生物利用度;延长药物的停留时间,从而减少所需剂量,延长给药间隔[11-12]。此外,还可以通过增强渗透和滞留(EPR)效应,被动靶向至肿瘤组织,从而提高现有化疗药物在治疗癌症过程中的安全性和有效性[13-15]。
壳聚糖(CS)作为一种天然阳离子多糖,被认为是一种具有广泛医学应用前景的生物材料。由于其独特的生物相容性、抗菌抑菌、抗胆固醇、抗癌和黏膜黏附特性[16-18],不会引发人体的免疫排斥反应;同时,CS还具有生物降解性,可被溶菌酶和壳聚糖酶等内部酶降解,以获得低聚糖和单糖,随后被身体吸收;CS表面富有大量的反应活性位点,负载药物可以通过化学交联、静电吸附等多种作用方式,在药物表面形成一层“半透膜”,使得药物释放过程需要克服大分子骨架的阻碍,达到缓释控释的目的。CS是一种极具潜力的药物载体材料[19],不仅能够负载多种药物,包括大分子蛋白质/多肽、小分子亲水/亲脂抗癌药物以及DNA、miRNA、siRNA等[20-23],还可通过鼻腔、静脉、口腔和眼部等多种给药途径达到治疗目的[24-26]。
本文以阳离子多糖壳聚糖作为聚阳离子,N-异丙基丙烯酰胺和2-丙烯酰胺基-2-甲基丙磺酸的共聚物为聚阴离子,通过聚电解质复合法[27-30]制备壳聚糖纳米载药体系。在制备过程中分别负载5-氟尿嘧啶与丹参素钠2种模型药物,无需使用有机溶剂、化学交联剂或表面活性剂,具有毒性更小、安全性更高的优势,并实现长时间缓释控释,提高抗癌药物的治疗效果。
1 实 验
1.1 试剂与仪器
1.1.1 试剂
壳聚糖(CS,上海笛柏化学品技术有限公司,分析纯);N-异丙基丙烯酰胺(NIPAm,上海笛柏化学品技术有限公司,分析纯);2-丙烯酰胺基-2-甲基丙磺酸(AMPS,阿拉丁试剂有限公司,分析纯);偶氮二异庚腈(AVBN,阿拉丁试剂有限公司,分析纯);5-氟尿嘧啶(5-FU,西安优博生物试剂有限公司,分析纯);丹参素钠(C9H9NaO5,SAS,阿拉丁试剂有限公司,分析纯)。
1.1.2 仪器
傅里叶变换红外光谱仪(Nicolet5700,美国ThermoNicolet公司);场发射扫描电镜(Quanta-450,美国FEI公司);冷冻干燥机(FD-1,北京博医康实验仪器有限公司);恒温振荡器(SHA-C,常州市中贝仪器有限公司);紫外可见分光光度计(UV-2450,日本岛津公司);激光粒度仪(90Plus Zeta,布鲁克海文)。
1.2 材料的制备及表征
1.2.1 载药纳米颗粒条件优化
以N-异丙基丙烯酰胺(NIPAm)、2-丙烯酰胺基-2-甲基丙磺酸(AMPS)为单体,以偶氮二异庚腈为引发剂,采用自由基溶液聚合法合成阴离子聚合物NIPAm-co-AMPS, 即PNAM。采用混合法制备载药纳米颗粒,具体步骤如下:分别配制 CS醋酸溶液与PNAM水溶液,质量浓度为0.8 g/L,用1 mol/L的氢氧化钠调节pH至5.0左右;分别准确称取质量分数为30%、40%、50%的5-FU/SAS溶于CS醋酸溶液中,磁力搅拌2 h;然后将溶入药物的CS溶液以2 μL/s的速度缓慢滴入聚合物PNAM溶液中,体积比控制为5∶3; 滴加完毕后室温继续搅8 h,得到载药纳米颗粒分散液;将分散液用G1砂芯漏斗过滤除去大的聚集体,上清液用超滤离心管离心数次,直到滤液中无药物的紫外吸收;经水性滤膜过滤后,冷冻干燥得到纳米颗粒。壳聚糖纳米载药体系制备示意图如图1所示。

图 1 壳聚糖纳米载药体系的制备示意图Fig.1 Schematic diagram of chitosan nano drug delivery system
1.2.2 载药纳米颗粒的表征
1) 红外表征。取适量纳米颗粒粉末用KBr压片后,采用红外光谱仪在500~4 000 cm-1范围内进行扫描,测定其红外光谱。
2) 粒径大小及分布。分别调节5-FU/SAS不同药物投加量(质量分数分别为30%、40%、50%)、5-FU/SAS不同质量浓度(0.2、0.4、0.6、0.8、1.0 g/L),溶入5-FU或SAS的CS溶液与PNAM体积比(10∶1、10∶3、10∶5、10∶7、10∶9),制备壳聚糖载药纳米颗粒,用DLS测定其粒径尺寸及分布系数(PdI)。PdI值越小,说明粒径分布越均匀。
3) 尺寸及形貌表征。将载丹参素钠/5-氟尿嘧啶壳聚糖纳米颗粒分别分散在去离子水中,滴到铜网上,待干燥后,利用透射电镜(TEM)表征其尺寸及形貌。
1.3 载药量及包封率的测定
将冷冻干燥后的纳米颗粒溶解于1 mol/L HCl中,用紫外分光光度法测定纳米颗粒包裹5-FU和丹参素钠的量。通过测定样品最大吸收波长处(5-FU 266 nm、丹参素钠281 nm)的紫外吸收值并建立标准曲线,计算载药量(LC)和包封率(EE)。
式中:md为包裹于纳米颗粒中药物的质量;mn为载药纳米颗粒的质量;mt为药物加入总量。
1.4 体外药物控释性能
1.4.1 标准曲线的绘制
称取一定量的5-FU/SAS,分别用pH=4.0、7.4为缓冲溶液定容配制储备液,稀释成具有一定梯度的溶液,用紫外可见分光光度计测定样品最大吸收波长处的紫外吸收值。以5-FU/SAS质量浓度为横坐标,以最大吸收波长处的紫外吸收值为纵坐标,分别绘制5-FU/SAS在pH=4.0、7.4缓冲溶液中的工作曲线,从而得到线性拟合方程,用于定量计算。
1.4.2 体外药物控释性能
准确移取5 mL质量浓度为0.8 g/L的2种纳米颗粒分散液,置于截留相对分子质量为7.0 kDa的透析袋中,加入25 mL PBS缓冲溶液作为释放外液至离心管中。同时,将相同量的游离药物溶于一定量缓冲溶液中,置于100 r/min的恒温摇床上对药物进行控释实验。每隔一定时间从离心管中取出4.0 mL样品溶液,并补加4.0 mL对应缓冲液,研究药物初始投加量(质量分数30%、40%、50%)、温度(25 ℃、37 ℃)以及释放介质pH(4.0、7.4)对体外药物释放性能的影响。测试所移取样品溶液中5-FU在266 nm处、丹参素钠在281nm处的紫外吸收值,根据工作曲线计算一定时间内药物的累积释放率(Er);用零级动力学模型、一级动力学模型、Korsmeyer Peppas模型以及Higuchi模型模拟药物释放行为,初步评价其释药机理。Er计算公式为
式中:Va为透析液的置换体积;Vb为释放外液的总体积;Ci为第i次取样时释放液中药物的浓度;mdrug为用于控释的载药纳米颗粒中药物的质量;n为置换液的置换次数。
1.5 载药壳聚糖纳米颗粒的生物相容性
将DMEM培养液的pH调到7.2左右,过滤除菌,加入0.1 μm滤膜无菌过滤新生牛血清; 然后将L929细胞置于37 ℃的DMEM培养液中,在5% CO2培养箱中培养24 h; 再将L929细胞于96孔培养板中以5 000细胞/孔接种;加入不同浓度的壳聚糖纳米颗粒分散液,培养24 h后,用PBS溶液冲洗3次; 在倒置显微镜下观察细胞的形态变化及成长情况,评价载药壳聚糖纳米颗粒的生物相容性。
2 结果与讨论
2.1 壳聚糖纳米颗粒的红外表征
壳聚糖纳米颗粒的红外光谱如图2所示。
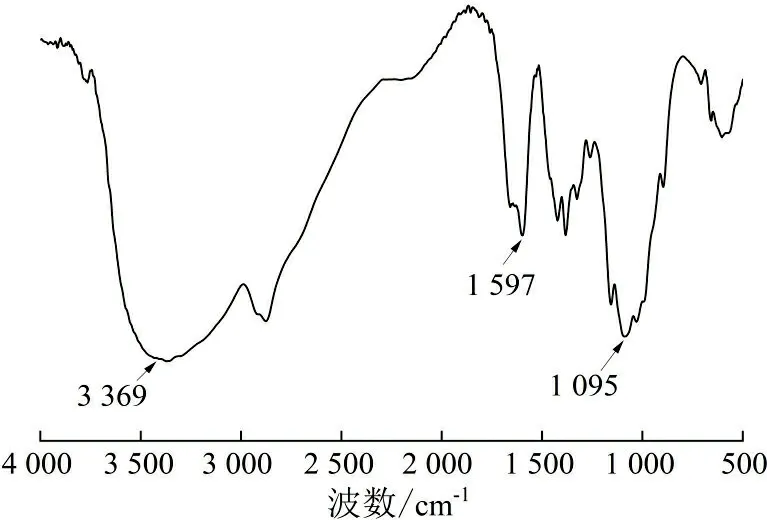
(a) 壳聚糖

(b) 壳聚糖纳米颗粒图 2 壳聚糖及壳聚糖纳米颗粒红外光谱图Fig.2 FTIR spectra of CS and CS nanoparticles

2.2 载药壳聚糖纳米颗粒的粒径分布
2.2.1 质量浓度的影响
聚电解质复合法制备壳聚糖复合纳米颗粒的形成主要包括3个步骤:静电相互作用形成一级复合物,新键生成或聚合物链间相互扭曲形成稳定复合物,疏水相互作用导致二级复合物间的聚集。以丹参素钠为例,壳聚糖与聚合物不同浓度下纳米颗粒粒径大小如表1所示。
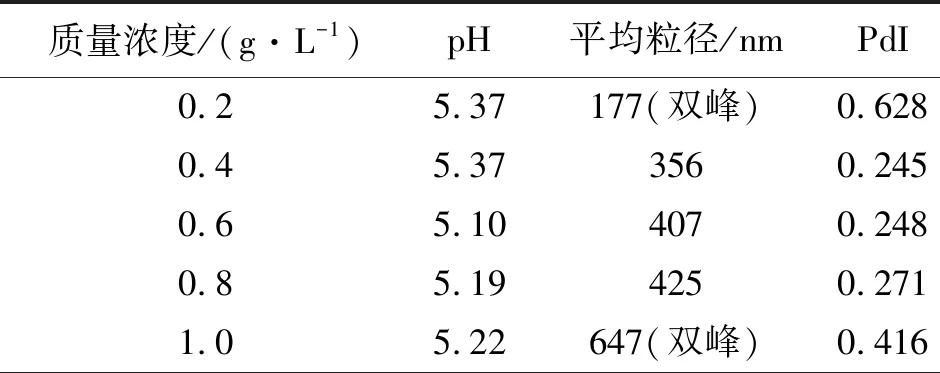
表 1 质量浓度对粒径的影响
由表1可以看出,在其他条件不变的情况下,随着质量浓度的升高,平均粒径有增大的趋势。浓度太低时,可反应的基团少,静电相互作用力弱,不易形成纳米颗粒;而浓度太高时,壳聚糖的黏度增大,壳聚糖本身分子链的缠绕会影响与聚合物之间的相互作用。当壳聚糖和聚合物质量浓度在0.4~0.8 g/L时粒径及其分布较好;质量浓度大于0.8 g/L时,壳聚糖溶液趋于黏稠并伴有沉淀产生,纳米颗粒粒径分布不均匀。考虑到实际应用,选择质量浓度为0.8 g/L制备载药壳聚糖纳米颗粒。
2.2.2 质量比的影响
纳米粒子的形成受静电相互作用的控制,CS氨基与聚合物磺酸基团之比是影响纳米颗粒粒径分布的主要因素之一。仍以丹参素钠为例,纳米颗粒粒径在不同壳聚糖与聚合物质量比下纳米颗粒粒径大小如表2所示。

表 2 质量比对粒径的影响
由表2可以看出,相同质量浓度(0.8 g/L)条件下,滴加的聚合物量太少,质量比小于10∶3时,溶液始终澄清,浓度太低,不足以使两者形成交联结构;随着质量比的增加,两者交联程度增加,形成纳米颗粒的趋势增加;但当质量比太大时,聚合物分子质量的增加,可能会包裹在纳米颗粒内部,粒径突然增大,最终导致沉淀。实验结果说明CS和聚合物滴加比在10∶5~10∶7之间效果较佳。
2.2.3 药物初始投加量的影响
药物初始投加量对载5-FU以及载丹参素钠壳聚糖纳米颗粒粒径大小如表3所示。

表 3 药物投加量对粒径的影响
由表3可以看出,随着药物初始投加量的增加,其平均粒径有增大的趋势,但其粒径分布仍然比较均一,PdI值较小。另外,载丹参素钠的壳聚糖纳米颗粒粒径比载5-FU体系略大,原因可能是由于丹参素钠与壳聚糖分子间本身一定的静电相互作用,使丹参素钠负载量高,粒径偏大。
与丹参素钠体系不同,5-FU有质子化和去质子化的潜在位点,依赖于随pH变化的中性、阳离子和阴离子间的多重平衡,以至少4种互变异构形式出现。5-FU在pH值3.1~4.5间带正电荷;随着pH值的增加,5-FU逐渐带负电荷[31]。影响壳聚糖与聚合物之间的相互作用,从而影响粒径和粒径分布。在pH值为5.0附近,5-FU基本呈现电中性,而此时壳聚糖分子链上的氨基质子化程度最高,与聚合物之间的静电相互作用增强,纳米颗粒结合相对紧密。通过实验得出,制备载5-FU壳聚糖纳米颗粒的最佳条件是质量浓度为0.8 g/L,质量比5∶3,此时可以形成粒径大小在400 nm左右的纳米载药颗粒。不同初始药物投加量下5-FU壳聚糖纳米颗粒的粒径分布如图3所示。由图3可知,随着初始投加量的增加,载药量随之增加,其粒径也逐渐增大。
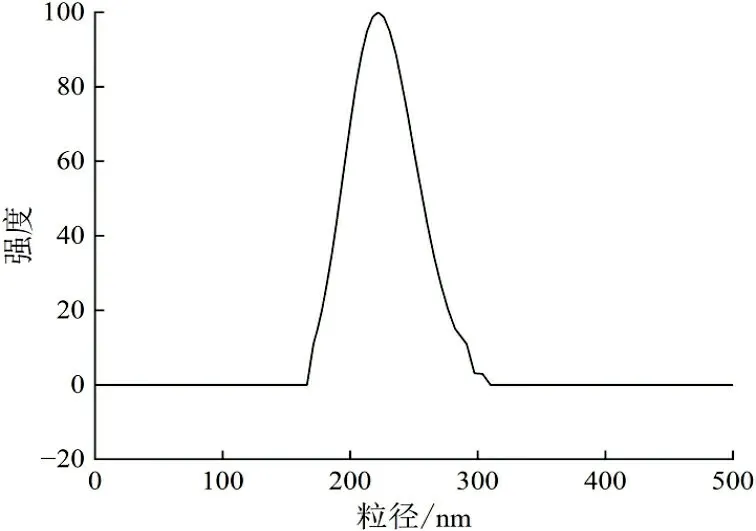
(a) 30%

(b) 40%
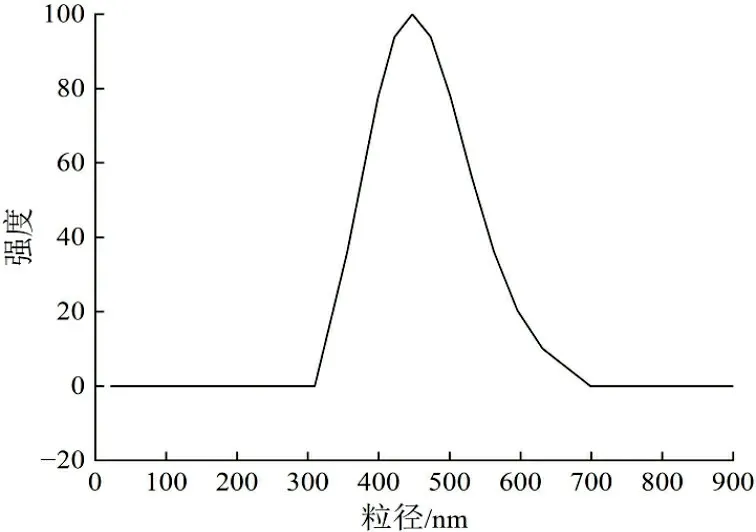
(c) 50%图 3 不同药物投加量载5-FU的粒径分布Fig.3 Particle size distribution of 5-FU with different drug dosage
2.3 负载药壳聚糖纳米颗粒的形貌表征
负载SAS/5-FU壳聚糖纳米颗粒的TEM如图4所示。

(a) SAS (b) 5-FU图 4 负载SAS/5-FU壳聚糖纳米颗粒的TEMFig.4 TEM images of SAS- and 5-FU-loaded CS nanoparticles
由图4可以看出,纳米颗粒分布均匀,分散性良好,呈致密球形结构。其致密结构可能归因于壳聚糖质子化的氨基与聚合物的磺酸基团之间的强静电相互作用。此外,负载SAS的CS纳米颗粒的尺寸[图4(a)]在300 nm左右,负载5-FU的CS纳米颗粒[图4(b)]的尺寸在250 nm左右。比DLS测定结果偏小,原因在于DLS测定的是水合粒径。
2.4 载药量和包封率的测定
2.4.1 载5-FU纳米颗粒
用紫外分光光度计测定5-氟尿嘧啶在1 mol/L HCl溶液中的工作曲线。拟合方程为
y=0.018+70.9x,R2=0.997
根据载药量和包封率的计算公式,得到如表4所示结果。
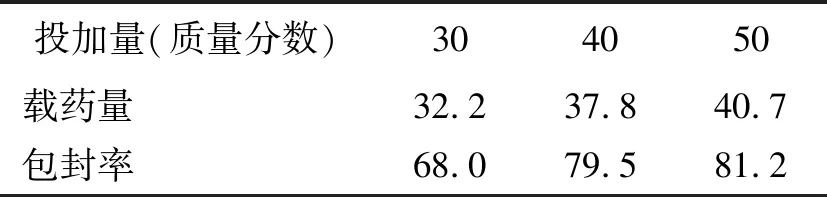
表 4 药物投加量对载5-FU载药量和包封率的影响
由表4可以看出,随着药物初始投加量的增加,其载药量和包封率都有所提高,一定程度上可以提高药物利用率。
2.4.2 载丹参素钠纳米颗粒
用紫外分光光度计测定丹参素钠在1 mol/L HCl溶液中的工作曲线。拟合方程为
y=0.123+13.6x,R2=0.998
然后根据载药量和包封率公式进行计算,结果如表5所示。
由表5可以看出,在药物初始投加量小于40%时,随着投加量的增加,载药量和包封率都随之增加。与载5-FU体系相比,载药量和包封率均较高。可能是由于丹参素钠在一定条件下带负电,与质子化的氨基间存在静电相互作用,导致载药量增大。与上述药物投加量对粒径的影响结果基本保持一致。而当初始投加量大于40%后,载药量和包封率反而有所下降。原因可能是由于纳米颗粒内部空间有限,几乎达到饱和。

表 5 药物投加量对SAS载药量和包封率的影响
此外,这种聚电解质复合法制备的纳米药物载体,更适宜负载一定条件下可以带电的药物分子,其载药量和包封率大幅度增加。这是由于在载药纳米颗粒的形成过程中,不仅有壳聚糖的氨基与聚合物磺酸基团之间的静电相互作用,还存在药物分子与壳聚糖/聚合物之间的相互作用,有利于载药量和包封率的增加,也有利于药物的释放行为。
2.5 壳聚糖纳米颗粒的药物控释性能
2.5.1 5-FU体外控释性能
1) 游离药物及载药纳米颗粒的体外药物释放。根据5-FU在pH=7.4缓冲溶液中的工作曲线,拟合方程为
y=0.040+58.0x,R2=0.998
可以计算游离药物以及药物投加量为40%的壳聚糖纳米颗粒的累积释放率,其累积释放曲线及拟合图如图5所示。
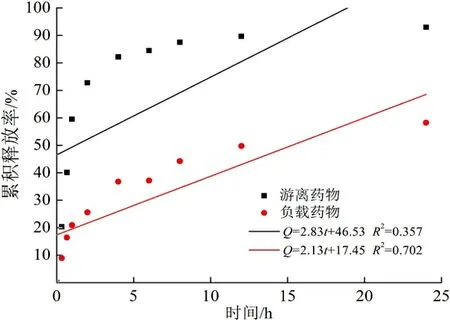
(a) 零级动力学释放模型

(b) 一级动力学释放模型
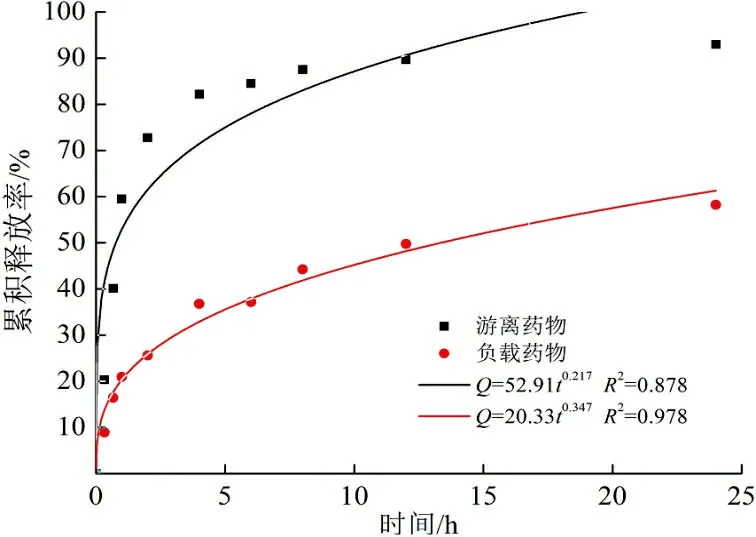
(c) Korsmeyer-Peppas模型
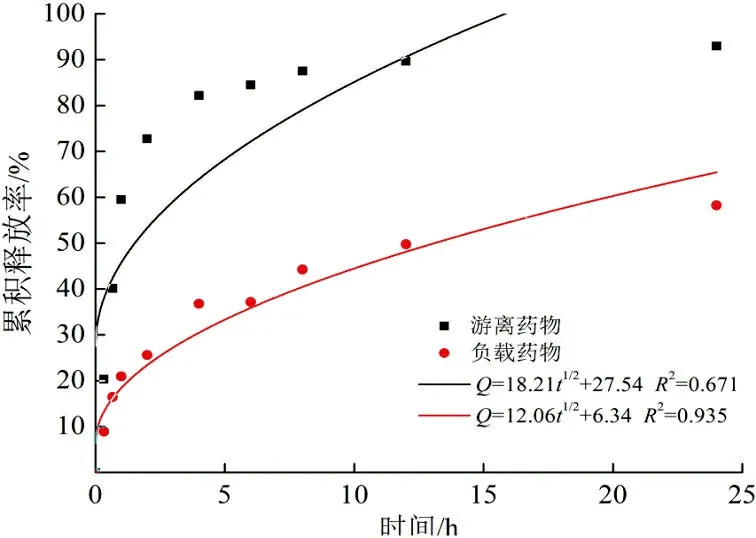
(d) Higuchi模型图 5 游离药物及载药纳米颗粒的控制释放曲线及模型拟合Fig.5 Controlled release profiles of free drug and drug-loaded nanoparticles
由图5可以看出:游离药物累积释放速率较快,2 h释放了70%以上;与游离药物相比,壳聚糖载药体系药物控释速率明显较慢,前1 h的突释是由于吸附在纳米颗粒表面的药物所导致,随后实现了缓慢释放。可能是由载体基质的降解和药物从聚合物基质的缓慢扩散引起的。10 h仅释放50%左右,说明壳聚糖载药纳米颗粒有明显的药物控释效果。药物在体内的突然释放可迅速达到有效治疗浓度,而持续释放可使药物停留在有效治疗浓度范围。用零级动力学、一级动力学、Korsmeyer-Peppas以及Higuchi模型分别进行了模拟。可以看出:游离药物的释放符合一级动力学模型,以药物分子的扩散释放为主,而载药纳米颗粒更符合Korsmeyer-Peppas模型,拟合度最高,扩散指数n<0.45。说明药物的释放为Fick扩散,溶剂渗透控制释放速率,而释放速率取决于释放介质pH以及纳米颗粒和药物之间的相互作用。
2) 释放介质pH对体外药物控释的影响。根据5-FU在pH=4.0缓冲溶液中的工作曲线,拟合方程为
y=0.001 5+56.6x,R2=0.998
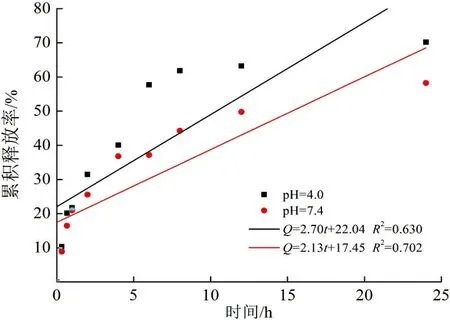
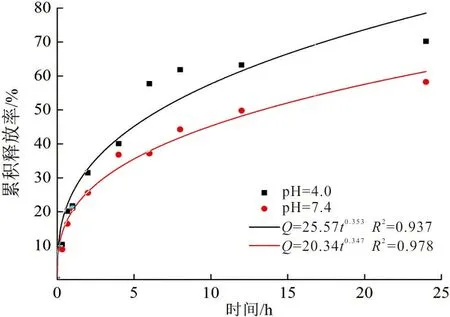
以及pH=7.4缓冲溶液中的工作曲线,可以计算当药物初始投加量为40%时,37 ℃条件下,不同释放介质pH下的累积释放率,如图6所示。
(a) 零级动力学释放模型

(b) 一级动力学释放模型
(c) Korsmeyer-Peppas模型

(d) Higuchi model模型图 6 pH释放介质对药物控释性能的影响及药物模型模拟Fig.6 Effects of pH medium on the controlled release properties and drug model simulation
由图6可以看出,在1 h左右,各pH条件下5-FU的释放速度都较快。可能是由于表面吸附一定量的药物导致开始有突释现象。1 h以后,释放介质为pH=4.0条件下释药速度较快。可能是由于在此条件下,聚合物离子化程度降低,电荷密度下降,使纳米颗粒结构较为松散。此外,pH=4.0时,5-FU可能带正电荷,与壳聚糖氨基之间的排斥作用,使得药物分子扩散速度较快,一级动力学释放模型拟合度较高;而在pH=7.4时,Korsmeyer Peppas模型拟合度最高。
3) 药物初始投加量对药物控释的影响。当释放介质为pH=7.4缓冲溶液、37 ℃条件下,不同药物初始投加量(30%、40%、50%)对壳聚糖纳米颗粒药物控释性能的影响如图7所示。
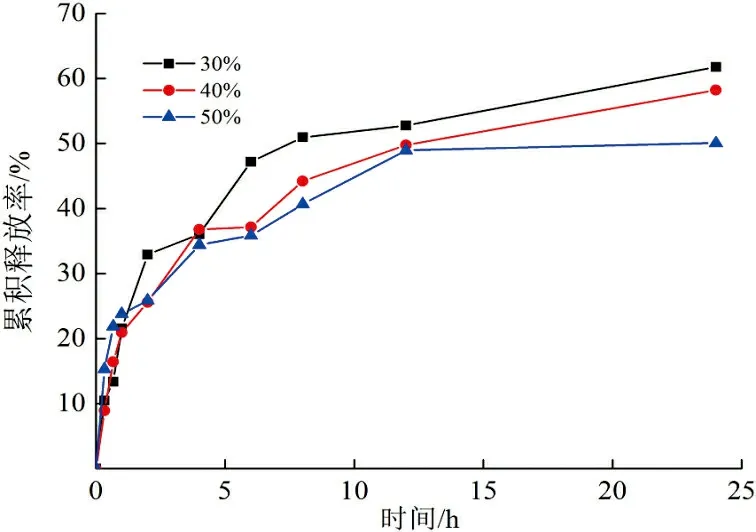
图 7 不同药物初始投加量对药物控释性能的影响Fig.7 Effects of different initial dosage of drugs on controlled release properties
由图7可以看出,在相同条件下,药物初始投加量低的载药体系,累积释放率较高,说明药物的释放量与其载药量有关。这是由于初始投加量低时,载药量低,药物分子更容易从纳米颗粒中释放出来;另外,此时纳米颗粒粒径较小,比表面积较大,在透析介质中逐渐结构疏松,导致累积释放率增大。
4) 温度对药物控释的影响。当释放介质为pH=7.4缓冲溶液、药物初始投加量为50%时,不同温度(25 ℃、37 ℃)对壳聚糖纳米颗粒药物控释性能的影响如图8所示。
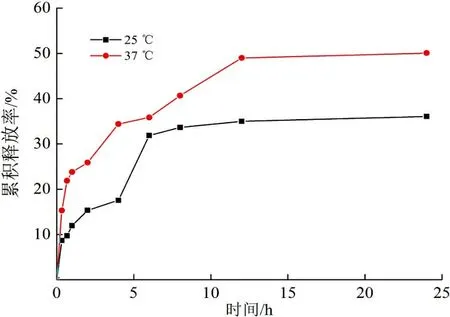
图 8 温度对药物控释性能的影响Fig.8 Effect of temperature on controlled release properties of chitosan nanoparticles
由图8可以看出:37 ℃时壳聚糖纳米颗粒释药速度明显大于在25 ℃,2 h内释药达到25%;而在25 ℃时,壳聚糖纳米颗粒2 h释药为15%。这可能是由于温度较高,载药纳米颗粒结构逐渐松散,使药物更容易释放出来。从另外一个角度分析,本文所使用的聚合物为温度敏感性聚合物,临界温度大约在34~37 ℃。在此温度下,聚合物分子链会更疏松,与壳聚糖结合力减弱,使药物更容易扩散。生理条件下释放较快,低温条件下释放速度缓慢,更易于其实际应用。
2.5.2 丹参素钠体外控释性能
1) 释放介质pH对体外药物控释的影响。根据丹参素钠在pH=4.0缓冲溶液中的工作曲线,拟合方程为
y=0.042+327.1x,R2=0.996
pH=7.4缓冲溶液中的工作曲线,拟合方程为
y=0.132+11.4x,R2=0.998
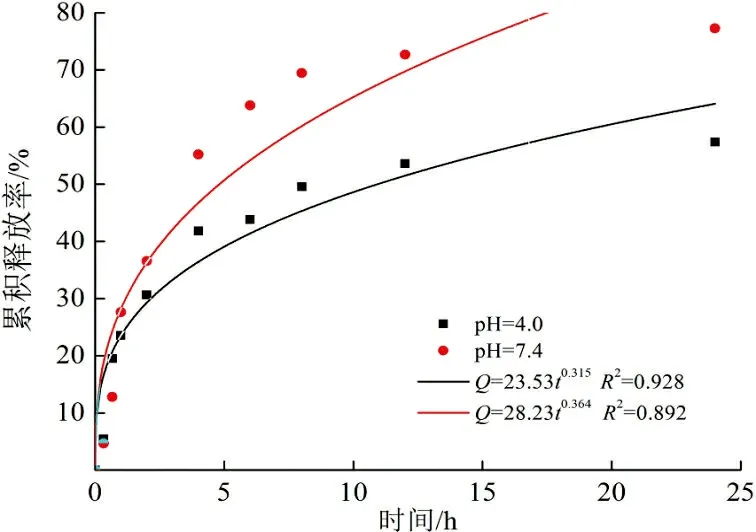
可以计算当药物初始投加量为40%,37 ℃条件下,不同释放介质pH下的药物累积释放率,如图9所示。

(a) 零级动力学释放模型

(b) 一级动力学释放模型
(c) Korsmeyer-Peppas模型
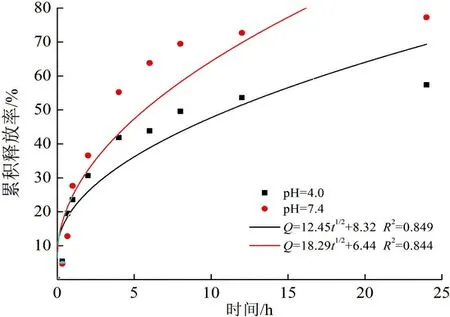
(d) Higuchi模型图 9 pH释放介质对药物控释性能的影响及药物模型模拟Fig.9 Effects of pH medium on the controlled release properties and drug model simulation
由图9可以看出,与载5-FU体系不同,SAS体系在pH=7.4条件下释放较快。这是因为丹参素钠是一种酸性药物且水溶性受pH值的影响较大。在pH=4.0下,壳聚糖分子链上的氨基质子化程度提高,与带负电的药物丹参素钠一级聚合物间的静电相互作用力更强,结合更紧密,阻碍了释放介质的渗透以及药物的释放,从而释放速率相对较慢。此时Korsmeyer-Peppas模型拟合度最高,以Fick扩散为主;而pH=7.4下,一级动力学模型拟合度最高,以分子扩散为主。此外,在pH=4.0条件下,24 h后药物累积释放率达到55%左右。说明这种方法构建的壳聚糖纳米载药体系不仅具有控释作用,也有一定的缓释作用,预计其可以减少给药次数,提高药物利用率。
2) 药物初始投加量对药物控释的影响。当释放介质为pH=7.4缓冲溶液,37 ℃下,不同药物初始投加量(30%、40%、50%)对壳聚糖纳米颗粒药物控释性能的影响如图10所示。

图 10 药物初始投加量对药物控释性能的影响Fig.10 Effects of different initial dosage of drugs on controlled release properties
由图10可以看出:丹参素钠在不同的投药量下的累积释放率与初始投加量的关系很紧密,当初始投加量是40%时,累积释放率最快。这与载药体系的载药量和包封率以及药物本身的属性有一定的联系:对于载丹参素钠体系,其初始投加量为40%时,载药量最高,粒径较大,药物释放所需要的阻力小。
3) 温度对药物控释的影响。当释放介质为pH=7.4缓冲溶液、药物初始投加量为50%时,不同温度(25 ℃、37 ℃)对壳聚糖纳米颗粒药物控释性能的影响如图11所示。
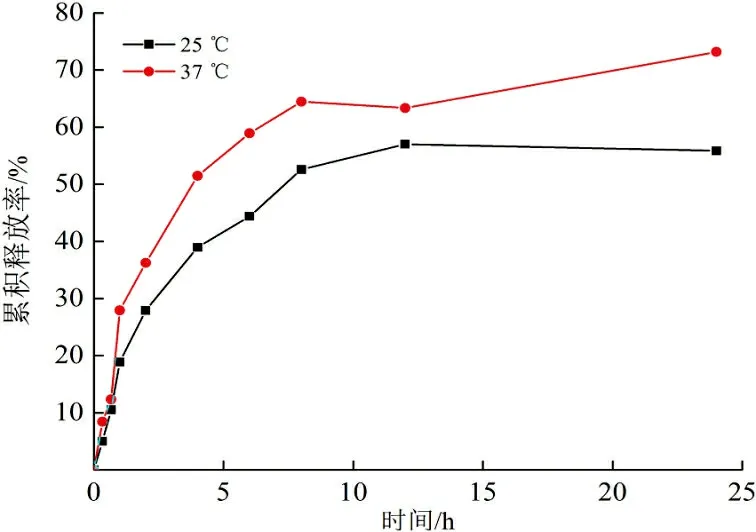
图 11 温度对药物控释性能的影响Fig.11 Effect of temperatures on controlled release properties
由图11 可以看出,温度对载丹参素钠与载5-FU的壳聚糖纳米颗粒释药性能的影响相同。37 ℃时,载丹参素钠壳聚糖纳米颗粒释放速度较快;低温下释放速度较慢,便于保存,更有利于实际应用。
2.6 载药壳聚糖纳米颗粒的生物相容性
在倒置显微镜下观察载药壳聚糖纳米颗粒与细胞培养24 h后的细胞形态变化,结果如图12所示。
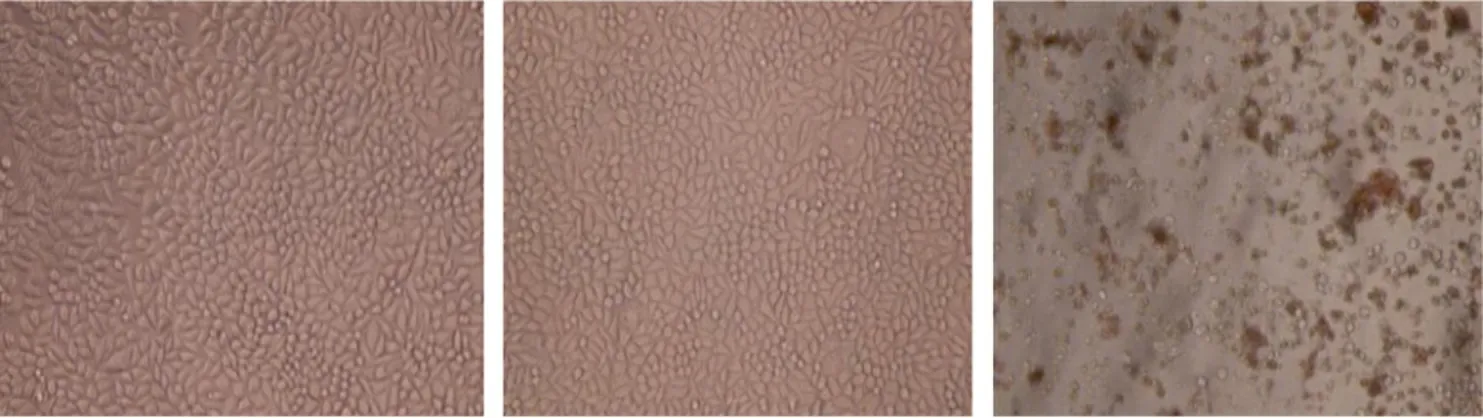
(a) 5-FU (b) SAS (c) 苯酚溶液图 12 细胞形态倒置显微镜照片Fig.12 Inverted microscope photos of cells
从图12可以看出:以苯酚溶液为对比样品,发现对比样品使细胞变形或塌缩,大部分是死细胞;而载药壳聚糖纳米颗粒体系图12(a)、(b)的细胞形态良好,呈梭形或多角形,胞体饱满,表明载药壳聚糖纳米颗粒生物相容性良好。
3 结 论
1) 对于载5-氟尿嘧啶体系,当质量浓度为0.8 g/L,质量比为5∶3时,可以形成粒径382 nm的壳聚糖纳米颗粒;对于载丹参素钠体系,当质量浓度为0.8 g/L,质量比为10∶7时,可以形成粒径425 nm的壳聚糖纳米颗粒。随着投药量的增加,平均粒径有增大趋势,载药量与包封率也随之增大。
2) 与游离药物相比,对于载5-氟尿嘧啶体系,载药纳米颗粒有明显的控释效果。初始投加量越低,pH越小,温度越高,释放速率越快;对于载丹参素钠体系,初始投加量越高,pH越大,温度越高,释放速率越快。不同的药物,控释效果与释放动力学模型拟合不同。
3) 通过聚电解质复合法构建的壳聚糖纳米载药体系,更适宜负载一定条件下带电的药物分子,其载药量和包封率会有所提高,且药物的控制释放行为更明显。
4) 载药壳聚糖纳米颗粒生物相容性良好,符合生物医用材料的基本要求。
