检测肺炎支原体新方法的建立及应用
2022-11-12周丽娟吴艳凌刁叶秋王正芳王广洲
周丽娟, 吴艳凌, 周 林, 刁叶秋, 王正芳, 王广洲
(扬州大学临床医学院/江苏省苏北人民医院 医学检验科, 江苏 扬州, 225001)
肺炎支原体(Mp)是一种常见的病原微生物,主要通过呼吸道传播,其不仅可引起多种呼吸道疾病,还可导致肺外其他系统的多种并发症[1]。呼吸道病原体引起的感染症状比较相似,很难靠临床症状及常规检测方法进行明确的早期诊断。因此,快速、高灵敏、高特异性的检测方法对诊断、鉴别呼吸道病原体感染至关重要。环介导等温扩增(LAMP)技术实现了恒温条件下的连续快速扩增核酸片段[2], 但该技术也存在缺陷,其没有聚合酶链式反应(PCR)热循环以避免引物之间的结合,因此恒定温度下的反应很难避免部分非特异性扩增[3]。
成簇的规律间隔的短回文重复序列(CRISPR)技术是一种以序列特异性方式修饰内部DNA/RNA编辑基因的技术,具有简单、廉价和高效等优势。为解决LAMP非特异扩增的缺点,研究人员已经开始使用CRISPR结合LAMP来进行核酸的体外检测[4-5], 其已成功应用于农业、治疗和感染因子、食品工业和生物能源等众多领域[6]。本研究拟建立CRISPR-LAMP检测Mp的新方法,以实现Mp快速、精准检测。
1 材料与方法
1.1 临床样本
选取2021年1月—2021年12月入住苏北人民医院儿科的患儿50例,其中30例为Mp感染, 20例为非Mp感染。采集患儿口咽拭子, -70 ℃储存,集中进行检测。
1.2 材料
Loopamp®DNA扩增试剂盒和LAMP法荧光检测试剂盒购自日本荣研公司, EnGen®Lba Cas12a (Cpf1)购自New England Biolabs公司, MpDNA质控品购自广州健仑生物科技有限公司,甲流病毒(FluA)标准物质及乙流病毒(FluB)标准物质购自上海计量院,肺炎克雷伯氏菌(Kp)、肺炎链球菌(Sp)临床菌株来源于本院医学检验科微生物室。
1.3 引物设计
采用Primer Explorer Version 5 软件设计LAMP引物,采用Deskgen软件设计CRISPR/Cas12a crRNA, 委托上海生工生物工程有限公司合成。引物及crRNA序列见表1。
1.4 CRISPR-LAMP单管一步法检测
LAMP引物配制,使用去离子双蒸水溶解引物至如下工作浓度: F3(5 μmol/L)、B3(5 μmol/L)、FIP(40 μmol/L)、BIP(40 μmol/L)、LB(40 μmol/L)。
LAMP反应液12.5 μL∶2×反应缓冲液(RM), 6.0 μL; F3、B3、FIP、BIP、LB各0.5 μL; Bst DNA聚合酶 0.5 μL; 去离子水2.5 μL、DNA 1.0 μL。
Crispr 12a反应液: 2.0 μL 10×NEB buffer, 7.5 μL H2O, 1.0 μL Cas12a, 1.0 μL crRNA, 1.0 μL ssDNA report。
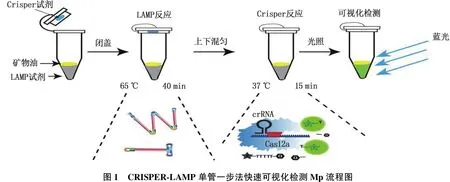
CRISPR-LAMP单管一步法反应体系为25.0 μL, 检测步骤及流程见图1。将12.5 μL Crispr/Cas12a 试剂加在试管盖上, 12.5 μL LAMP反应试剂加在管底,并在LAMP试剂上加1层矿物油; 盖上管盖, 65 ℃反应40 min; 将试管上下颠倒混匀, Cas12a试剂与LAMP反应产物充分混匀后, 37 ℃反应15 min; 470 nm蓝光灯(蓝光透射仪OSE-470-12)照射反应试管,阳性结果呈现绿色荧光。

表1 Mp LAMP 引物及crRNA序列
1.5 Mp PCR方法
Mp检测的引物序列为F: 5′-GGCCGTAACTATAACGGTCC-3′; R: 5′- AGACCCCGTGAAGCTTTACT-3。扩增条件: 95 ℃预变性3 min; 30循环,条件为95 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 60 s, 72 ℃ 10 min。使用仪器为天隆科技Genesy 96T基因扩增热循环仪,购自西安天隆科技有限公司。
1.6 灵敏度分析
Mp基因组DNA稀释至10.0 ng/μL, 应用NanoDrop 1000微量紫外可见分光光度计(美国Thermo Scientific), 配置1×106fg/μL、1×104fg/μL、1×102fg/μL、1×10 fg/μL和1 fg/μL的Mp DNA标准品。ddH2O为阴性对照。分别采用CRISPER-LAMP单管一步法和PCR法检测上述标准品,以评估CRISPER-LAMP单管一步法的灵敏度。
1.7 特异性分析
采用AllPrep®DNA Mini Kit试剂盒提Kp、Sp基因组DNA, 每份DNA样本稀释至10 ng/μL与MpDNA质控品、FluA标准物质及FluB标准物质进行CRISPER-LAMP单管一步法检测。
1.8 统计学方法
PCR法结果与CRISPER-LAMP单管一步法结果一致性采用Cohen′s Kappa 检验。
2 结 果
2.1 CRISPR-LAMP单管一步法检测Mp灵敏度
以稀释的Mp DNA标准品为检测模板进行反应, CRISPR-LAMP单管一步法结果见图2A、2B。A为荧光检测仪(Biotek Synergy)检测反应产物荧光值, B为可视化检测结果。应用琼脂糖凝胶电泳法检测PCR法扩增Mp DNA系列浓度标准品的产物,结果见图2C。结果显示, CRISPR-LAMP单管一步法检测Mp检出限为10 fg/μL, PCR法检测Mp检出限为100 fg/μL。
2.2 CRISPR-LAMP单管一步法检测Mp的特异性分析
CRISPR-LAMP单管一步法检测FluA, FluB、Kp、Sp反应均为阴性; Mp为阳性,结果见图3A、3B。结果显示, CRISPR-LAMP单管一步法检测Mp具有高特异性,与咽拭子中可能存在的病原体不存在交叉污染检测。
2.3 CRISPR-LAMP法与PCR法检测临床样本的一致性
CRISPR-LAMP单管一步法检测50例临床标本(30例Mp感染样本; 20例临床非Mp感染标本),其中30例阳性, 20例阴性。CRISPR-LAMP单管一步法与PCR法一致性较好(Kappa值为1), 见表2。

A: CRISPR-LAMP单管一步法检测Mp荧光检测结果; B: CRISPR-LAMP单管一步法检测Mp可视化检测结果,阳性结果呈现绿色荧光; C: PCR检测Mp DNA扩增产物琼脂糖凝胶电泳结果; M: DNA梯状标志; 1~5分别为1×106 fg/μL、1×104 fg/μL、1×102 fg/μL、10 fg/μL和1 fg/μL Mp DNA, N为阴性对照。图2 CRISPR-LAMP单管一步法及PCR法检测Mp灵敏度分析
3 讨 论
实验室病原学检测是Mp感染诊断的关键,检测Mp的传统方法为分离培养和血清学试验。但培养法因周期较长、灵敏度低在临床应用中受到极大限制; 血清学抗体检测也不能实现Mp早期检测,故上述方法限制了其在临床实验室的广泛开展[7]。PCR技术在实验室诊断中起到了关键的作用,目前已成为Mp首推的重要的检测手段之一,但用于临床实验室的PCR技术都需依赖特定场所、设备、仪器及经培训上岗的工作人员,操作复杂、费时、技术要求高,不适合Mp检测的常规开展[8]。血清学、培养法、分子检测在临床实践中各有优缺点,因此亟需研发、转化可灵敏、准确鉴定Mp的新技术方法。


表2 CRISPR-LAMP法与PCR法检测临床标本一致性(n=50)
LAMP技术已应用于塞卡病毒、新型冠状病毒 (SARS-CoV-2)等多种病原体的检测[9-11]。该技术克服了传统PCR反应需通过反复热变性过程获得单链模板的缺点,并避免了反复降温的耗时过程,可以在15~60 min扩增出109~1010倍靶序列拷贝,具有高灵敏度和扩增效率。CRISPR-Cas系统是原核生物中的一种适应性免疫系统,其在细菌宿主染色体中以病毒DNA的形式存储记忆,以防止噬菌体感染[12]。在CRISPR-Cas效应子家族中, Cas12a系统能在识别靶点后诱导任意单链DNA(ssDNA)的分裂,在分裂位点释放荧光信号[13]。
本研究利用CRISPR可进一步提高LAMP反应的特异性这一优势,建立了CRISPR-LAMP单管一步法检测Mp。因CRISPR-Cas12a系统的高特异性,当特殊设计的crRNA与靶标Mp病原体DNA配对后,与Cas12a蛋白形成复合物,激活该蛋白的切割活性,进而引起荧光信号的释放,从而应用蓝光透射仪实现了荧光可视化的检测。该法可检测到10 fg/μL的Mp DNA, 检测灵敏度高于传统的PCR技术(100 fg/μL)一个数量级,与TAO D G等[14]研究结论相一致。
在核酸检测实验中的主要问题是气溶胶污染导致的假阳性[15]。本方法中虽然LAMP扩增温度为65 ℃, CRISPR体系的反应温度为37 ℃, 但本研究组利用矿物油把2个反应系统分隔放置在一个试管的不同位置。LAMP扩增反应首先在离心管中进行,在进行过程中, CRISPR体系试剂将在管盖内保持相对稳定。当LAMP扩增反应完成后, CRISPR体系试剂通过人为混匀进入LAMP扩增后的体系中,并进行核酸检测,然后对反应混合物进行荧光成像检测,故本方法可以有效减少气溶胶污染。
本研究建立的方法检测了50例经确诊的临床样本,其中有30例为阳性, 20例为阴性,结果均与PCR结果一致,Kappa值为1, 表明2种方法一致性很好。此方法检测FluA、FluB、Kp、Sp反应均为阴性,显示其具有高特异性。但本法存在以下3点不足: ① 由于LAMP反应的温度为65 ℃, 此温度对CRISPR体系中的Cas12a、crRNA 和ssDNA report 3种试剂产生影响的程度以及是否对最终实验结果产生影响,本研究将会在后续的实验中逐步加以验证。② 在此法评价灵敏度时,本研究实验结果为10 fg/μL, 实际的检测限应该小于10 fg/μL, 后续本研究将会评价10 fg/μL至1 fg/μL之间的其他浓度,以期找到此法“真实”的检出限。③ 在此法评价特异性时,本研究选取了除Mp外4种病原体,仍不够全面,在后续的实验中本研究将会增加引起呼吸道感染的其他病原体,继续探究本检测方法的特异性。此外检测临床样本仅有50例,存在偶然性及片面性。
综上所述,本研究将LAMP的强大病原体扩增优势与CRISPR-Cas12a对Mp DNA特异性检测能力相结合,建立了单管一步法检测Mp的方法,该法简便、快速,检测过程中无需开盖、无气溶胶污染,并可在1 h后可读取结果; 检测灵敏度达到了10 fg/μL, 且特异性强不受其他病原体干扰,不需要高端复杂的设备。CRISPER-LAMP单管一步法有望成为检测Mp的新手段,可为社区及基层医院广泛检测Mp提供新方法。
