靶向抗肿瘤抗体-药物偶联物研发进展
2022-11-11谢铭
谢 铭
靶向抗肿瘤抗体-药物偶联物研发进展
谢 铭
(广西民族大学预科教育学院,广西 南宁 530006)
抗体-药物偶联物(ADC)是将细胞毒性小分子药物与单克隆抗体偶联的靶向抗肿瘤药物,利用抗体的特异靶向性和细胞毒性小分子的高效抗肿瘤活性,达到高效低毒的目的,是当前肿瘤创新药研发的热点。文章主要从单克隆抗体的筛选和人源化改造、靶点抗原的选择、细胞毒小分子的类型、连接子的偶联策略等方面进行综述,对ADC研发趋势进行总结分析,为教学和科研提供参考。
抗体-药物偶联物;单克隆抗体;靶点抗原;细胞毒性小分子;连接子;发展趋势
引言
抗体-药物偶联物(antibody-drug conjugate,ADC)是单克隆抗体(monoclonal antibodies,mAbs)与细胞毒性小分子(cytotoxic small molecule)的偶联产物。在肿瘤治疗上,单克隆抗体虽靶向性良好但大多靶向于细胞外或细胞表面抗原,抗肿瘤活性较弱,对实体瘤的治疗效果有限,且较易产生耐药;常规抗肿瘤化疗药物,虽然具有高效的抗肿瘤细胞活性,但缺乏靶向性,常误伤躯体正常细胞,毒副作用较严重。抗体-药物偶联物正好使两者互补,兼具抗体的高特异性和细胞毒性药物对肿瘤的高毒性,达到专一杀死肿瘤细胞而不损伤正常组织细胞的作用,临床上具有高效低毒的抗肿瘤效果[1]。
1 ADC的作用机制
ADC作为以单克隆抗体为载体的新型靶向给药体系,由单克隆单抗、细胞毒性小分子药物和抗体-药物连接子3部分组成(图1)。单克隆抗体的主要功能是药物载体,控制ADC药物靶向性,将“弹头”——细胞毒小分子药物靶向输送、富集至肿瘤部位,其结合的靶点抗原必须是高特异性表达于肿瘤细胞或者肿瘤微环境。细胞毒性小分子药物是ADC药物设计中第二个关键性因素,ADC药物抗肿瘤的效应主要取决于所选细胞毒性小分子药物的杀伤效应。连接子主要起桥梁作用,将单抗与细胞毒性小分子稳定的偶联,它承载ADC的稳定、水溶性和肿瘤细胞内释放等功能。ADC以静脉注射的方式进入血液循环,进入肿瘤组织后与肿瘤细胞表面的抗原结合,随后在受体介导下,大多通过网格蛋白(clathrin)的牵引发生细胞内吞而进入肿瘤细胞溶酶体,释放的细胞毒性小分子与肿瘤细胞的DNA、RNA、微管蛋白等结合,影响其复制或有丝分裂,产生抗肿瘤作用。除细胞毒性小分子(有效载荷)的细胞毒作用外,单抗介导的肿瘤细胞受体信号通路抑制,以及抗体Fc域和有效载荷介导的免疫反应均可辅助ADC的疗效。抗体、靶抗原、细胞毒素、连接子及偶联方式的选择均是影响ADC药物开发成功的关键[2]。
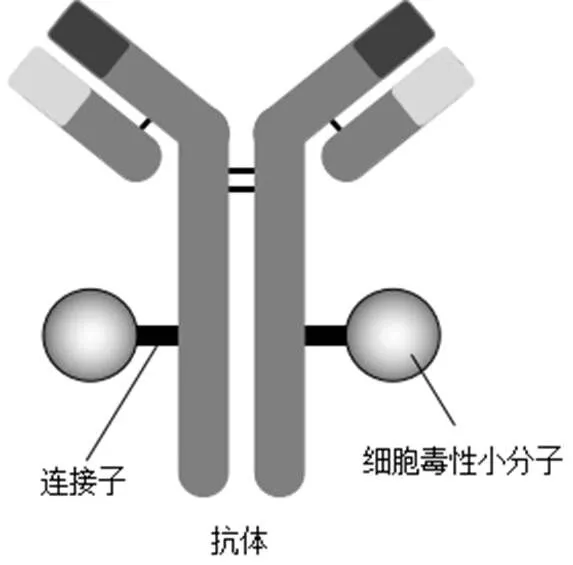
图1 ADC结构模型
2 单克隆抗体
2.1 单克隆抗体选择
ADC抗体部分既作为细胞毒素载体,又承担靶向作用,并可诱导肿瘤细胞表面靶抗原介导的内吞作用。单克隆抗体一般为针对肿瘤细胞表面靶点抗原设计的特异性单克隆抗体,由单一B细胞克隆产生,具有纯度高、灵敏度高、特异性强、交叉反应少、制备成本较低等特点,通常采用杂交瘤技术制备。理想的单克隆抗体除了应具有较低的免疫原性外,还应具有以下特点:高特异性即良好的靶向性,能与靶细胞特异性结合并且亲和力高,经靶细胞内吞作用,导致携带的小细胞毒分子有效释放;结合抗原后不会产生负反馈;与毒性药物偶联后自身特性不改变。目前单克隆抗体一般都选择具有较长半衰期的IgG,多为IgG1、IgG2及IgG4。
2.2 单克隆抗体人源化改造
早期生产的单克隆抗体为鼠源性抗体,ADC使用的也是鼠源性单抗,易导致病患产生严重的免疫反应副作用,而且鼠源抗体不能在人体内有效地激活补体系统和Fc受体相关效应,使其临床应用受到限制。为了解决异源抗体的缺陷,20世纪80年代后,研究人员对单抗进行了人源化改造[3]。抗体人源化的类型包括嵌合抗体、改型抗体以及通过噬菌体展示技术或转基因鼠产生的全人源化抗体。全人源单抗完全用人类的遗传信息来编码抗体,人源化抗体在临床上的成功运用大大减少了异源抗体对病患造成的免疫副反应。
2.3 靶点抗原选择
ADC靶点主要针对癌细胞病理生理发生、发展的关键靶点。单抗靶点一般选择肿瘤细胞表面的抗原或者特定受体,这些抗原或受体在正常细胞没有或很少表达,最好是肿瘤细胞表面特有,这样才能保证ADC的靶向性。其次ADC与抗原结合后要能够被内吞进入细胞。研究发现肿瘤细胞表面靶抗原的表达水平只需略高于正常细胞,就可成功诱导ADC药物活性。已成功用于ADC靶点的肿瘤细胞抗原有细胞分化簇抗原分子(cluster of differentiation,CD)中的CD30、CD33、CD22等,它们是细胞膜上的一类蛋白质或糖蛋白;肿瘤细胞受体有表皮生长因子受体(HER)中的HER1(EGFR)和HER2等。靶点也可以扩展为支持肿瘤生长、扩散相关的组织,例如肿瘤新生血管组织中的血管内皮生长因子(VEGF),或者肿瘤细胞外基质中的抗原等。靶点选择与肿瘤基因分型密切相关[4]。目前以HER2、GPNMB等为靶点的ADC主要用于治疗乳腺癌;目前治疗肺癌的ADC多选择EGFR、NaPi2b等抗原作为靶点;治疗胶质瘤的ADC多选择PSMA、EGFR等抗原作为靶点;治疗白血病、淋巴瘤的ADC主要以白细胞分化抗原CD分子作为靶点;此外又发现一些新型靶点可用于ADC药物的研发,如PSMA、EPCAM、CEA等[5]。目前上市或临床在研ADC的靶点有40多个。寻找新靶点是ADC研发中很重要的环节,靶点抗原的丰富能扩大ADC的适用症范围,使一些原来无合适靶点的肿瘤可以有的放矢。
3 细胞毒性小分子药物
最早的ADC连接的细胞毒药物是临床上传统常规的大分子化疗药物,诸如甲氨蝶呤、长春碱、丝裂霉素等,分子量过大,临床抗癌效果较差。多数肿瘤细胞表面抗原的低表达和较弱的内吞活性,易导致输送至肿瘤细胞内部的ADC少之又少,因此抗体携带的毒素分子必须分子量小且具有极高的细胞毒性。毒性强的细胞毒小分子,在低于纳摩尔浓度以至皮摩尔浓度就可杀伤癌细胞,毒性强烈但不适合直接给药,而利用单克隆抗体携带进入肿瘤细胞恰能充分发挥其抗肿瘤作用,成为目前ADC药物的首选。
3.1 细胞毒性小分子类型
靶向递送的细胞毒性小分子是ADC杀伤癌细胞最重要的武器,可通过抑制DNA、RNA、蛋白合成、细胞分裂等对肿瘤细胞进行杀伤。与单抗连接的细胞毒性小分子作用机制要清楚,分子量要小、活性要高,同时要对多药耐药蛋白(MDR1)介导的外排低敏感性,化学修饰后与连接子结合良好,偶联到单抗后不改其抗肿瘤活性。目前应用于ADC的细胞毒小分子,依据不同的作用机理主要分为微管蛋白抑制剂和DNA 损伤剂。微管蛋白抑制剂主要有美登素(maytansines)和澳瑞他汀(auristatins)等,DNA 损伤剂主要有卡奇霉素(calicheamicins)、倍癌霉素(duocarmycins)、阿霉素(doxorubicin)和吡咯开苯并吖庚三烯(pyrrolobenzodiazepines)等[6]。此外,美登素衍生物、拓扑异构酶抑制剂(如伊立替康等喜树碱衍生物)和RNA聚合酶Ⅱ抑制剂(α-鹅膏蕈碱)等也被应用于ADC的研发。这些高活性小分子细胞毒药物其毒性比传统常规化疗药物高出10倍以上,通常4~6个分子的剂量就能对靶向肿瘤细胞进行杀伤,对肿瘤细胞具有更强的杀伤力。这些细胞毒素需要具有优良的水溶性,才便于毒素分子与抗体在水溶液中进行偶联反应。如果初选毒素分子的性质并不适于在ADC中使用,可以对其进行化学修饰改造,使之具备合适的物理化学性质并且容易发生偶联,在生产及储存过程中保持稳定性。开发新型细胞毒性小分子药物是ADC研发过程中非常重要的环节。
3.2 细胞毒小分子作用机制
DNA损伤剂卡奇霉素与肿瘤细胞DNA结合后产生自由基,切割DNA骨架导致DNA双链断裂分离,从而达到杀伤肿瘤细胞的效果。卡奇霉素为天然烯二炔类抗肿瘤抗生素,最早从稀有放线茵小单胞菌中分离获得。微管蛋白抑制剂美登素为大环内脂类化合物,最早从热带非洲的美登木中提取,通过与肿瘤细胞微管蛋白结合,抑制微管蛋白的聚集,引起细胞周期G2/M期的阻滞,从而抑制肿瘤细胞的有丝分裂过程,达到抗肿瘤效果。澳瑞他汀是一种从印度洋截尾海兔(Dolabella auricularia)中分离出来的环肽衍生物,通过抑制分裂细胞的纺锤体形成,使肿瘤细胞有丝分裂停止于分裂中期,并诱导细胞凋亡。美登素的衍生物DM1和DM4为含巯基的有丝分裂抑制剂[7]。拓扑异构酶是调控细胞内DNA复制的一种酶,伊立替康等可使拓扑异构酶受到抑制,造成DNA链发生断裂,从而抑制肿瘤细胞增殖。
4 连接子
连接抗体和毒素的连接子必须在血液循环中保持长时间稳定,以免毒性小分子提前释放到血液中产生严重不良反应及降低疗效,而进入癌细胞后又要确保“弹头”细胞毒素分子的有效释放。ADC一般使用肽键、二硫键、硫醚键等共价键进行单抗和毒性小分子的连接。连接子分为不可裂解和可裂解两类。不可裂解连接子稳定性好,如硫醚连接子等。治疗乳腺癌的Kadcyla用稳定的硫醚连接子把美登素衍生物DM1连接到抗体上。根据裂解机制不同,可裂解连接子分为化学裂解连接子和酶裂解连接子,前者有腙类连接子等,后者有肽连接子等[8]。西雅图遗传研发上市治疗霍奇金淋巴瘤的Adcetris用缬氨酸-瓜氨酸二肽连接子把微管抑制剂海兔毒素10的合成衍生物MMAE成功偶联到单克隆抗体cAC10上。
连接子的连接方式分为非定点偶联法和定点偶联法。由于抗体分子上存在大量的功能基团,使用非定点偶联法,偶联反应可在多个位点进行,偶联ADC最终产物是混合物,具有不同药物——抗体比(drug-antibody ratio,DAR),导致产品复杂的药理学,不易调控的药物动力学及药物药效学,且产品稳定性欠佳,连接的细胞毒分子较易脱落产生毒副作用,对其分析鉴定和产品质量控制都易出现问题。采用定点偶联技术可以解决这些问题,该技术多通过对抗体进行修饰、改造,把细胞毒分子连接在抗体特定位点上,大幅提高了ADC的均一性和纯度,能有效控制药物-抗体比以及载药分布等关键质量属性,便于分析鉴定和质量控制,减少了药物毒副作用,增加了药物治疗窗口。2019年上市的Enhertu和2020年上市的Trodelvy,连接子的连接策略就是定点偶联,定点偶联成为新一代ADC研发和创新的趋势。
5 ADC研发历程和未来趋势
ADC药物是抗肿瘤创新药,但起源可以追溯到一百多年前,曾获得诺贝尔医学奖的德国医学家保罗·欧立希(Paul Ehrlich)早在1897年就提出“魔术子弹”假说,设想通过肿瘤细胞表面抗原进行细胞毒素的靶向运输。1958年Mathe首次将抗鼠白细胞免疫球蛋白与甲氨蝶呤偶联用于白血病的治疗,开启了ADC研发的有益尝试。但是ADC的发展困难重重,直到20世纪80年代后,随着单克隆抗体临床药用成功,ADC的研发才逐步变为现实,并被寄予厚望。ADC研发应用历程大致可分为以下几个发展阶段:1975年Kohler和Milstein共同发明单克隆抗体杂交瘤技术;1986年第一个鼠源单克隆抗体药物莫罗莫那-CD3获准上市;1994年第一个人-鼠嵌合抗体药物上市,2002年完全人源单抗获批上市;全球第一款抗体偶联药物Mylotarg于2000年上市,为第一代ADC;2013年第二代ADC—Kadcyla上市;第三代ADC研发取得重要进展[9]。
第一代ADC Mylotarg由于该药物的linker中含有在酸性环境下不稳定的腙键而且靶点的特异性不强,上市后临床疗效有限和毒副作用严重,该药于2010年被辉瑞主动撤市。经过剂量调整/补充临床数据后该药物于2017年重新获得美国美国食品药品管理局(FDA)批准上市。第二代ADC技术有所改进,有较好的临床疗效和安全性。但上市的Kadcyla和Besponsa均利用非定点偶联技术,产品结构高达百万种,均一性不佳影响了药物的有效性和安全性[10]。第二代ADC所采用的马来酰亚胺类linker有在血清中早期解离的风险,因而第三代ADC对该风险进行了改良。第三代ADC是国内外研发趋势热点,目标是进一步优化筛选单克隆抗体和细胞毒素,创新连接子,重点是使用定点偶联技术进行定点定量偶联,降低产品的异质性和毒副作用,提高药物的稳定性和改善药代动力学效率,利于增大治疗窗口期,也更适于大量生产ADC[11]。随着强效毒素分子开发、定点偶联、生物偶联以及纳米抗体、双特异性抗体等新技术的发展,新型ADC研发势头高涨。由于单抗的分子质量较大,有时难以透过毛细血管内皮或由肿瘤细胞间隙到达实质性肿瘤内部,因此采用具有更强穿透能力的抗体片段如Fab、sc Fv 单链与小分子细胞毒药物偶联构成ADC是目前的研究热点之一[12]。
鉴于ADC药物结构和制造工艺的复杂性,各国药品监管机构对ADC药物的审批一直持相对谨慎的态度。截至2020年12月底FDA批准上市的ADC药物共有9个(表1),主要治疗恶性肿瘤特别是复发难治性恶性肿瘤,已在世界多国临床应用,正在进行临床研发的ADC有80多个[13]。2015年11月,我国首个ADC抗癌药物RC48进入临床试验,填补了我国在该领域的空白。2021年6月,我国自主研发的创新抗体偶联药物新药—维迪西妥单抗(商品名:爱地希,研究代号RC48)获得中国药监局(NMPA)上市批准,适用于治疗至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌患者。该药采用全新的、亲和力更强、内吞效果更好的人源化迪西妥单抗(Disitamab),使用先进的连接子(MC-Val-Cit-PAB)和小分子细胞毒药物单甲基澳瑞他汀E (Monomethyl Auristatin E,MMAE),该药获批上市打破了ADC药物领域无我国原创新药的局面,填补了全球HER2过表达晚期胃癌患者后线治疗的空白。截至2021年上半年,我国药企已经累计申报30多款ADC的临床试验。

表1 FDA批准上市的ADC药物
6 结束语
作为靶向抗肿瘤创新药,ADC药物在临床“精准医疗”上获得了一系列振奋人心的成功,被比作对抗肿瘤的“特洛伊木马”,展现了广阔的应用前景,21世纪以来特别是近10年掀起了研发应用热潮。随着单克隆抗体技术的不断发展,以及新型细胞毒素、连接子和肿瘤靶标的开发,ADC研发进展明显加快。但ADC研发是非常复杂的系统工程,其化学结构、作用机制、生物活性和工艺质量控制都具有特殊性,涉及分子生物学、免疫药理、基因工程、有机化学、药代动力学等多种学科,技术门槛高,制备工艺复杂,目前获批上市的ADC数量较少。减少脱靶毒性,在安全性和有效性之间达到最佳平衡,扩大治疗种类,扩大治疗窗,ADC研发创新仍面临诸多挑战,对ADC产品的临床应用研究也在不断深入和完善。可以期待的是ADC在癌症靶向治疗领域将会取得更多的成就,会有更多的优质ADC药物获批上市,惠及更多患者。
[1] Ricart A D, Tolcher A W. Technology insight cytotoxic drug immunoconjugates for cancer therapy[J]. Nature Clinical Practice Oncology, 2007, 4(4): 245-255.
[2] 张忠兵,王旸,白玉. 抗体偶联药物研发及药学审评要点[J]. 药学学报,2020,55(8): 1971-1977.
[3] Peters C, Brown S. Antibody-drug conjugates as novel anti-cancer chemotherapeutics[J]. Bioscience Reports, 2015, 35(4): e00225.
[4] Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of antibody-drug conjugates[J]. Nature Reviews Drug Discovery, 2017, 16(5): 315-337.
[5] 周辛波,李静. 靶向抗肿瘤新技术—抗体偶联药物[J]. 临床药物治疗杂志,2016,14(3): 98-92.
[6] 姚雪净. 抗体药物偶联物的研究进展[J]. 中外医学研究,2020,18(12): 185-188.
[7] Klute K, Nackos E, Tasaki S, et al. Microtubule inhibitor-based antibody-drug conjugates for cancer therapy[J]. Oncotargets and Therapy, 2014(7): 2227-2236.
[8] 郭立红,王金朋,翟立海,等. 抗体偶联药物和小分子偶联药物的研究进展[J]. 中国医药工业杂志,2019,50(8): 842-849.
[9] Lamb Y N. Inotuzumab ozogamicin: first global approval [J]. Drugs, 2017, 77(14): 1603-1610.
[10] Matos M J, Oliveira B L, Martinez-Saez N, et al. Chemo and regioselective lysine modification on native proteins[J]. Journal of the American Chemical Society, 2018, 140(11): 4004-4017.
[11] 李明莹,汪琳,马宁宁. 定点偶联技术在抗体药物偶联物中的应用[J]. 药学进展,2021,45(3): 180-187.
[12] 于丝雨,刘晓东,刘李. 抗体药物偶联物药动学研究进展[J]. 药学进展,45(3): 188-195.
[13] 陈虎,张信玲,孔娜娜,等. 基于定点偶联技术的抗体药物偶联物的临床研究进展与挑战[J]. 药学进展,2021,45(3): 167-179.
Research and Development Progress of Targeted Antitumor Antibody-Drug Conjugate
Antibody-drug conjugate (ADC) is a targeted antitumor drug that couples cytotoxic small molecule drugs with monoclonal antibodies. Using the specific targeting of antibodies and the high antitumor activity of small cytotoxic molecules, achieve the purpose of high efficiency and low toxicity. It is a hot spot in the research and development of innovative cancer drugs. This paper reviews the screening and humanization of monoclonal antibodies, the selection of target antigens, the types of cytotoxic small molecules, and the coupling strategy of linkers, summarizes and analyzes the development trend of ADC, providing reference for teaching and scientific research.
antibody-drug conjugate; monoclonal antibody; target antigen; cytotoxic small molecule; linker; development trend
R73; R979.1
A
1008-1151(2022)10-0113-04
2022-08-15
谢铭(1965-),男,广西民族大学预科教育学院讲师,研究方向为生物学、组织学与胚胎学教学和科研。
