镓锗工业生产中镓锗浸出液Fe2+氧化剂选择方案探讨
2022-11-11高艳芬张俊峰杨振宇彭明星
高艳芬 张 伟,2 张俊峰 杨振宇 钟 湘 彭明星 胡 立
(1.深圳市中金岭南有色金属股份有限公司丹霞冶炼厂, 广东 韶关 512325; 2.江西理工大学 材料冶金化学学部, 江西 赣州 341000)
0 前言
镓、锗是重要的稀散金属,在自然界中极少有独立矿床存在,通常伴生在有色金属矿中。由于在矿物中赋存状态的不同,镓、锗资源伴生的矿物也不同:镓主要集中在铝土矿、硫化铜矿和闪锌矿中,因此90%的镓回收来源于氧化铝工业生产,约10%来自炼锌产物;锗主要集中在铅锌矿和煤矿中,所占比例分别为69%和17%,所以大部分锗从锌冶炼的副产品中回收或从煤中提取[1-5]。广东省凡口铅锌矿是我国特大型富含稀散金属镓、锗的工业矿床矿山,含镓量和含锗量分别大于170 g/t和120 g/t[6]。国内某冶炼企业采用氧压酸浸工艺处理富含镓、锗的凡口锌精矿,镓、锗浸出率分别为90%和95%,锌浸出液采用中和- 锌粉置换工艺得到富含镓和锗的锌粉置换渣,这些锌粉置换渣成为工业提取镓和锗的生产原料[7]。采用稀硫酸二次浸出富含镓、锗的锌粉置换渣时,渣中的杂质元素铁同时被浸出进入溶液中。由于锌粉置换渣呈还原态,镓锗浸出液中的铁离子主要为二价,为了满足后续萃取除铁工艺生产的条件,需要尽可能地将Fe2+氧化成Fe3+,且经过氧化后镓锗浸出液中的Fe2+质量浓度要求低于0.05 g/L,所以采用合适的氧化剂是提取镓、锗生产中的关键环节。
当前,工业生产中可以应用的氧化剂种类繁多,根据氧化反应要求,介质主要分为3类:1)酸性介质氧化剂,如过氧化氢、过氧乙酸、重铬酸钠、硝酸、高锰酸钾、过硫酸盐等;2)碱性介质氧化剂,如次氯酸钠、过碳酸钠、过硼酸钠和过硼酸钾等;3)中性氧化剂,如溴、碘、氯等[8]。考虑到工业生产的实际情况,一方面需要避免引入其他影响镓、锗提取的杂质离子,另外一方面需要考虑氧化剂的采购成本和储存安全,本研究选择了工业级氧化剂过硫酸钠、锰矿粉和过氧化氢三种氧化剂。通过试验探索这三种氧化剂氧化镓锗浸出液Fe2+的最佳工艺参数,并从工业应用和生产成本等方面综合考虑选择最佳的氧化剂,以期为同类企业提供经验借鉴。
1 试验部分
1.1 试验原料和试剂
镓锗浸出液为国内某锌冶炼厂硫酸浸出镓锗置换渣后的溶液,主要成分见表1。取5 L过滤备用。

表1 镓锗浸出液主要成分
试剂:锰矿粉(化工用MnO2矿粉,MnO2含量≥65%,粒度300目,湖南大吉锰业公司);过硫酸钠(工业级,Na3S2O8含量≥99%,福建省展化化工有限公司);过氧化氢(工业级,H2O2有效含量≥30%,广东韶关乳源东阳光有限公司)。
试验仪器:DF- 101T集热式恒温水浴锅(巩义市予华仪器有限责任公司),JJ- 120数显恒速电动搅拌机(巩义市予华仪器有限责任公司),JJ2000型电子天平(常熟市双杰测试仪器厂),玻璃仪器制品若干。
1.2 试验方法与原理
设定水浴锅恒温,使用100 mL量筒分次量取共计250 mL镓锗浸出液倒入0.5 L玻璃烧杯中,设定搅拌转速500 r/min。待溶液温度达到设定温度时开始记录时间,按照理论化学反应摩尔比加入氧化剂过硫酸钠、锰矿粉和过氧化氢,在设定时间内用移液管抽取部分溶液,采用重铬酸钾标准溶液滴定法测定溶液中的Fe2+质量浓度。
镓锗浸出液中的Fe2+与氧化剂过硫酸钠(Na2S2O8)、锰矿粉(MnO2)和过氧化氢(H2O2)氧化的反应方程式[9-11]如下:
(1)
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(2)
H2O2+2Fe2++2H+=2Fe3++2H2O
(3)
镓锗浸出液Fe2+氧化率的计算方法见式(4)。
(4)
式中,η为氧化率,%;V为镓锗浸出液体积,L,Me(a)Fe2+为氧化前镓锗浸出液Fe2+质量浓度,g/L,Me(b)Fe2+为氧化后镓锗浸出液Fe2+质量浓度,g/L。
2 结果与讨论
2.1 过硫酸钠氧化试验
2.1.1 过硫酸钠加入量对镓锗浸出液Fe2+的氧化率影响
设定反应温度50 ℃,反应时间30 min,开启搅拌装置至搅拌速度500 r/min,考察过硫酸钠加入量对镓锗浸出液Fe2+的氧化率影响,结果如图1所示。
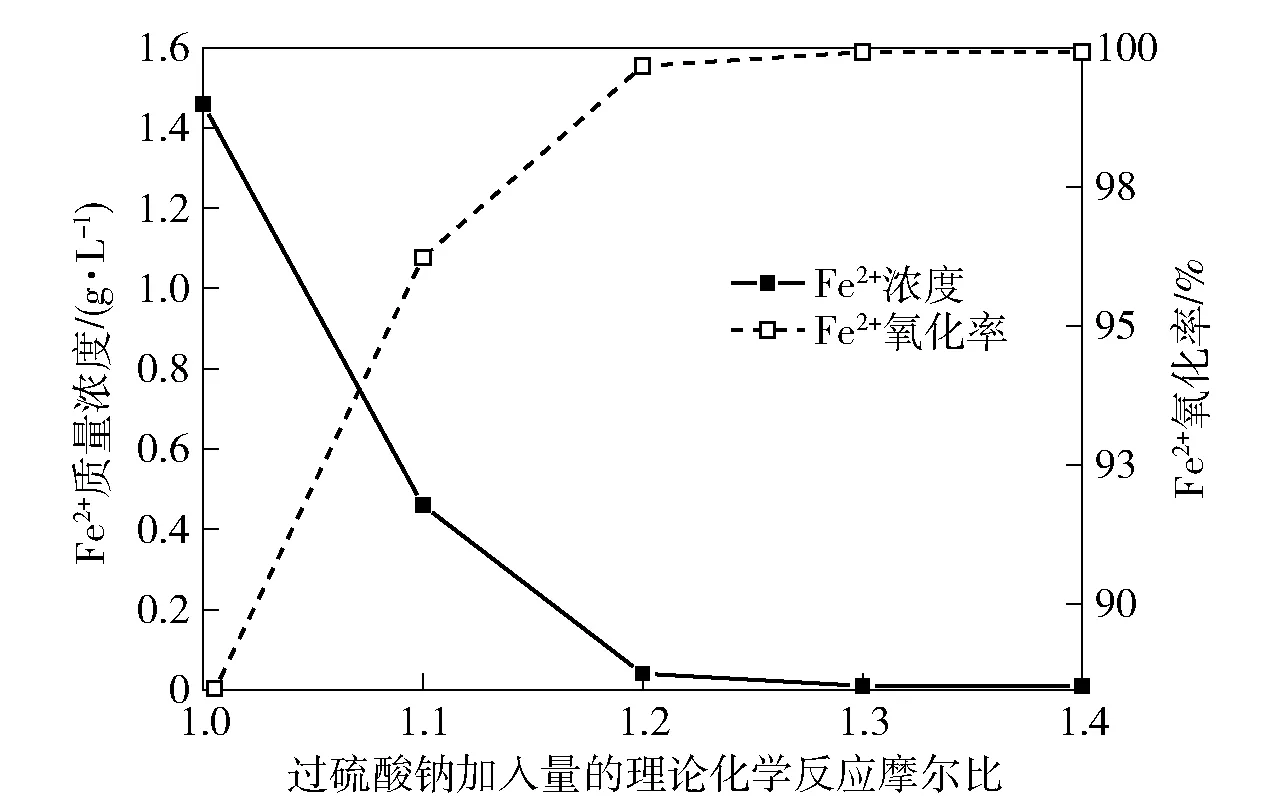
图1 过硫酸钠加入量对镓锗浸出液Fe2+的氧化率影响
从图1可知,随着过硫酸钠加入量的不断增加,镓锗浸出溶液中Fe2+质量浓度逐渐降低, Fe2+氧化率逐渐升高;当过硫酸钠按照理论化学反应摩尔比1.2加入时,镓锗浸出溶液中Fe2+质量浓度为0.04 g/L,Fe2+的氧化率为99.67%;进一步增加过硫酸钠至理论化学反应摩尔比1.3时,镓锗浸出溶液中Fe2+的质量浓度为 0.01 g/L,Fe2+的氧化率升高了0.25%,达到了99.92%。综合考虑,过硫酸钠按理论化学反应摩尔比1.2加入为宜。
2.1.2 反应时间对镓锗浸出液Fe2+氧化率的影响
过硫酸钠添加量按照理论化学反应摩尔比1.2加入,设定反应温度50 ℃,开启搅拌装置至搅拌速度500 r/min,考察反应时间对镓锗浸出液Fe2+的氧化率影响,结果如图2所示。

图2 反应时间对镓锗浸出液Fe2+的氧化率影响
从图2可知,随着反应时间的延长,镓锗浸出溶液中Fe2+质量浓度逐渐降低;当反应时间为50 min时, Fe2+质量浓度为0.06 g/L,Fe2+的氧化率为99.51%;当反应时间增加至60 min时, Fe2+质量浓度下降至0.03 g/L,Fe2+的氧化率升高了0.24%,达到99.75%。综合考虑,反应时间选择60 min为宜。
2.1.3 反应温度对镓锗浸出液Fe2+的氧化率影响
过硫酸钠添加量按照理论化学反应摩尔比1.2加入,设定反应时间60 min,开启搅拌装置至搅拌速度500 r/min,考察反应温度对镓锗浸出液Fe2+的氧化率影响,结果如图3所示。

图3 反应温度对镓锗浸出液Fe2+的氧化率影响
由图3可知,随反应温度的升高,镓锗浸出液中Fe2+质量浓度不断升高。当反应温度为15 ℃时,镓锗浸出液Fe2+质量浓度为0.04 g/L,Fe2+的氧化率为99.67%;当反应温度升高至75 ℃时,Fe2+质量浓度升高至0.12 g/L,Fe2+的氧化率降低了0.67%,为99.0%。由此可见,反应温度的升高对过硫酸钠氧化镓锗浸出液Fe2+有明显的抑制作用,主要原因为过硫酸钠具有强氧化性,随着反应温度的不断升高,氧化能力不断增强,氧化选择性降低,温度升高后,除了Fe2+外,还会氧化镓锗浸出溶液中的Mn2+等其他杂质离子,直接导致过硫酸钠参与Fe2+氧化的化学反应摩尔比下降,从而影响了镓锗浸出液Fe2+的氧化率。综合考虑,反应温度选用45 ℃为宜。
2.2 锰矿粉氧化试验
2.2.1 锰矿粉加入量对镓锗浸出液Fe2+的氧化率影响
设定反应温度50 ℃,反应时间30 min,开启搅拌装置至搅拌速度500 r/min,考察锰矿粉加入量对镓锗浸出液Fe2+的氧化率影响,结果如图4所示。
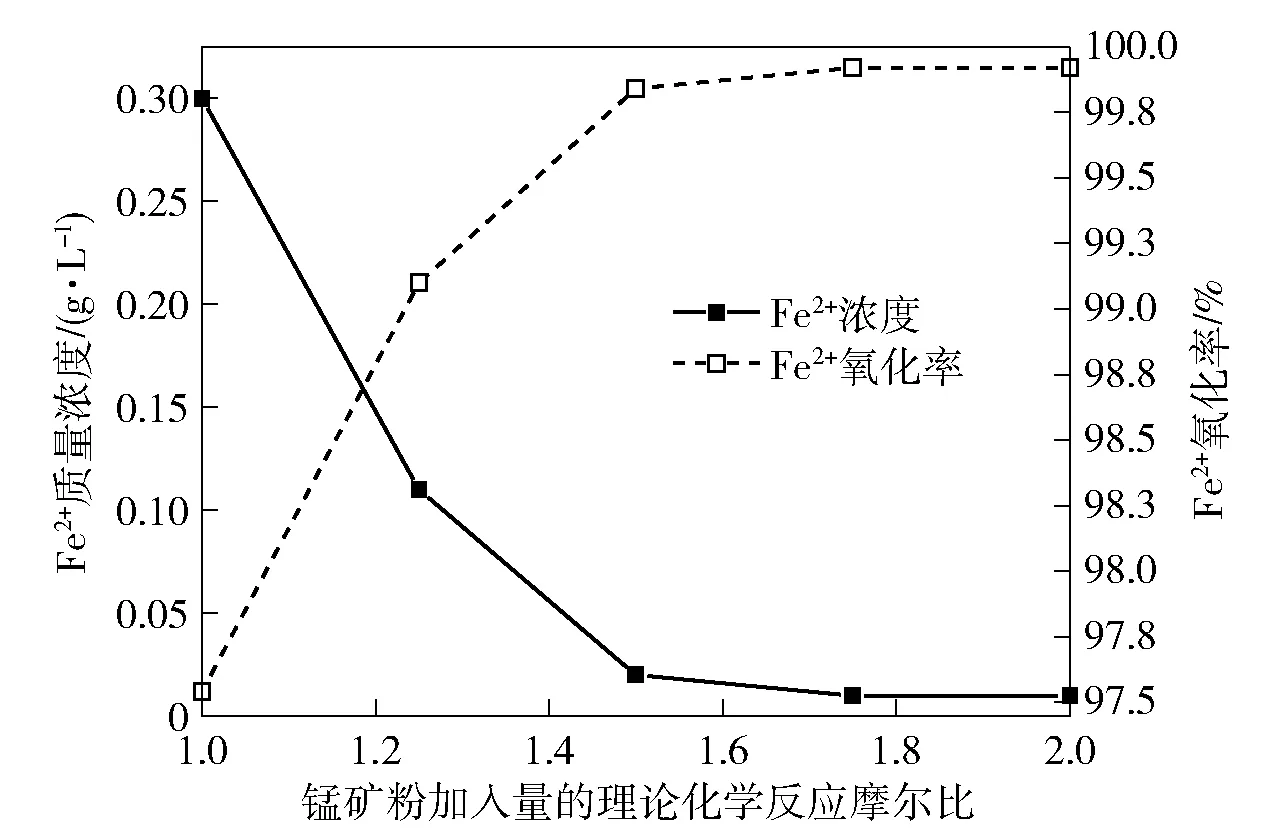
图4 锰矿粉加入量对镓锗浸出液Fe2+的氧化率影响
从图4可知,随着锰矿粉加入量的不断增加,镓锗浸出溶液Fe2+质量浓度逐渐降低,Fe2+的氧化率逐渐升高;当锰矿粉加入量按理论化学反应摩尔比1.5加入时,Fe2+质量浓度为0.02 g/L,Fe2+的氧化率为99.84%,进一步增加锰矿粉至理论化学反应摩尔比1.75时, Fe2+的质量浓度下降至0.01 g/L,Fe2+的氧化率升高了0.08%,达到99.92%。综合考虑,锰矿粉按理论化学反应摩尔比1.5加入为宜。
2.2.2 反应时间对镓锗浸出液中Fe2+的氧化率影响
锰矿粉按照理论化学反应摩尔比1.5加入,反应温度50 ℃,开启搅拌装置至搅拌速度500 r/min,考察反应时间对镓锗浸出液Fe2+的氧化率影响,结果如图5所示。

图5 反应时间对镓锗浸出液Fe2+的氧化率影响
由图5可知,随着反应时间的延长,镓锗浸出液中Fe2+质量浓度不断下降。当反应时间为50 min时,Fe2+质量浓度为0.01 g/L,Fe2+的氧化率为99.92%;反应时间增加至60 min,镓锗浸出液Fe2+质量浓度没有变化,Fe2+的氧化率没有升高。综合考虑,反应时间选用50 min为宜。
2.2.3 反应温度对镓锗浸出液Fe2+的氧化率影响
锰矿粉按照理论化学反应摩尔比1.5加入,设定反应时间50 min,开启搅拌装置至搅拌速度500 r/min,考察反应温度对镓锗浸出液中Fe2+的氧化率影响,结果如图6所示。
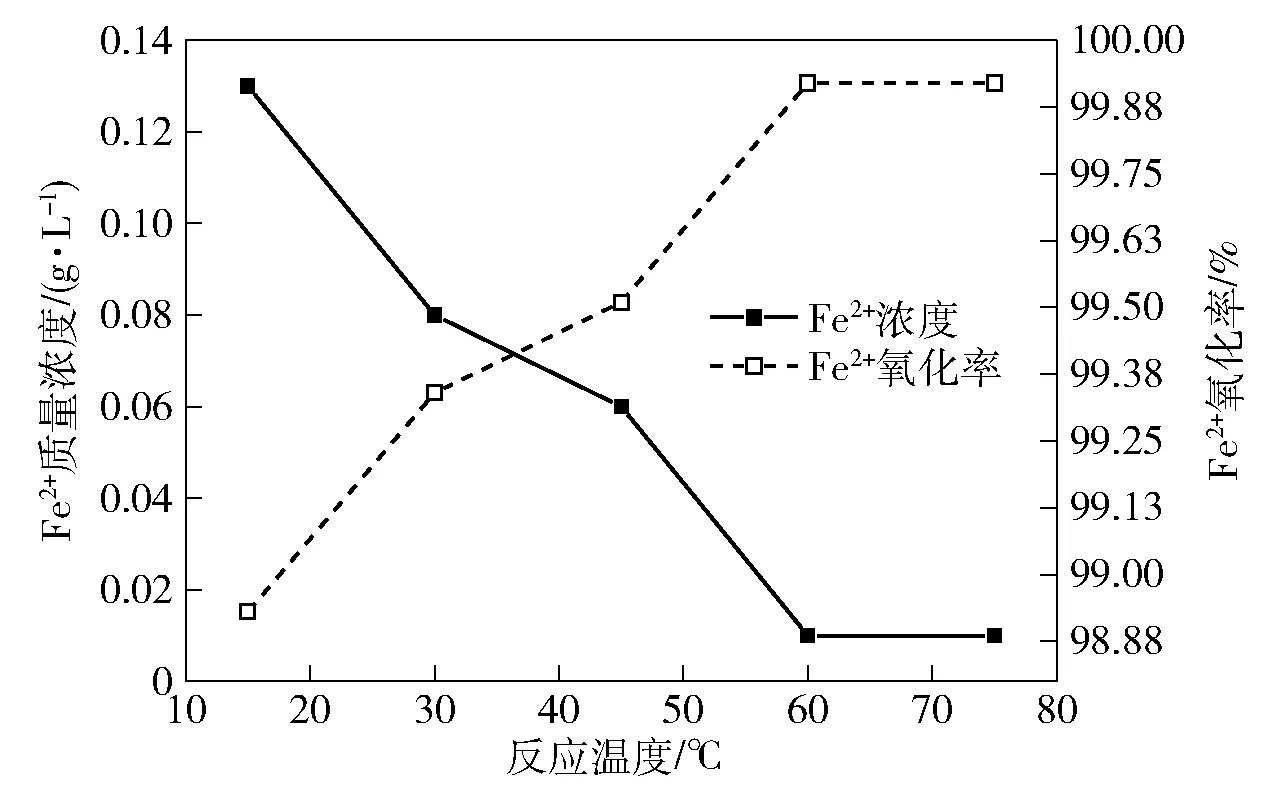
图6 反应温度对镓锗浸出液中Fe2+的氧化率影响
由图6可知,随着反应温度的升高,镓锗浸出液中Fe2+质量浓度不断降低。当反应温度为15 ℃时,Fe2+质量浓度为0.13 g/L,Fe2+的氧化率为98.93%;当温度升高至60 ℃时,Fe2+质量浓度下降至0.01 g/L,Fe2+的氧化率升高了0.99%,达到99.92%;继续提高反应温度至75 ℃,Fe2+质量浓度未降低,Fe2+的氧化率保持不变。综合考虑,反应温度以60 ℃为宜。
2.3 过氧化氢试验
2.3.1 过氧化氢加入量对镓锗浸出液Fe2+的氧化率影响
设定反应温度50 ℃,反应时间30 min,开启搅拌装置至500 r/min,考察过氧化氢加入量对镓锗浸出液Fe2+的氧化率影响,结果如图7所示。
油画作为一种“舶来艺术”,似乎与有着浓郁地方性的民俗文化截然分割,两者甚至被定性为“雅”与“俗”的二元对立状态。其实,无论是民俗文化抑或是油画艺术,二者的相通之处可以体现为以下两点:一是表达自我的情感与内在的自发冲动;二则是在具体表现中均突出主体的想象性与直觉性。因其既有差异又有着相通的特性,中国油画家才能够将两者统一于艺术作品中。
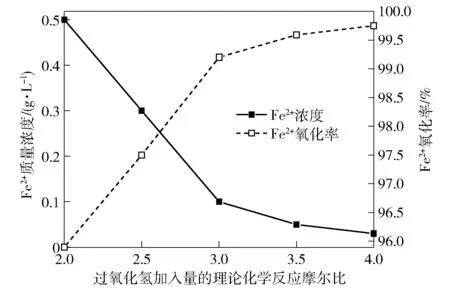
图7 过氧化氢加入量对镓锗浸出液Fe2+的氧化率影响
由图7可知,随着过氧化氢加入量的不断增加,镓锗浸出溶液中Fe2+质量浓度逐渐降低,Fe2+的氧化率逐渐升高。当过氧化氢加入量按理论化学反应摩尔比3.0加入时,Fe2+质量浓度为0.1 g/L,Fe2+的氧化率为99.20%;继续加大过氧化氢用量,Fe2+的氧化率继续增加;当过氧化氢加入量按理论化学反应摩尔比4.0加入时,镓锗浸出溶液中Fe2+质量浓度为0.01 g/L,Fe2+的氧化率升高了0.55%,达到了99.75%。结合考虑,过氧化氢按理论化学反应摩尔比4.0加入为宜。
2.3.2 反应时间对镓锗浸出液Fe2+的氧化率影响
过氧化氢添加量按照理论化学反应摩尔比4.0加入,设定反应温度50 ℃,开启搅拌装置至搅拌速度500 r/min,考察反应时间对镓锗浸出液Fe2+的氧化率影响,结果如图8所示。

图8 反应时间对镓锗浸出液Fe2+的氧化率影响
由图8可知,随着反应时间的延长,镓锗浸出溶液Fe2+质量浓度不断升高。反应时间为20 min时,镓锗浸出液Fe2+质量浓度为0.02 g/L,Fe2+的氧化率为99.83%;增加反应时间至60 min,Fe2+质量浓度增加至0.08 g/L,Fe2+的氧化率下降了0.49%,为99.34%。综合考虑,反应时间选用20 min为宜。
2.3.3 反应温度对镓锗浸出溶液Fe2+氧化率影响
过氧化氢按照理论化学反应摩尔比4.0加入,设定反应时间20 min,开启搅拌装置至搅拌速度500 r/min,考察反应温度对镓锗浸出溶液中Fe2+氧化率影响,结果如图9所示。

图9 反应温度对镓锗浸出液Fe2+的氧化影响
由图9可知,随反应温度升高,镓锗浸出溶液Fe2+质量浓度不断升高。当温度为15 ℃时,Fe2+质量浓度为0.02 g/L,Fe2+的氧化率为99.83%;继续升高反应温度至60 ℃时,Fe2+质量浓度升高至0.16 g/L,低于生产工艺控制标准,Fe2+的氧化率下降了1.14%,为98.69%。升高反应温度不利于Fe2+的氧化,主要原因是过氧化氢性质不稳定,升高温度加速了有效成分H2O2的分解反应,降低了参与氧化还原过程反应的过氧化氢有效成分量,直接导致了镓锗浸出液Fe2+的氧化率下降。根据工业生产的实际情况,反应温度选择45 ℃为宜。
3 综合扩大试验
经过上述单因素试验,不同的氧化剂氧化镓锗浸出液Fe2+的最优工艺条件见表2。

表2 氧化镓锗浸出液Fe2+的最优工艺条件
按照表2中三种氧化剂氧化镓锗浸出液Fe2+的最优操作条件,分别取1L镓锗浸出液进行试验,结果见表3。由表3可知,采用上述三种氧化剂,镓锗浸出溶液中的Fe2+浓度均可以达到工业生产的工艺控制标准。
为了确保氧化后液的萃取性能,采用以P507+N235为主要萃取体系的有机相进行萃取试验。萃取试验条件如下:相比(O/A)为2∶1,混合时间15 min,萃取温度35 ℃。记录不同氧化剂氧化镓锗浸出液与有机相萃取混合后的澄清分相时间,结果见表3。

表3 不同氧化剂扩大试验结果及萃取混合后分相时间
由表3可知,锰矿粉氧化镓锗浸出液Fe2+得到的溶液与P507+N235萃取体系进行萃取混合,澄清时无法正常分相,主要原因是工业产品锰矿粉含有10%的二氧化硅杂质,氧化过程中二氧化硅进入溶液形成硅胶,硅胶与萃取有机相形成乳状物,导致无法正常分相。
以市场采购价格工业过硫酸钠10 600元/t,过氧化氢1 800元/t,锰矿粉3 600元/t计算,氧化每千克Fe2+,生产成本分别为17 940元、4 190元和1 640元。因此,从生产成本方面分析,采用过氧化氢的生产成本最低。从安全环保角度分析,锰矿粉为工业产品,安全风险最低,过硫酸钠和过氧化氢均为强氧化剂,且过氧化氢通过液体罐车或立方桶运输,运输和使用过程较更为繁琐,管理更为严格;另外,过硫酸钠和过氧化氢均需要专用的储存场地,执行严格的使用规范,增加了生产管理难度。
综合以上方面考虑,在提取镓锗工业生产中,最终选择了工业级过氧化氢作为镓锗浸出液Fe2+的氧化剂。
4 结论
采用工业级过硫酸钠、锰矿粉和过氧化氢三种氧化剂进行氧化镓锗浸出液中Fe2+的试验。试验结果表明,氧化后镓锗浸出液中的Fe2+质量浓度均低于工艺标准0.05 g/L,Fe2+的氧化率均超过99.75%。从工业实际生产现状与生产成本综合考虑,选用工业过氧化氢作为镓锗浸出液Fe2+的氧化剂,最佳氧化工艺条件为:转速500 r/min,过氧化氢按照理论化学反应摩尔比4.0加入,反应温度45 ℃,反应时间20 min。工业应用中,采用工业级过氧化氢生产成本最低,但需要在生产现场建立专用储存场所和执行严格的使用规范,从而确保生产过程安全可控。
