维生素D联合阿司咪唑对肝癌细胞的抑制作用及其机制
2022-11-11徐俊丽陈昳菲李雅睿郭丹王如画
徐俊丽 陈昳菲 李雅睿 郭丹 王如画
(1西安市第一医院,陕西 西安 710000;2西安交通大学第一附属医院)
手术治疗对于早期发现的肝癌治疗效果好〔1〕。研究证实肝癌术后有较高的复发和肝内转移率,肝癌根治性切除术后5年的复发率高达80%〔2,3〕。由此肝癌的靶向治疗随着分子生物学的发展受到了越来越多的关注,寻找有效的抗肿瘤药物及其作用靶点至关重要。维生素D(VD)代谢的调节对于人体生理学是关键的,它通过VD受体(VDR)调节钙稳态相关的基因表达。此外,VD是一种重要的内源性抗癌剂,因为它可抑制细胞增殖,获得更加分化的表型并诱导细胞凋亡〔4,5〕。Eag1是EAG K+通道家族的成员,在VD的抗肿瘤作用中,Eag1表达对细胞的生长抑制起重要作用〔6~8〕。VD吸收入血后在肝脏和肾脏进行代谢,肾脏中的一个关键酶是 24-羟化酶(CYP24A1),主要起到降解骨化三醇的作用〔9〕,它的表达同时也受到骨化三醇与VDR的结合及与CYP24A1启动子中存在的VD应答元件(VDRE)的进一步相互作用而直接调节〔10〕。而阿司咪唑是一种通过特定通道对K+电流的功能性阻断,来达到对Eag1的抑制作用〔11,12〕。研究表明,在乳腺癌、宫颈癌及神经细胞瘤等研究中,阿司咪唑通过影响细胞K+通道可发挥其肿瘤细胞的增殖抑制作用〔13~15〕。但是阿司咪唑对于VD是否有药代动力学的作用,在肝癌中尚未得到证明,本研究旨在探讨VD联合抗组胺药物对于肝癌细胞的作用,并对其分子机制进行阐述。
1 材料与方法
1.1材料
1.1.1细胞株 人肝癌细胞系HepG2、Huh7获自中国科学院上海细胞库。
1.1.2主要试剂和药物 DMEM/High Glucose培养基、胎牛血清、胰蛋白酶购自HyClone公司;KCNH-1抗体购于Abcam公司;VDR抗体购自Wanleibio公司;甘油醛-3-磷酸脱氢酶(GAPDH)、辣根过氧化物酶(HRP)标记羊抗兔IgG及羊抗小鼠IgG购自北京天德悦生物科技有限公司;常规生物化学试剂购自西安赫特生物公司;VD3、阿司咪唑购自Solarbio公司。
1.2药品配制 将10 mg VD3溶于10 ml无水乙醇中,分装后避光4℃保存。将50 mg阿司咪唑溶于11 ml无水乙醇中,分装后避光4℃保存。
1.3细胞培养 将肝癌细胞HepG2、Huh7在含有10%胎牛血清、100 μg/ml链霉素和100 U/ml青霉素的DMEM中培养。将其保持在37℃,5%CO2湿润的培养箱中。取对数生长期细胞进行实验。每个浓度设5个复孔,实验重复3次。
1.4Western印迹 分别收集阴性对照组、1 μmol/L的VD3、5 μmol/L的阿司咪唑、VD3和阿司咪唑双重干预72 h的HepG2、Huh7细胞,提取蛋白,Bradford法测定蛋白含量,制备Western上样样品,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE);将电泳分离的蛋白电转膜至聚偏氟乙烯(PVDF)膜;用含5%脱脂奶粉的TBST(封闭液)封闭PVDF膜1 h;加VDR一抗(1∶500,含5%脱脂奶粉的TBST稀释)、Eag-1一抗(1∶1 000,含5%脱脂奶粉的TBST稀释)4℃孵育过夜,TBST充分洗涤PVDF膜3次,每次10 min;加HRP标记羊抗兔IgG及羊抗小鼠IgG(1∶5 000,3%牛血清白蛋白TBST稀释)孵育1 h,TBST洗涤PVDF膜3次,每次10 min;内参使用GAPDH(鼠抗人,稀释度1∶1 000)。电化学发光(ECL),X线胶片曝光,凝胶成像系统扫描,以目的条带与GAPDH条带灰度值的比值代表蛋白的表达水平。
1.5qRT-聚合酶链反应(PCR) 分别收集阴性对照组、1 μmol/L的VD3、5 μmol/L的阿司咪唑、VD3和阿司咪唑双重干预72 h的HepG2、Huh7细胞,利用Trizol进行RNA提取,然后进行逆转录的操作,具体方法参照试剂盒说明书进行。进行qRT-PCR检测时,以actin为内参。VDR基因引物序列:正义链:5′-TCTCCAATCTGGATCTGAGTGAA-3′,反义链:5′-GGATGCTGTAACTGACCAGGT-3′;CYP24-A1基因引物序列:正义链:5′-GATTTTCCGCATGAAGTTGGGT-3′,反义链:5′-CCTTCCACGGTTTGATCTCCA-3′。反应体系:2.0 μl cDNA,8.5 μl超纯水,上下游引物各1.0 μl,SYBR Green 12.5 μl,共计25 μl。反应条件:①预变性95℃,10 min;②变性:95℃,15 s;③退火/延伸:60℃,1 min,循环35~40次。
1.6四甲基偶氮唑蓝(MTT) 将HepG2和Huh7细胞以(3~5)×104个细胞/孔的密度接种在96孔板中,培养基中加入各组药物。培养24、48、72、96 h后,随后将细胞在含有0.5 mg/ml MTT的培养基中培养,并在黑暗中保持4 h。 除去上清液后,加入150 μl二甲基亚砜(DMSO)。 通过EnSpire Multimode Plate Reader测量490 nm处的光密度(OD)来测定细胞活力。按照公式:细胞存活率=实验组吸光值/阳性对照吸光值×100%。为提高实验结果的准确性,每组设置5个复孔。与实验平行,加细胞、培养基不加抑制剂的组为阳性对照组。
1.7统计学方法 采用SPSS20.0软件进行t检验、χ2检验和Fisher精确检验、Pearson相关性分析。
2 结 果
2.1VD联合阿司咪唑对肝癌细胞增殖的影响 与阴性对照组相比,24 h后VD和阿司咪唑可抑制肝癌细胞增殖,VD联合阿司咪唑组对肝癌细胞增殖的抑制最明显(均P<0.05)。见表1。
2.2VD联合阿司咪唑对肝癌细胞中VDR、Eag-1及CYP24A1 mRNA的表达影响 VD组、阿司咪唑组和VD联合阿司咪唑组VDR mRNA均显著高于阴性对照组,VD联合阿司咪唑组显著高于VD组及阿司咪唑组(均P<0.05);VD组、阿司咪唑组、VD+阿司咪唑组CYP24A1、Eag-1 mRNA均显著低于阴性对照组,VD联合阿司咪唑组显著低于VD组及阿司咪唑组(P<0.05)。见表2。
2.3VD联合阿司咪唑对肝癌细胞中Eag-1及VDR蛋白表达的影响 不同干预处理肝癌HepG2、Huh7细胞72 h后,各组Eag-1/GAPDH比较:阴性对照组最高,其次为VD组和阿司咪唑组,VD组+阿司咪唑组最低,差异均有统计学意义(P<0.05)。各组VDR/GAPDH比较:阴性对照组最低,其次为VD组和阿司咪唑组,VD+阿司咪唑组最高,差异均有统计学意义(P<0.05)。见表2、图1。
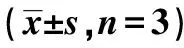
表1 不同干预对肝癌HepG2、Huh7细胞增殖的影响
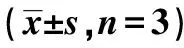
表2 各组肝癌HepG2细胞VDR、CYP24A1、Eag-1 mRNA的表达及Eag-1/GAPDH、VDR/GAPDH的灰度比值

1~4:阴性对照组;VD组;阿司咪唑组;VD联合阿司咪唑组图1 不同干预处理肝癌HepG2、Huh7细胞72 h后对Eag-1、VDR蛋白表达的影响
3 讨 论
VD已在体内和体外显示出显著的抗肿瘤作用〔3,16〕。致癌因子Eag1作为VD的靶点,同时又被阿司咪唑阻断活性〔17〕,研究报道高VDR和Eag1表达是肝癌肿瘤的特征〔7〕。本研究结果表明,阿司咪唑能够通过涉及CYP24A1下调和VDR表达上调的机制增强VD的抗肿瘤增殖作用,提示阿司咪唑能够改善VD的生物学效应。此外,阿司咪唑和VD均下调Eag1基因的表达,再加上阿司咪唑对Eag1通道活性的功能性阻断〔8〕,可进一步解释联合治疗的高效抗增殖作用。本研究结果表明,阿司咪唑可以改变VD的药代动力学,并暗示可以将VD与阿司咪唑组合用于未来的研究。本研究结果证实,当在阿司咪唑存在共培养时,VD增加其在表达VDR和Eag1基因细胞中的抗增殖活性。这种效应很可能是由于阿司咪唑依赖性VDR上调和CYP24A1识失活;Eag1表达和活性的抑制也同理。
