犬黑皮质素受体-4突变体D298N真核表达载体的构建及其在MDCK细胞中的表达
2022-11-11宋立先刘春红王占青徐学振
宋立先,刘春红, 王占青,高 蓉,徐学振
(滨州医学院烟台附院,山东烟台 264100)
黑皮质素受体系统由5个密切相关的G蛋白偶联受体组成(MC1R、MC2R、MC3R、MC4R和MC5R)。这些受体参与包括人类在内的多细胞动物许多重要的生物学过程[1]。研究发现,黑皮质素途径在体重调控中起着重要作用,下丘脑黑皮质素信号的增强导致食物摄入减少和能量消耗增加。单基因肥胖伴MC4R功能障碍与能量平衡调节密切相关。此外,MC4R基因突变与单基因肥胖和普通肥胖均有显著相关。MC4R基因突变与脂肪量和肥胖相关(FTO)基因的相互作用显著增加肥胖风险,尤其是青少年[2]。据文献报道,在美国有近12 800名肥胖患者与MC4R的缺陷有关[3]。
研究发现,有超过15亿的成人和儿童面临肥胖的困扰,肥胖已经作为公共健康问题受到人们的广泛关注,严重威胁人类健康[4]。全球疾病负担小组估计,2015年BMI值升高导致400万人死亡,其中2/3的人死于心血管疾病(CVD)[5]。肥胖与2型糖尿病的关系早已被人们所认识,并清楚地解释了许多国家2型糖尿病的高患病率。许多肥胖高危患者的特征是代谢和心血管危险因素并存[6]。众所周知,过度肥胖对流感易感性增加,包括近年在全世界范围流行的新型冠状病毒,对人类的危害堪称是灾难性的。人们通常认为,饮食结构不恰当和缺乏运动是导致肥胖的主要原因,但是有些人即使是健康的生活方式,仍然会面临肥胖的困扰,因为导致肥胖的原因除了生活方式,还有基因因素参与[7]。有学者在对UK生物银行的0.5亿份样本进行筛查,发现了61个MC4R突变体,通过分析发现,均与BMI、肥胖相关代谢性心肌病密切相关[8]。因此,迫切需要深入探究MC4R突变导致的肥胖。
MC4R是一个有996个碱基配对的七次跨膜受体,定位染色体18Q21.3上,主要分布于下丘脑[7]。犬被认为是研究人类疾病和包括肥胖在内的功能失调机制的理想生物医学模型[9]。犬MC4R基因由编码332个氨基酸的单一外显子组成,定位在1号染色体上,在各物种之间存在高度同源性[10]。为了探讨MC4R突变和肥胖之间的关系,笔者成功构建了犬 D298N突变体的真核表达载体,后将其导入MDCK细胞内,旨在为进一步探讨MC4R突变引起的蛋白功能变化提供信息,同时也为人类肥胖的基因治疗提供科研数据。
1 材料与方法
1.1 材料
1.1.1质粒、菌株及细胞系。带His标签的pcDNA3.1载体、DH5α、PMD18-T Vector、MDCK细胞。
1.1.2主要试剂。Beagle犬新鲜血液;聚合酶rTaqDNA、X-Gal、异丙基硫代半乳糖苷、限制性内切酶(XhoⅠ和BamHI)、DNA Marker、T4-DNA 连接酶、RNA PCR提取试剂盒;Trizol Reagent、培养基、Anti-myc 抗体;G418抗生素、FuGENE HD 转染试剂盒;胎牛血清等。
1.2 方法
1.2.1引物设计。根据GenBank犬MC4R基因,设计引物序列:上游引物A,5′-CGGGATCCGCCAGGATGAACTCCACCCTTCAGC-3′;中间引物B,5′-ATGAGAGGGTTGATGATGGAG-3′;中间引物C,5′-CTCCATCATCAACCCTCTCAT-3′;下游引物D,5′-CCGCTCGAGGTATCTGCTAGACAAGTCAC-3′。引物AB扩增基因长度为115 bp,引物 CD扩增基因长度为902 bp,引物AD扩增基因长度为1 019 bp。
1.2.2提取犬血DNA,扩增D298N突变体基因PCR。
(1)以引物AB、CD进行PCR反应获得基因片段,分别命名为产物AB、CD。扩增完毕取目的产物20 μL,用凝胶电泳进行检测,然后将凝胶进行回收、纯化,取2 μL进行电泳检测。
(2)以引物AB、CD产物为模板,用引物A、D进行PCR反应获得突变体的DNA片段。扩增完毕取目的产物20 μL,用凝胶电泳进行检测,然后将凝胶进行回收、纯化,取2 μL进行电泳检测。
1.2.3获得的DNA片段进行TA克隆、测序。将突变体D298N的DNA片段连接到pMD18-T载体,命名pMD18-T-cMC4R-D298N,转化到DH5α感受态细胞进行蓝白斑筛选,提取质粒,用BamHI、XhoI进行酶切鉴定,筛选阳性质粒送测序,并与犬MC4R基因序列进行比较。
1.2.4重组真核表达载体构建、测序。用BamHI、XhoI将TA克隆阳性质粒和带His标签的pcDNA3.1真核表达载体进行双酶切、电泳,回收目的片段。用T4 DNA连接酶将带His标签的pcDNA3.1真核表达载体和MC4R片段在16 ℃条件下14 h进行连接,将产物转化到DH5α细胞,用抗生素平板筛选,挑取单克隆菌落鉴定。测序正确后扩大培养,提取质粒DNA。
1.2.5将基因转染到MDCK细胞。将处于对数生长期的MDCK细胞重悬在培养基中,接种细胞,培养24 h,使细胞融合率达75%,把空质粒及重组质粒转染到MDCK细胞内。转染24 h后,继续培养1~2 h,收集细胞。
1.2.6用RT-PCR方法检测基因的表达。转染3 d后,提取未转染细胞、空载体转染细胞、重组体转染细胞的总RNA,进行凝胶电泳检测。用RNA PCR 试剂盒进行RNA反转录。用cDNA做模板,引物A和D进行PCR反应。取20 μL PCR产物,用凝胶电泳检测。
1.2.7用Western blot方法检测蛋白的表达。转染3 d后,用EDTA-胰酶对未转染的细胞、空载体转染细胞、重组体转染细胞进行消化,并提取蛋白质,将蛋白质进行定量检测(分光光度计),然后灌胶、点样、电泳、转膜、封闭,加入His抗体,孵育过夜,与羊抗鼠二抗反应、显色。
2 结果与分析
2.1 犬的基因组DNA条带用Beagle犬的新鲜全血提取DNA,结果见图1。
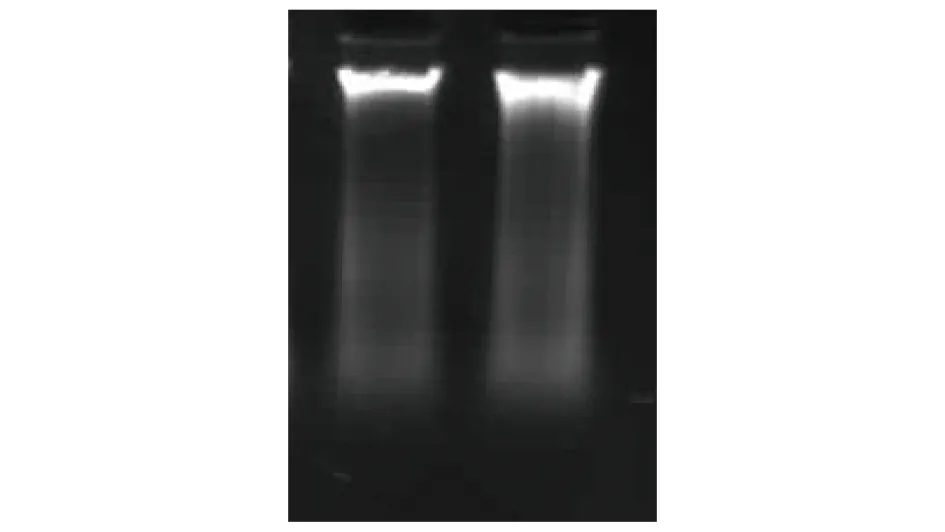
图1 犬基因组DNA 1%琼脂糖凝胶分离结果
2.2 犬突变体D298N-MC4R目的片段电泳结果用overlap PCR技术首先扩增115和902 bp 2个片段,再以这2个扩增得到的片段为模板,扩增D298N-cMC4R目的片段,扩增产物约1 000 bp(图2) 。

注:1.犬MC4R 115 bp目的产物;2.犬MC4R 902 bp目的产物;3.D298N-cMC4R目的产物;M.DNA Marker 100 bp
2.3 载体pMD18-T-cMC4R-D298的酶切、测序载体pMD18-T的分子量约2.7 kb,扩增PCR产物约1.0 kb,预测pMD18-T-cMC4R-D298N 的大小约为3.7 kb,提取pMD18-T-cMC4R-D298N 酶切、凝胶电泳回收产物(图3)。测序结果重组表达质粒2处碱基不同,碱基T(777位)→C,碱基G(892)→A(引入的突变位点)。

注:1.pMD18-T-cMC4R-D298N 3 700 bp目的产物;2.pMD18-T 的2 700 bp条带和犬cMC4R-D298N的1 000 bp目的产物;M.DNA Marker
2.4 重组体酶切、测序pcDNA3.1-myc-His/A分子量约5.5 kb,PCR扩增产物大小约1 000 bp,可以预测pcDNA3.1-myc-His/A-cMC4R的大小6.5 kb,提取的重组体酶切、凝胶电泳回收产物见图4。测序结果同T—A克隆结果见图5,第298位的天冬氨酸变成天冬酰胺,表明成功构建带突变位点的目的载体。
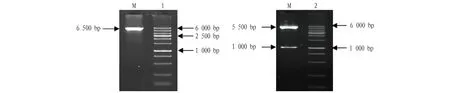
注:1.pcDNA3.1- myc-His/A-cMC4R重组体;2.pcDNA3.1-myc-His/A-cMC4R经Xho I/BamH 酶切产物;M.100~6000 bp DNA分子量对照

图5 犬MC4R-D298N测序结果
2.5 重组体转染MDCK细胞、RT-PCR检测目的基因表达将重组表达载体pcDNA3.1-myc-His/A-cMC4R-D298N转染入MDCK细胞(图6)培养3 d,提取细胞总RNA并检测,结果见图7。用RT-PCR进行反转录,凝胶电泳结果见图8。从图8可见,空载体转染细胞组、未转染细胞组在1 000 bp处无条带,表明无目的基因表达;转染重组体细胞组在约1 000 bp处有亮带,表明目的基因成功表达。

注:1.100倍光镜下未转染细胞;2.100倍光镜下转染3 d后细胞Note:1.The cells without transfection(100×); 2.The cells were transfected with recombinant plasmid after 3 days(100×)

注:1.转染重组体MDCK细胞总RNA;2.转染空载体MDCK细胞总RNA;3.未转染MDCK细胞总RNA
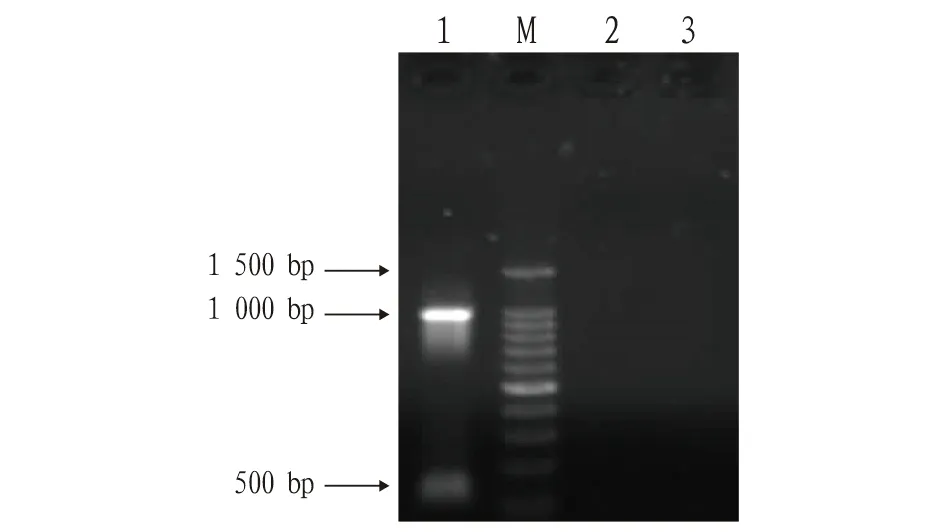
注:1.转染重组体的MDCK细胞RT-PCR结果;2.转染空载体的MDCK细胞RT-PCR结果;3.未转染的MDCK细胞RT-PCR结果;M.100 bp DNA 分子量对照
2.6 Western blot检测蛋白表达犬的MC4R基因由332个氨基酸组成,编码蛋白的分子量为36.9 kD。载体融合标签分子量大小约为3 kD,重组体表达的融合蛋白预期大小约为40 kD。Western blot检测蛋白表达结果见图9,可见融合蛋白在40 kD处显示亮带,空载体和未转染组处无亮带,原因为myc基因作为癌基因,细胞本身也有少量表达,因此空载体和未转染细胞组在40 kD处有暗带。

注:A,1.D298N重组体转染细胞组;2.空载体转染细胞组; 3.转染野生型重组体细胞组;4.未转染细胞组。B,Beta actin 内参
3 讨论
随着肥胖病例逐年上升,迫切需要找到一种能调节体重和食欲的治疗方法。MC4R是新疗法的一个有吸引力的潜在靶点,MC4R被激活后,MC4R调节能量平衡并减少脂肪生成。同时可以识别多种细胞外刺激物,包括小分子、离子、光子、肽和蛋白质,并将刺激物穿过不渗透的膜屏障传递到细胞内区域,从而影响细胞功能的变化。信号通过蛋白质相互作用和激活事件的级联传递,从而引起细胞功能的细胞内生化介质(如第二信使)水平的变化,从而调节多种生理功能。MC4R调节脂肪组织的形成和能量平衡,被认为是新型肥胖治疗的单基因靶点[11]。
MC4R作为瘦素-黑素皮质素途径的一部分,在下丘脑体重调节和能量消耗中起着关键作用。MC4R突变可导致各种MC4R信号通路发生截然不同的变化,并突出了受体突变综合表征的重要性,是单基因肥胖最常见的原因。迄今为止,在肥胖患者中发现的许多突变在体外系统的过度表达中具有功能特征,其中大部分缺少Gs信号途径[12]。近年来,有对牛、鸡、猪、犬的MC4R基因的相关研究,其中研究较多的为猪和犬。黑皮质素受体所有亚型中位于第298位的Asp298的基因序列高度保守[13]。有文献报道,在猪MC4R基因298位氨基酸突变与猪背膘的肥厚呈相关性[14],而犬的该位点是否存在突变及突变后对蛋白功能是否有影响,目前尚鲜见文献报道。然而,今后要想深入研究蛋白功能,载体构建即是第一步工作。
笔者所在课题组曾在前期研究中成功构建犬MC4R-D90N突变体的真核表达载体,并在融合蛋白中成功表达[15]。目前国内有关犬MC4R-D298N氨基酸突变的研究较少,基于此,笔者构建了突变体MC4R-D298N重组真核表达载体,第298位的天冬氨酸变成天冬酰胺,后转染到犬的细胞中并获得成功表达。更多突变位点的发现,尤其是高度保守区域氨基酸突变能否导致蛋白功能变化为进一步探索肥胖的原因提供了更多信息。针对肥胖患者饮食调控的治疗过程中,手术治疗并未在长期临床效果中获益,更加强调了MC4R激动剂药物治疗的重要性,且只有通过基因筛查后才可以评估患者是否适合手术治疗。因此,针对治疗肥胖患者的药物研发更加重要。筛选导致肥胖的危险基因,当前不仅是为了研究常规治疗肥胖药物,甚至可为儿科内分泌学筛选导致肥胖的基因提供指导意见[16]。因此,可以通过基因突变位点的筛查,对存在MC4R基因突变的儿童进行前期干预,包括饮食、运动及药物干预。综上所述,该研究为MC4R基因突变引起蛋白功能变化、MC4R与配体结合后2个信号传导通路之间联系机制提供了前期科研基础,同时为临床上研发治疗肥胖药物及从儿童期预防肥胖的前期干预提供了科研数据。
