VDAC1参与调控BCG感染RAW264.7细胞凋亡
2022-11-11宋阿北李瑞乾缪西鹏谢玉杰许立华
宋阿北,李瑞乾,缪西鹏,谢玉杰,高 瑞,许立华
(宁夏大学 农学院,宁夏 银川 750021)
结核病(Tuberculosis,TB)是主要由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)和牛分枝杆菌(Mycobacteriumbovis)所引起的一种人畜共患性慢性消耗性传染病[1-2]。在MTB感染过程中,宿主免疫系统对感染的应答是首先通过启动炎症反应和吞噬作用杀灭并清除病原体[3]。如果感染不能终止并持续进行,促进细胞死亡的信号通路就会被激活,从而从宿主生物体中清除受感染的细胞[3]。最终感染的巨噬细胞可能面临坏死、凋亡、自噬3种结局。在典型的坏死中,被侵袭的细胞肿胀、破裂,细胞内容物溢出到周围组织,引起急性炎症[4]。坏死也可能是肉芽肿形成并导致空洞化、液化和组织损伤,使细菌数量的大量增加的主要原因[5]。而在细胞凋亡中,细胞按时间顺序崩解其细胞骨架,解体核膜,碎裂DNA,并将细胞碎片包装成小的“凋亡小泡”,而不会泄漏细胞内容物[2]。虽然在微生物感染中细胞凋亡可能会部分导致组织损伤,但总的来说细胞凋亡的启动可能对宿主有益,因为其促进了微生物的清除[6]。此外,巨噬细胞的凋亡还可以通过激活先天性和适应性免疫反应来限制分枝杆菌感染。比如包含细胞质、细胞器或微生物的凋亡小体通过受体介导的吞噬作用被巨噬细胞和树突状细胞吞噬,然后降解并通过MHC Ⅱ类分子递呈促进先天免疫和适应性免疫[7-8]。细胞凋亡在宿主抵御MTB感染过程中发挥着重要作用。
电压依赖性阴离子通道(voltage dependent anion channel,VDAC)是一类线粒体膜蛋白(共VDAC1、VDAC2和VDAC3 3种亚型),主要位于线粒体外膜。研究表明,VDAC1可通过介导Cyt C、AIF、Smac/DIABLO和内切酶G的释放从而诱导细胞凋亡。有报道指出VDAC在病毒感染中的作用。JITOBAOM等[9]发现VDAC1对登革病毒(DENV)在哺乳动物细胞中的复制非常重要,通过siRNA下调VDAC1可显著降低DENV感染率。LI等[10]发现了VDAC在传染性法氏囊病(IBD)中的作用,IBD是一种由传染性法氏囊病毒(IBDV)引起的免疫抑制禽病。IBDV蛋白VP5与活化蛋白激酶C1受体(RACK1)和VDAC2相互作用形成复合物,抑制细胞凋亡,促进病毒复制[11]。除此之外,VDAC1还被确定为线粒体抗病毒信号蛋白MAVS的靶点,并参与MAVS介导的病毒感染引发的细胞凋亡[12]。目前被普遍认可的VDAC介导内源性凋亡途径主要有2个:VDAC1与VDAC1、Bax/Bak等Bcl-2促凋亡蛋白相互作用,发生同源寡聚或异源寡聚,在线粒体外膜上形成大的蛋白质传输通道,导致Cyt C等促凋亡因子释放到细胞基质进而引起细胞凋亡[13-14]。
本研究通过VDAC1的小干扰RNA(siRNA-VDAC1)和靶向VDAC1抑制剂VBIT-4分别处理RAW264.7细胞,并结合BCG感染,通过检测各处理组细胞凋亡相关指标的变化,以期揭示VDAC1是否参与BCG感染小鼠巨噬细胞凋亡及其调控作用机制,为结核病的预防和治疗提供新思路。
1 材料与方法
1.1 主要试剂全蛋白提取试剂盒、AnnexinV-FITC/PI细胞凋亡检测试剂盒购自南京凯基公司;BCA定量试剂盒、Cell ROX、eBioscienceTMJC-1Mitochondrial Membrane Potential Dye购自Invitrogen公司;4%多聚甲醛、Tritonx-100、一抗稀释液购自北京索莱宝科技有限公司;HRP化学发光试剂盒购自美国BD公司;兔抗鼠VDAC1一抗购自美国Abcam公司和生工生物工程(上海)股份有限公司;LipofectanmineTMRNAiM-AX Transfection Reagent购自美国ZETA-LIFE公司;兔抗鼠PARP、Caspase-3一抗购自武汉爱博泰克科技有限公司;兔抗鼠Caspase-9一抗购自美国CST公司;兔抗鼠Cyt C一抗、辣根过氧化物酶标记二抗购自美国Proteintech公司。
1.2 菌株与细胞系牛分枝杆菌减毒株(BCG)购自成都生物制品研究所有限公司,采用常规方法进行培养,每月传代1次。小鼠肺泡巨噬细胞(RAW264.7)购自中科院上海细胞研究所,以胎牛血清(FBS)∶高糖DMEM为1∶9的比例配制培养液,37℃、5% CO2培养箱中培养,每1~2 d 传代1次。
1.3 引物设计与合成使用Primer Premier 6.0软件设计相关PCR引物序列,由生工生物工程(上海)股份有限公司合成。引物序列见表1。

表1 实时荧光定量PCR引物信息
1.4 小干扰RNA的构建根据VDAC mRNA全长序列,在VDAC mRNA不同位点处设计并合成了3段小干扰序列。小干扰RNA序列见表2。
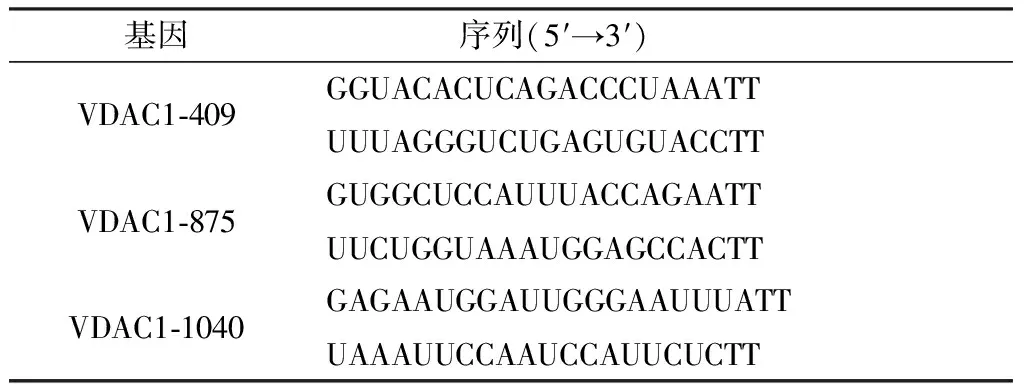
表2 小干扰RNA序列
1.5 小干扰RNA的转染将RAW264.7细胞在感染前12 h铺于6孔板中进行培养(1×106个/孔),设置Control组、BCG组、干扰组和干扰+BCG组,转染过程参照LipofectanmineTMRNAiM-AX Transfection Reagent说明书进行。转染24 h后用BCG感染(MOI=1∶10)组和干扰+BCG组。
1.6 荧光定量PCR检测参照北京天根生化科技有限公司总RNA提取试剂盒说明书提取细胞总RNA;参照全式金TransStart One-Stept cDNASynthesis SuperMix说明书进行反转录;反应结束后参照全式金TransStart Tip Green qPCR SuperMix说明书,利用合成的cDNA配制荧光定量PCR反应体系,进行荧光定量PCR反应。
1.7 噻唑蓝比色法(MTT)检测RAW264.7细胞存活率将RAW264.7细胞提前12 h接种于96孔板(5×103个/孔),于37℃、5% CO2细胞培养箱进行培养。然后用BCG感染细胞,并设置(6,12,18,24 h)时间梯度,每个处理组设置4个复孔,每孔加入50 μL 1× MTT溶液,37℃孵育4 h后加入100 μL DMSO,37℃避光振荡培养15 min后使用酶标仪测D490值,按照公式细胞存活率%=[(处理组D490值-空白组D490值)/(对照组D490值-空白组D490值)]×100%,计算细胞存活率。试验重复3次,取平均值。
1.8 流式细胞检测细胞凋亡率具体步骤参照AnnexinV-FITC/PI细胞凋亡检测试剂盒说明书进行。
1.9 流式细胞检测ROS积累水平具体步骤参照活性氧(ROS)检测试剂盒说明书进行。
1.10 流式细胞检测线粒体膜电位具体步骤参照eBioscienceTMJC-1 Mitochondrial Membrane Potential Dye说明书进行。
1.11 线粒体胞浆蛋白的提取具体步骤参照细胞线粒体分离试剂盒说明书进行。
1.12 Western blot检测RAW264.7细胞以1×106个/孔接种于6孔板培养皿中,按试验设计处理后,使用南京凯基全蛋白提取试剂盒按说明书操作提取蛋白,使用BCA法试剂盒按说明书操作检测蛋白浓度后进行SDS-PAGE凝胶电泳,转膜后采用Western blot分别测定Caspase-3(一抗稀释液稀释1∶1 000)、Caspase-9(一抗稀释液稀释1∶1 000)、PARP(一抗稀释液稀释1∶1 000)、VDAC1(一抗稀释液稀释1∶1 000)以及β-actin(一抗稀释液稀释1∶1 000)蛋白表达水平。
1.13 免疫荧光染色检测Caspase-3剪切体表达情况取12孔板,每孔提前置入20 mm细胞爬片,每孔接入5×104个RAW264.7细胞,于37℃、5% CO2细胞培养箱进行培养12 h。按试验组设计处理结束后,吸弃上清,PBS润洗1次,每孔加入500 μL 4%多聚甲醛,常温固定20 min。吸弃多聚甲醛,每孔加入500 μL PBS清洗3次,每次5 min。每孔加入500 μL 3% TritonX-100(PBS稀释),常温通透20 min。吸弃TritonX-100,每孔加入500 μL PBS清洗3次,每次5 min。每孔加入500 μL 3% BSA(PBS)稀释常温封闭60 min,结束后吸弃,每孔加入Caspase-3抗体(兔抗鼠,3% BSA稀释,1∶500)500 μL,37℃孵育过夜。吸弃一抗,每孔用500 μL PBS清洗3次,每次5 min。加入荧光二抗(羊抗兔,PBS稀释1∶1 000)500 μL,避光常温孵育2 h。孵育结束,吸弃荧光二抗,每孔加入500 μL PBS避光清洗3次,每次5 min。用含DAPI的封片剂封片,置于暗盒中储存,尽快使用激光共聚焦显微镜观察。
2 结果
2.1 BCG感染对RAW264.7细胞VDAC1表达的影响依据BCG感染不同时间设置处理组,检测各组VDAC1 mRNA及蛋白表达水平。各时间段BCG感染处理后RAW264.7细胞的VDAC1 mRNA及蛋白表达量均高于对照组,并在感染12 h后比较显著(P<0.001)。结果表明,BCG感染可诱导RAW264.7细胞内VDAC1表达上调(图1)。
2.2 小干扰RNA的验证根据VDAC1 mRNA全长序列,通过生物信息学分析设计针对不同位点的小干扰RNA,并利用脂质体转染方法将si-VDAC1转染至小鼠巨噬细胞RAW264.7中,转染24 h时通过荧光显微镜观察转染效果(图2A~C)。随后用Real-time PCR以及Western blot验证小干扰RNA敲减效率。3个不同干扰位点的小干扰RNA中,si-VDAC1-1040 会使mRNA和蛋白的表达下调较为显著(P<0.001)(图2D~F)。因此,后续试验均采用si-VDAC1-1040,转染时间选择24 h。
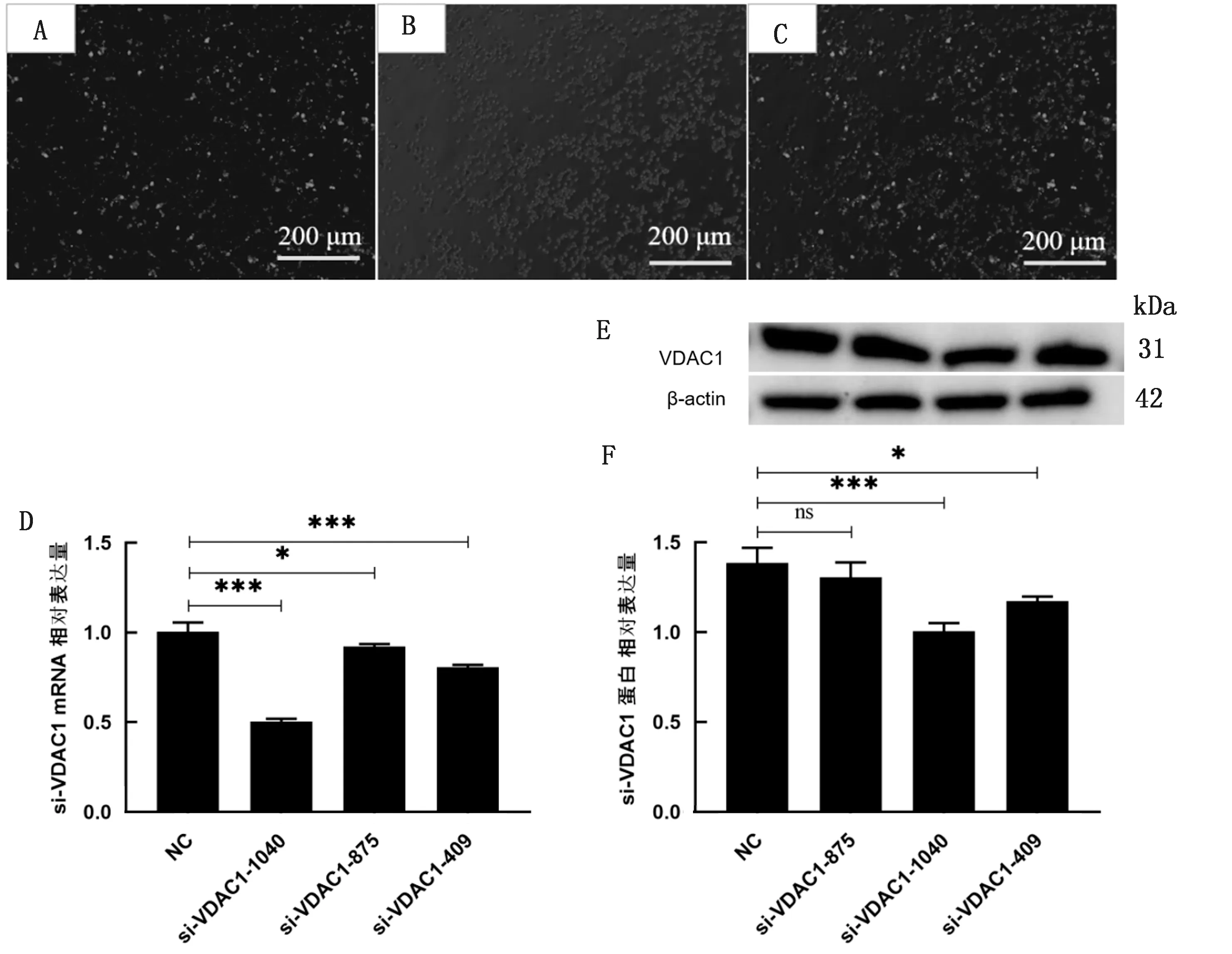
A.暗场下si-VDAC1转染效果图;B.明场下si-VDAC1转染效果图;C.Merge后si-VDAC1转染效果图;D.3条si-VDAC1 mRNA水平验证;E、F.3条si-VDAC1 蛋白水平验证
2.3 VDAC1对BCG感染RAW264.7细胞存活率的影响MTT法检测细胞存活率,结果显示BCG单独处理组细胞存活率显著下调(P<0.001);si-VDAC1单独处理组细胞存活率变化不明显;BCG和si-VDAC1共同处理组相对于BCG组细胞存活率显著上调(P<0.001)(图3)。由此可见,BCG感染巨噬细胞后可显著降低细胞存活率,且VDAC1参与了该过程。
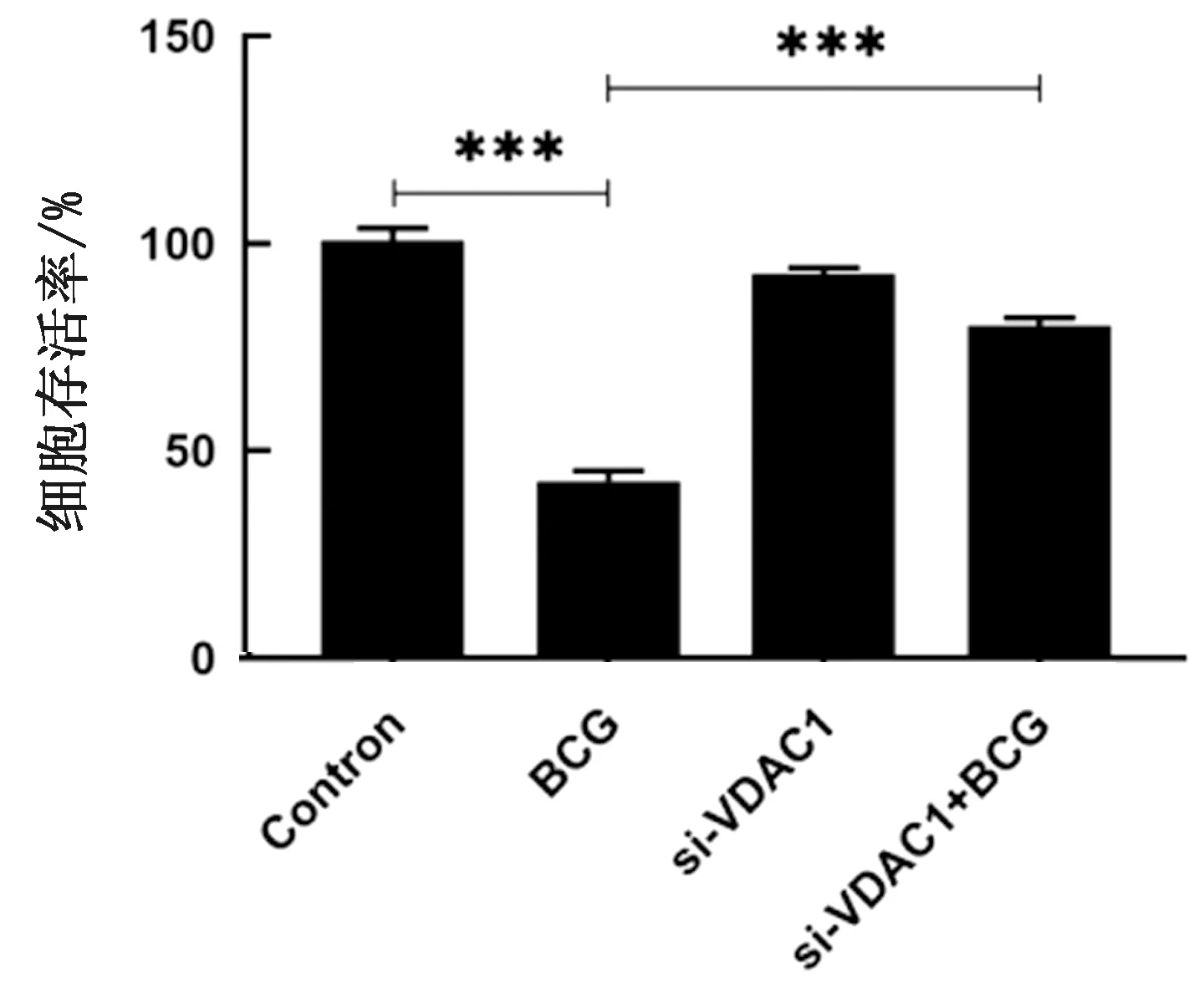
图3 VDAC1对BCG感染RAW264.7细胞存活率的影响
2.4 VDAC1对BCG感染致RAW264.7细胞凋亡影响采用AV/PI双染色法检测4个处理组细胞凋亡率,结果显示,细胞分散在4个象限,其中AnnexinV阳性细胞为右上和右下2个象限,即为凋亡细胞所占比例(图4A)。通过GraphPad Prism 9.0软件分析试验数据,结果显示BCG感染极显著提高细胞凋亡率(P<0.001),达到52.12%(图4B);而当BCG与si-VDAC1结合共同处理细胞后,细胞凋亡率显著低于BCG单独处理组(P<0.001)(图4C)。
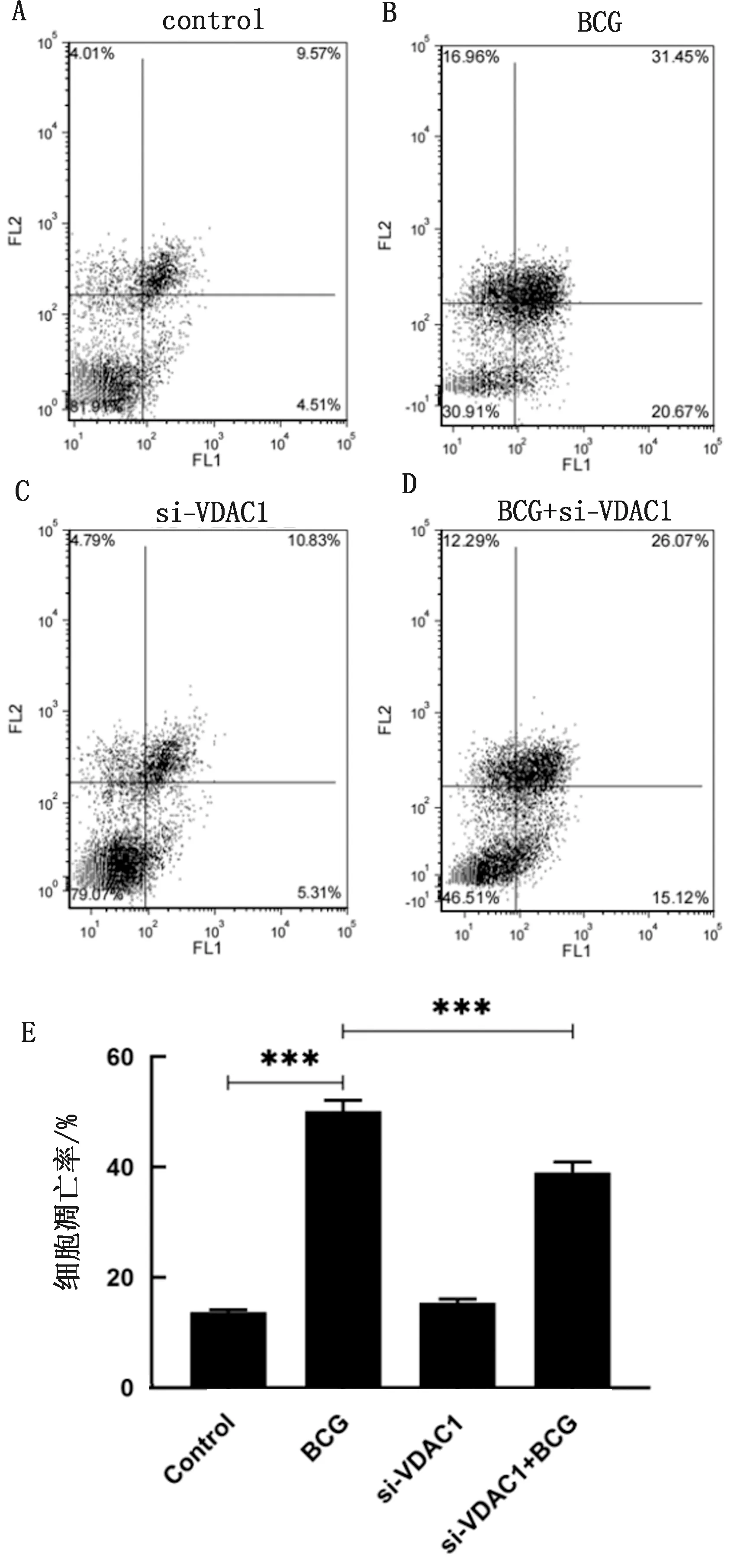
A~D.细胞凋亡散点图;E.细胞凋亡率
2.5 VDAC1对BCG感染RAW264.7细胞内ROS含量的影响为了验证VDAC1参与诱导的细胞凋亡是否与ROS积累有关,比较BCG单独处理和BCG与si-VDAC1共同处理组ROS表达情况(图5A、B)。结果显示,BCG单独处理时细胞内ROS含量显著升高(P<0.001);共处理组荧光强度显著降低(P<0.001)(图5D)。表明VDAC1参与了BCG感染巨噬细胞ROS在细胞内的积累。
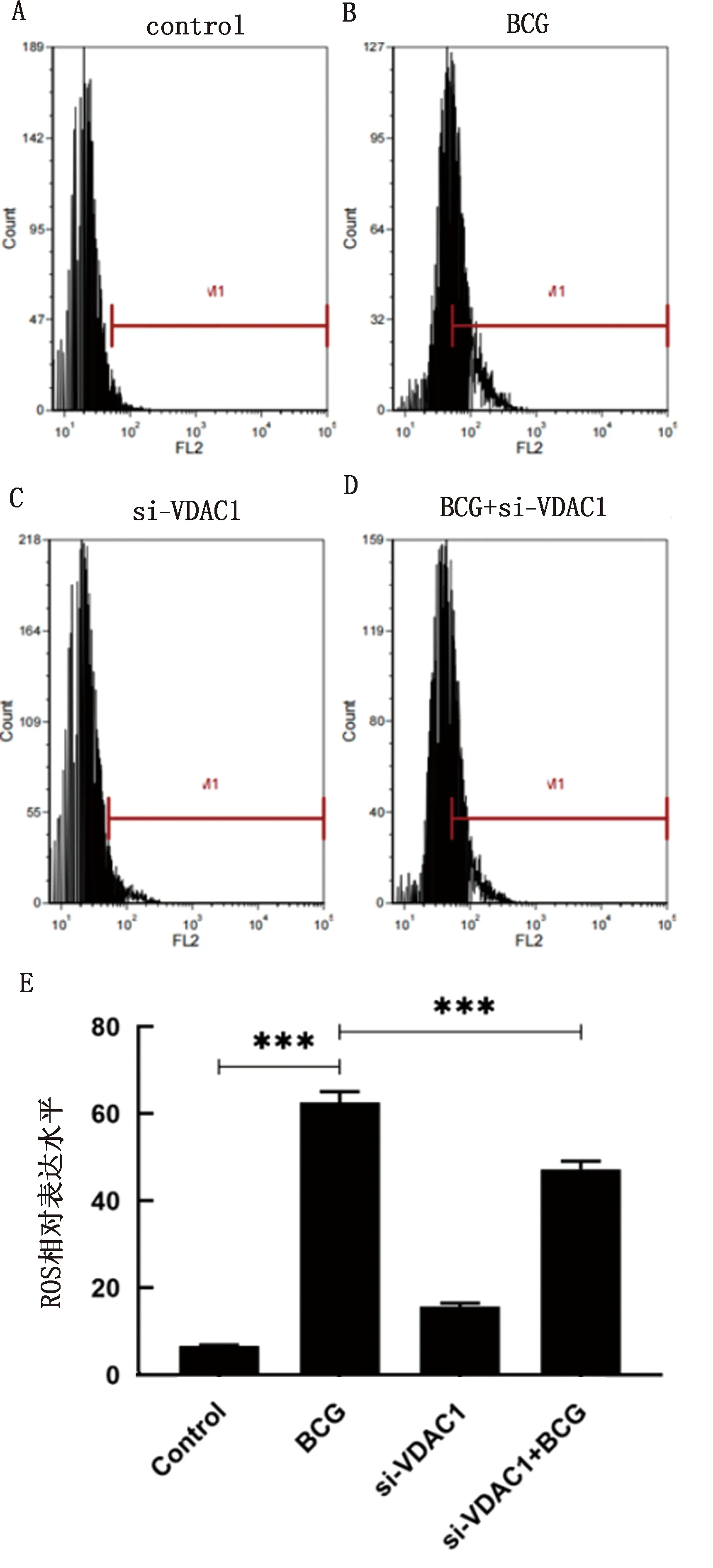
A~D.流式细胞仪检测细胞ROS含量累积;E.ROS相对表达结果分析图
2.6 VDAC1对BCG感染RAW264.7线粒体膜电位(MMP)的影响MMP是评价线粒体完整性和功能的重要指标之一。结果如图6所示,BCG降低RAW264.7细胞线粒体膜电位,与对照组相比,差异极显著(P<0.001)。当用BCG与si-VDAC1共同处理细胞后,BCG诱导的MMP下降被明显恢复至对照组水平,且与BCG单独处理组相比,差异极显著(P<0.001)。结果提示VDAC1与BCG所致的细胞MMP下降有关。
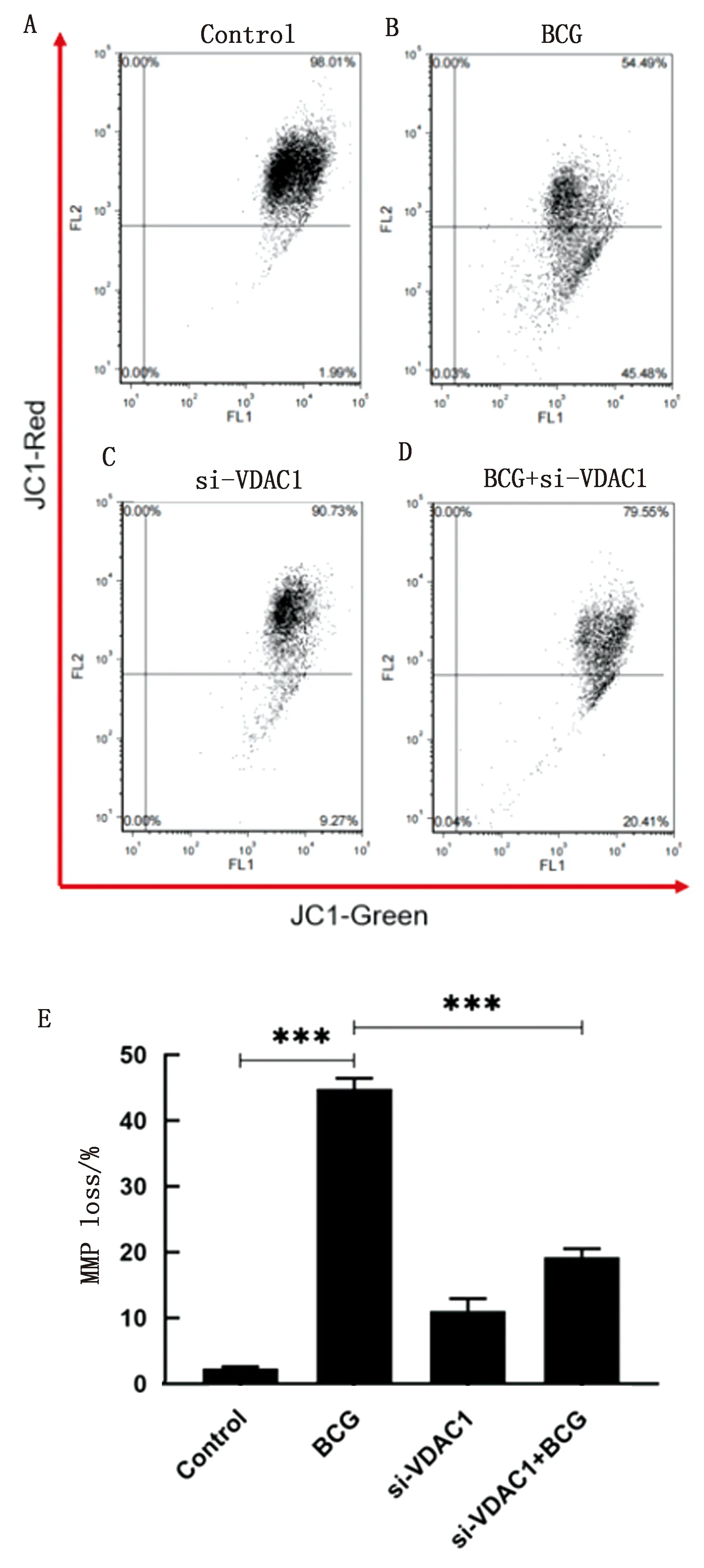
A~D.流式细胞术检测线粒体膜电位变化;E.结果分析图
2.7 VDAC1对BCG感染RAW264.7细胞凋亡相关基因表达的影响为验证VDAC1是否参与由BCG诱导RAW264.7细胞凋亡过程,通过实时荧光定量PCR检测Caspase-3、Caspase-9、PARP的mRNA水平。结果显示,BCG单独感染RAW264.7细胞后,Caspase-3、Caspase-9、PARP的mRNA水平表达量均显著上调(P<0.001);当干扰VDAC1后RAW264.7的3种促凋亡基因mRNA水平下调(P<0.001)(图7)。表明VDAC1可显著促进BCG感染巨噬细胞凋亡相关基因Caspase-3、Caspase-9、PARP的mRNA水平。
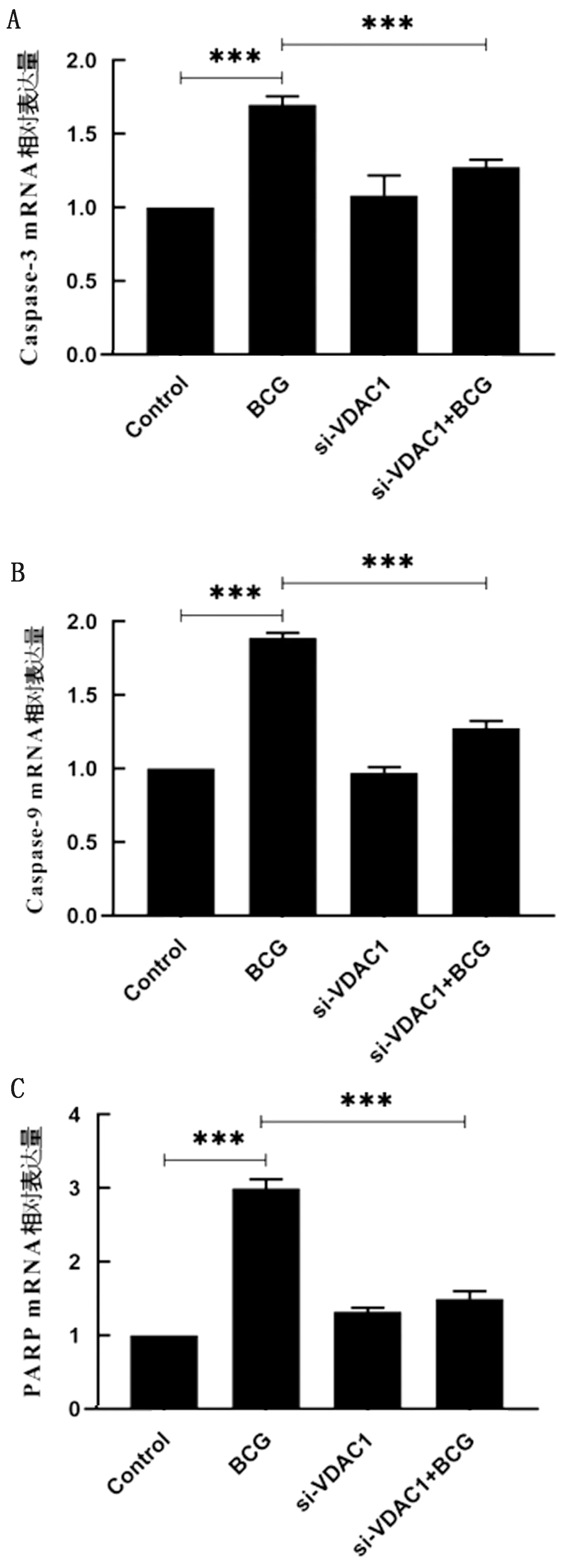
A.Caspase-3 mRNA表达量;B.Caspase-9 mRNA表达量;C.PARP mRNA表达量
2.8 VDAC1对BCG感染巨噬细胞凋亡相关蛋白的影响采用Western blot检测凋亡相关蛋白。结果显示,BCG单独感染RAW264.7细胞后,Cleaved-Caspase3、Cleaved-Caspase9、Cleaved-PA-RP蛋白表达量均增加。干扰VDAC1后,与BCG单独处理组相比,RAW264.7中这3种蛋白含量均下降(图8)。说明VDAC1与BCG感染巨噬细胞凋亡蛋白Cleaved-Caspase3、Cleaved-Caspase9、Cleaved-PA-RP表达变化有关。
2.9 VDAC1对BCG感染巨噬细胞所致的胞浆Cyt C表达的影响Cyt C从线粒体内释放到胞浆是线粒体凋亡的一个重要特征。因此,分析了VDAC1对Cyt C释放情况的影响。结果表明(图8G、H),与对照组相比,BCG处理组细胞的Cyt C在胞浆中的含量上升。当用BCG与si-VDAC1共处理时,发现si-VDAC1降低BCG诱导的Cyt C在胞浆中的表达且与BCG单独处理组相比,差异极显著(P<0.001)。结果提示VDAC1参与BCG诱导的Cyt C从线粒体释放到细胞胞浆。
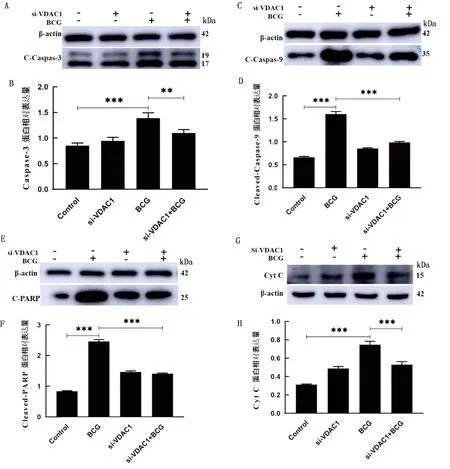
A、B.Caspase-3 剪切体蛋白表达量;C、D.Caspase-9 剪切体蛋白表达量;E、F.PARP 剪切体蛋白表达量;G、H.Cyt C 蛋白表达量
2.10 VDAC1参与BCG感染RAW264.7细胞凋亡的调控机制为了进一步探讨VDAC1在BCG诱导细胞线粒体凋亡中的调控作用机制,检测了VBIT-4对BCG感染RAW264.7后VDAC1寡聚体形成的影响。如图9所示,BCG感染后,细胞内绿色荧光斑点显著增加,当使用VBIT-4和BCG共同处理时,显著减少了细胞内的绿色荧光斑点数量。说明BCG感染增加了细胞内Caspase-3剪切体的含量,而使用VDAC1寡聚抑制剂VBIT-4之后抑制了BCG感染后细胞内Caspase-3的活化。如图10F、H所示,单独BCG处理组显著(P<0.001)促进VDAC1寡聚体的形成。当使用VBIT-4和BCG共同处理时显著降低了VDAC1寡聚体的形成。因此,证明VBIT-4对VDAC1的寡聚有抑制作用。采用Western blot检测凋亡相关蛋白,结果显示,BCG单独感染RAW264.7细胞后,Caspase-3、Caspase-9、PARP蛋白剪切体在细胞内的含量均显著增加(图10A~G);当使用VBIT-4和BCG共同处理时,RAW264.7中表达的这3种蛋白含量均显著减少(P<0.001)。
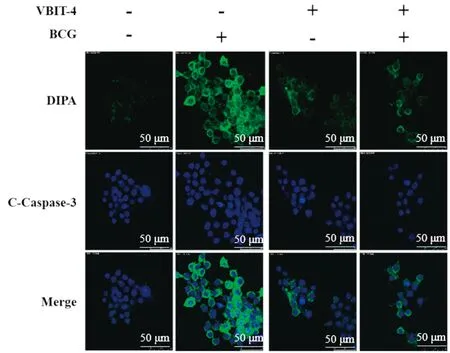
图9 VBIT-4对BCG诱导的巨噬细胞中Caspase-3蛋白表达变化
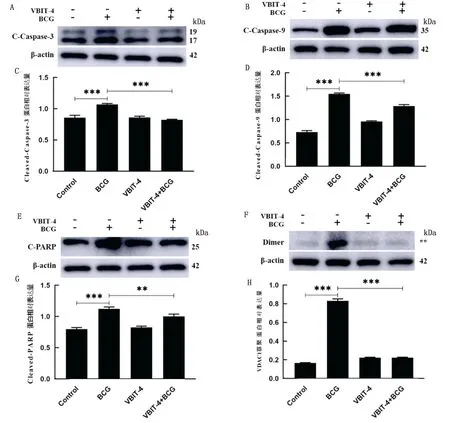
A、C.Caspase-3 剪切体蛋白表达量;B、D.Caspase-9 剪切体蛋白表达量;E、G.PARP 剪切体蛋白表达量;F、H.VDAC1多聚体蛋白表达量
3 讨论
随着活动性结核病发病率的升高、结核病与艾滋病及糖尿病的并发、耐多药结核病的增加、疫苗防范力的不足、筛选和诊断方法的短板以及结核病复杂的致病机理与机体复杂的免疫应答系统,使结核病的预防与治疗面对着十分严峻的挑战,同时也对全球畜牧业和公共卫生事业的健康发展造成了重大威胁[1]。当MTB进入机体后,虽然会面临宿主细胞多重复杂的防御,但是MTB仍然可以通过一系列的免疫逃避机制帮助自己在宿主细胞中增殖扩散[15]。随着人们对MTB的研究,发现调控细胞凋亡不仅可以保护机体免受炎性损伤,而且可以更好地激活先天性和适应性免疫反应进行防御和清除MTB[16]。VDAC作为线粒体外膜上含量最丰富的通道蛋白,不仅参与调节线粒体能量代谢、负责离子和代谢物转运、控制细胞运动、影响信号转导、组织发育、而且能够调控细胞凋亡,在维持线粒体和细胞的生理功能方面发挥着重要作用。研究表明,当细胞受到凋亡刺激后,VDAC1会受到一系列的调节作用导致线粒体外膜的通透性改变,进而使其通透化并导致位于膜间隙(IMS)中的一系列凋亡因子,例如 Cyt C、AIF(凋亡诱导因子)、Smac/DIABLO 和核酸内切酶G的释放。然后通过启动一系列级联反应,使蛋白质和DNA的降解,最终导致细胞凋亡[14]。事实上,线粒体功能障碍与多种疾病有关,包括癌症、阿尔茨海默病(AD)、帕金森病(PD)、肌萎缩侧索硬化症(ALS)、2型糖尿病(T2D)和心血管疾病(CVDS)。因此,各种疾病的发生发展均与VDAC1调控有关[17-20]。而在BCG感染过程中,VDAC的作用尚不完全清楚。
本研究发现,在BCG感染巨噬细胞RAW264.7过程中,会导致VDAC1的表达上调。因此推测BCG感染RAW264.7巨噬细胞诱导的细胞凋亡可能与VDAC1的调控有关。随后设计合成了针对VDAC1序列的干扰小RNA(si-VDAC)且进行了验证,对其是否参与了BCG感染的RAW264.7细胞凋亡进行研究。通过采用MTT法检测RAW264.7细胞存活率发现,当BGG刺激后细胞存活率下调,而si-VDAC1与BCG共同处理后细胞存活率得到了缓解。为进一步验证VDAC1是通过何种方式影响细胞存活率的,本试验通过流式细胞仪对细胞凋亡率进行测定,结果发现,BCG感染RAW264.7巨噬细胞后,细胞凋亡率发生上调,但si-VDAC1与BCG共同处理组作用RAW264.7细胞后,细胞凋亡率显著低于BCG单独处理组。结果表明VDAC1的敲减是通过降低BCG感染的巨噬细胞凋亡率而提高细胞存活率的。为确实这一结论,本试验通过流式细胞仪检测了各处理组中线粒体膜电位的变化和ROS积累情况,其结果表明BGG单独处理组会引起线粒体膜电位的逆转以及ROS积累,而si-VDAC1组会明显改善这种情况。以上结果说明了敲减VDAC1会影响细胞凋亡的发生。目前研究认为细胞凋亡有3种途径,根据凋亡刺激和引发途径的不同可分为:线粒体依赖的内源性途径、死亡受体介导的外源性途径以及内质网通路。由于VDAC1参与介导内源性凋亡,为进一步验证VDAC1参与BCG感染的RAW264.7细胞中内源性凋亡的发生,本研究通过Western blot与qPCR从分子水平检测凋亡内源性凋亡相关因子Caspase-3、Caspase-9以及参与DNA修复的PARP的表达。结果显示BCG感染可引起凋亡相关蛋白Caspase-3、Caspase-9、PARP的表达增加,而si-VDAC1与BCG共同处理组会显著抑制这一情况,这一发现与上述结果相符。综上,VDAC1的敲减会抑制BCG诱导的巨噬细胞RAW264.7的凋亡,表明VDAC1参与了BCG诱导巨噬细胞凋亡的调控作用。同时结合本试验通过测定胞质内Cyt C的释放情况,发现si-VDAC1和BCG共同处理组与BCG单独感染组相比,胞质内Cyt C的释放显著被抑制,进一步证明,VDAC1参与了BCG诱导巨噬细胞内源性凋亡的调控。这些发现为后续试验奠定了基础。
目前研究认为,导致MPOP发生的方式主要由Bcl-2蛋白家族中的促凋亡蛋白Bax/Bak寡聚、Bax/VDAC1异源寡聚以及VDAC1/VDAC1同源寡聚形成的大离子通道3种[13-14]。许多与VDAC1相互作用的物质可以通过抑制其寡聚进而调控细胞凋亡。其中VBIT-4通过与VDAC1相互作用,特异性地抑制VDAC1的寡聚化和随后在各种刺激诱导的各细胞系中的凋亡[21]。重要的是,VBIT-4能够保护线粒体免受功能障碍,特别是恢复线粒体膜电位,而线粒体膜电位被凋亡刺激所改变,会影响能量和代谢变化、ROS的产生、打破细胞内Ca2+的生理平衡[22-23]。因此能够有效避免以上因素诱导的细胞凋亡对试验产生干扰。最后,本研究通过使用VBIT-4抑制VDAC1的寡聚作用,深入探讨了VDAC1在BCG诱导细胞线粒体凋亡中的调控作用机制,检测了VBIT-4抑制VDAC1寡聚体形成后对BCG感染RAW264.7诱导细胞凋亡相关因子表达。结果表明,使用VDAC1寡聚抑制剂VBIT-4处理后同BCG处理组相比,VBIT-4显著抑制了VDAC1寡聚体的形成和凋亡相关因子Cleaved-Caspase 3、Cleaved-PARP1、Cleaved-Caspase 9的含量(P<0.001)。同时本研究结合免疫荧光检测了Caspase-3的表达,结果表明,BCG感染后,细胞内绿色荧光斑点显著增加,当使用VBIT-4和BCG共同处理时,显著减少了细胞内的绿色荧光斑点数量。说明BCG感染增加了细胞内Caspase-3剪切体的含量,而使用VDAC1寡聚抑制剂VBIT-4之后抑制了BCG感染后细胞内Caspase-3的活化。BCG感染后,细胞内绿色荧光斑点显著增加,当使用VBIT-4和BCG共同处理时,显著减少了细胞内的绿色荧光斑点数量,说明BCG感染增加了细胞内Caspase-3剪切体的含量,而使用VDAC1寡聚抑制剂VBIT-4之后抑制了BCG感染后细胞内Caspase-3的活化。这一发现与上述结果相符。综上,本研究推测VDAC1通过寡聚形成大的离子通道参与了BCG诱导巨噬细胞内源性凋亡的调控。
