磁敏感加权成像相位图病灶信号强度鉴别单纯出血或钙化失败的影响因素研究
2022-11-10苏录高培毅
苏录,高培毅,2
目的 旨在统计SWI相位图病灶本身信号强度(直接征象)鉴别单纯出血或钙化发生错判的概率,并通过logistic回归分析确定错判的独立影像学危险因素,为影像及临床医师鉴别诊断提供依据。
方法 回顾性分析2016-2019年首都医科大学附属北京天坛医院单纯出血或钙化病例,连续性入组。将SWI图像进行标准化,即将左手图变成右手图。含有多个病灶者,所有病变逐个评估。两名观察者直观定性评估SWI相位图数据:低、高信号或无法判断(混杂或等信号),预测病变为出血或钙化。与CT诊断“金标准”进行对比,预判结果与CT结果不一致者认定为失败组,一致者为成功组。评估的临床及影像学影响因素包括年龄、性别、病灶直径、平均CT值、T1WI和T2WI信号、SWI相位图病灶本身信号强度(直接征象)、左右手图、病灶位置、侧别、单多发及病灶性质。采用logistic回归分析SWI相位图病灶本身信号强度法鉴别失败的影响因素。
结果 共纳入受试者41例,病灶339个,钙化及出血病灶分别为157个及182个。失败组105个病灶,成功组234个病灶。通过SWI相位图病灶本身信号强度(直接征象)错判率为30.97%。多因素logistic回归分析显示,SWI相位图等或混杂信号(OR 97.263,95%CI 28.746~329.096,P<0.001)、SWI相位图高信号(OR 5.684,95%CI 2.042~15.819,P=0.001)、T2WI低或混杂信号(OR 5.024,95%CI 2.391~10.558,P<0.001)、CT值91~300 Hu(OR 2.710,95%CI 1.023~7.180,P=0.045)及病灶直径>4 mm(OR 2.437,95%CI 1.168~5.084,P=0.018)是导致SWI相位图病灶本身信号强度(直接征象)错判的独立危险因素。
结论 SWI相位图病灶高或混杂信号者、T2WI低或混杂信号者、CT值91~300 Hu者及病灶直径>4 mm者采用SWI相位图病灶本身信号强度(直接征象)方法鉴别单纯出血及钙化错误风险高,对临床及影像学诊断有一定指导作用。
国内外研究表明,SWI相位图(右手图)X-Y轴平面病灶中心层面上病灶本身(本质上为病变直接征象)呈高信号,提示存在反磁性物质,最常见的是钙化,呈低信号提示存在顺磁性物质,最常见的是出血[1-2]。X-Y轴平面病灶中心层面上病灶周围(间接征象)呈低信号以及Z轴两极(间接征象)呈高信号,提示病灶为反磁性物质,最常见为钙化;X-Y轴平面病灶中心层面上病灶周围(间接征象)呈高信号以及Z轴两极(间接征象)呈低信号,提示病灶为顺磁性物质,最常见为出血。左手图反之。后者利用病灶对周围磁场的扰动进行鉴别诊断,本研究不涉及此方法,其与直接征象方法的准确率、稳定性差异较大,但为了与直接征象方法区别,本研究称之为间接征象方法[3]。
直接征象法较为简便,在临床上的应用及认知较广泛,但常常出现SWI相位图病灶内信号高低混杂的情况,致使鉴别诊断价值大幅度下降,缺乏相关研究对此方法的准确率进行统计以及相关因素的深入分析研究。本研究将统计SWI相位图病灶本身信号强度(直接征象)鉴别单纯出血与钙化的错判发生率,并将可能的临床及影像学影响因素进行多因素logistic回归分析,确定独立危险因子,为临床及影像学医师提供线索。具有独立危险因子的病变,直接及间接征象法相结合更有利于临床对出血及钙化的鉴别诊断。
1 对象与方法
1.1 研究对象 回顾性分析2016-2019年首都医科大学附属北京天坛医院进行头颅MRI及CT检查的单纯出血或单纯钙化病例,连续性入组。
纳入标准:①单纯出血或者单纯钙化病例;②根据CT检查确定病变性质,单次不能确诊者两次CT检查密度不变者为单纯钙化,密度改变者为单纯出血;③除SWI、定量磁化率成像(quantitative susceptibility mapping,QSM)序列的常规平扫MRI不能发现病灶或不能鉴别出血、钙化者;④具有SWI数据。
排除标准:①对称性钙化病灶;②运动伪迹严重、无法评估者;③单次CT扫描不能确定性质,且无随访检查;④随访检查时间间隔太短,变化不显著无法确定是出血还是钙化;⑤病变内同时存在钙化及出血。
1.2 CT及MRI数据参数 层厚5.5~6.5 mm,层间隔1.0~1.5 mm,视野(field of view,FOV)240 mm×240 mm,矩阵512×512。磁共振仪型号:GE SIGNA Explorer,GE Discovery,Siemens Verio,Philips Ingenia CX。SWI:重复时间(repetition time,TR)27~78.6 ms,回波时间(echo time,TE)5.6~48.89 ms,层厚3~6 mm,层间隔2.4~3 mm,翻转角15°~30°。T1WI:TR 6.43 ms,TE 2.97 ms。T1FLAIR:TR 1900~2275.2 ms,TE 8.6~29.06 ms。T2WI:TR 4500~4744 ms,TE 85.82~110.22 ms。T2PROPELLOR:TR 7385.03 ms,TE 105.49 ms。CT型号:GE Revolution,GE Discovery CT750 HD,GE LightSpeed VCT,Philips iCT,SINOVISION Insitum 64S,Philips IQon-Spectral CT。毫安秒320~360 mAs,管电压120 KVp。
1.3 分组及数据评估 两名神经放射诊断医师运用直接征象法独立评估SWI相位图数据。①SWI相位图预测:通过SWI相位图病灶信号强度,预测病变为出血(低信号)或者钙化(高信号)。两名医师意见不同时,请上级医师会诊定夺。②分组:将SWI相位图评估结果与CT诊断“金标准”进行对比,预判结果与CT随访结果不一致者认定为失败组,一致者为成功组。有一名评估医师认为SWI相位图为混杂信号或等信号时,认定SWI预测错误,归入失败组。
将SWI图像进行标准化,即将左手图相位图进行黑白颠倒,使之变成右手图后再进行评估。对多个病灶者的所有病灶逐一进行评估。
MRI数据评估:①每个病灶SWI为右手图还是左手图;②直观判断每个病灶SWI相位图病灶信号强度(低信号、高信号、等信号或混杂信号);③每个病灶T1WI及T2WI序列信号强度(高信号、等信号、低信号或混杂信号)。
CT数据评估:①同一患者病灶为单发或多发;②每个病灶侧别(左侧或右侧);③每个病灶位置(额、顶、颞、枕叶、基底节、脑岛、小脑、脑干及丘脑);④测量每个病灶的病灶直径及CT平均值,精确到个位、不保留小数点。
1.4 统计分析 采用SPSS 26.0数据统计软件进行统计分析。计数资料以百分率(%)表示,计量资料符合正态分布者以表示,不符合正态分布者以M(P25~P75)表示。采用χ2检验比较出血及钙化组间SWI相位图病变信号强度差异。采用χ2检验、t检验及秩和检验比较SWI相位图鉴别成功及失败组间各参数的统计差异,即单因素分析,检验水准P≤0.05。对所有变量进行多重共线性诊断,容忍度≥0.1则可进行多因素分析。将单因素分析具有统计学意义的变量代入多因素logistic回归模型构建回归方程,采用向前步进法,显著性检验P≤0.05进入方程,显著性检验P≥0.1移出模型。确定SWI病灶本身信号强度(直接征象)法鉴别单纯出血或钙化失败的各相关因素的风险比,以OR和95%CI表示。
2 结果
2.1 基本信息 受试者共41例,病灶共339个。27例患者的157个钙化病灶,14例患者的182个出血病灶。鉴别成功组共234个病灶,失败组共105个病灶。
2.2 SWI相位图病灶本身信号强度(直接征象)鉴别钙化的诊断效度 钙化组157个病灶中,53个(33.8%)SWI相位图病灶本身信号为低信号(诊断错误),104个(66.2%)为高信号(鉴别成功)。出血组182个病灶中,52个(28.6%)SWI相位图病灶本身信号为高信号(诊断错误),130个(71.4%)为低信号(鉴别成功)。钙化与出血组间SWI相位图病灶本身信号强度(直接征象)失败率比较差异具有统计学意义(χ2=48.150,P<0.001)。
2.3 SWI相位图病灶本身信号强度(直接征象)鉴别出血与钙化失败与成功组的单因素分析受试者基本信息见表1。SWI相位图病灶本身信号强度(直接征象)鉴别失败组共105个病灶,成功组234个病灶,鉴别失败率为30.97%(105/339)。

表1 SWI相位图病灶本身信号强度(直接征象)鉴别单纯出血或钙化失败组与成功组各参数比较
成功组平均年龄(t=2.695,P=0.007)及男性患者比例(χ2=12.008,P=0.001)高于失败组,病灶直径(t=-6.499,P<0.001)及中位CT值(U=10 060.500,P=0.008)低于失败组,差异具有统计学意义。成功组SWI图像右手图比例(χ2=4.386,P=0.036)、相位图病灶本身高或低信号比例(χ2=139.859,P<0.001)、T1WI等信号比例(χ2=53.133,P<0.001)、T2WI等或高信号比例(χ2=87.516,P<0.001)高于失败组,差异具有统计学意义。两组病灶位置、侧别、单多发及钙化出血比例差异无统计学意义(表1)。
2.4 SWI相位图病灶本身信号强度(直接征象)鉴别单纯出血或钙化失败的影响因素 对各自变量进行多重共线性诊断,结果自变量的容忍度在0.160~0.983,表明自变量间多重共线性不严重。将单因素分析具有统计学意义的8个变量(年龄、性别、SWI图、SWI相位图信号、T1WI信号、T2WI信号、病灶直径、CT值)纳入多因素logistic回归分析,结果显示:SWI相位图病灶高信号及等或混杂信号、T2WI低或混杂信号、病灶直径>4 mm以及CT值高(91~300 Hu)是SWI相位图病灶本身信号强度(直接征象)鉴别单纯出血或钙化失败的4个独立危险因子(表2)。
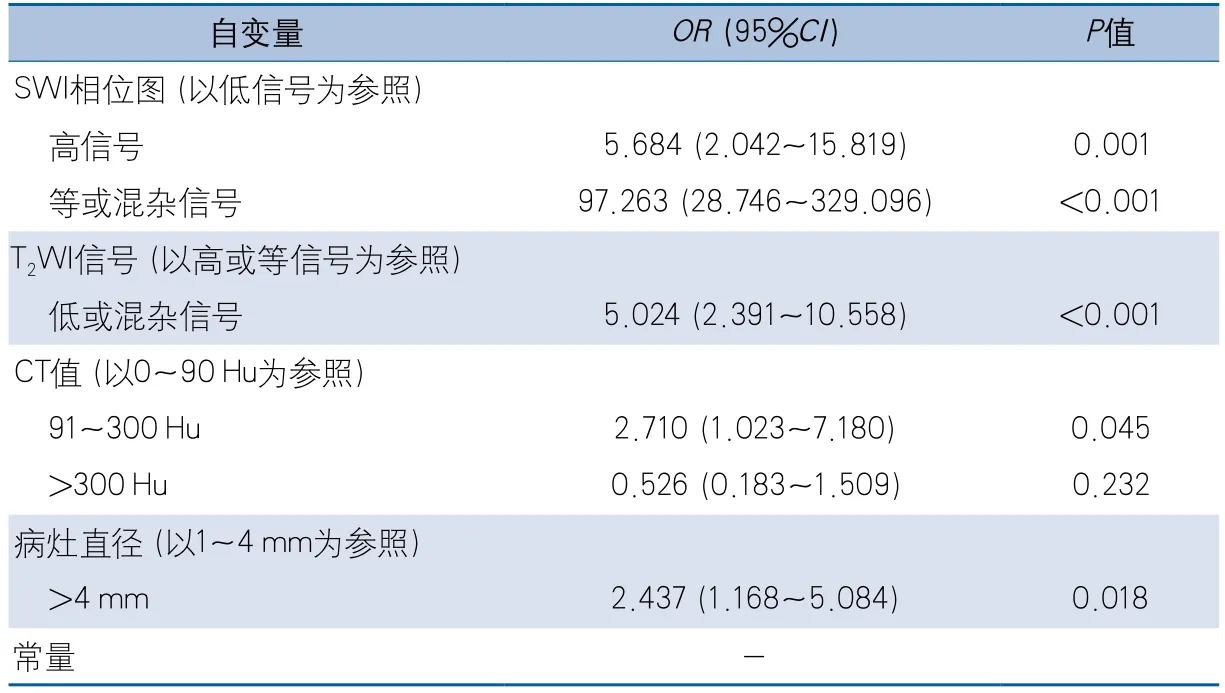
表2 SWI相位图病灶本身信号强度(直接征象)鉴别出血或钙化失败的影响因素logistic回归分析
SWI相位图病灶本身高信号、等或混杂信号病变错判风险分别是低信号病变的5.684倍(95%CI2.042~15.819)及97.263倍(95%CI28.746~329.096)。T2WI低或混杂信号病变是等或高信号病变错判风险的5.024倍(95%CI2.391~10.558)。大病变(病灶直径>4 mm)是小病变(病灶直径1~4 mm)错判风险的2.437倍(95%CI1.168~5.084),CT值91~300 Hu病变是0~90 Hu病变错判风险的2.710倍(95%CI1.023~7.180)。应用示例见图1~图4。
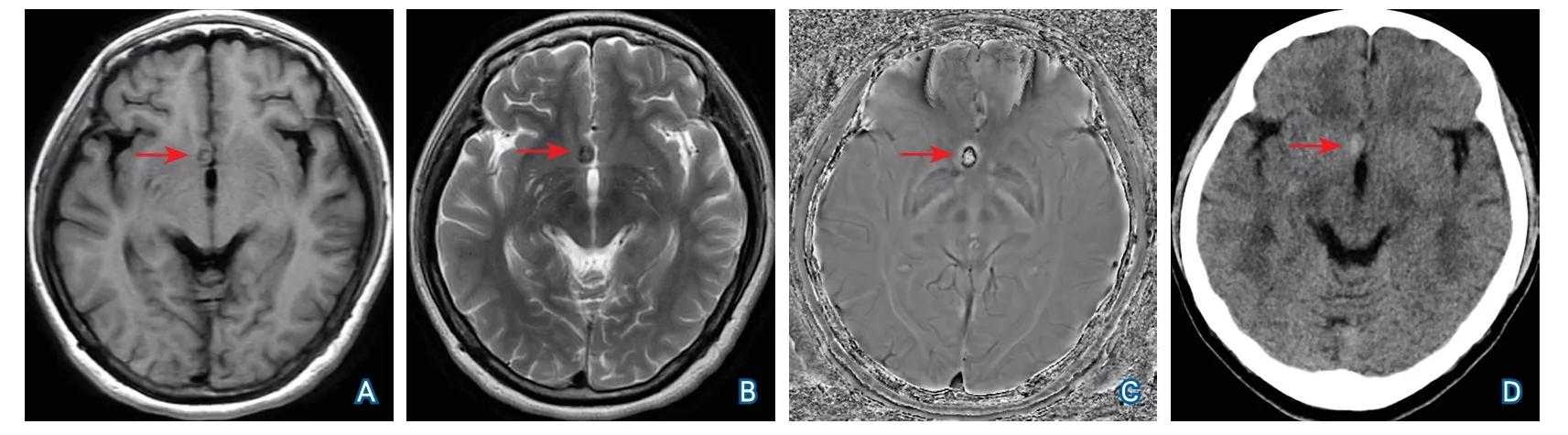
图1 病灶直径大SWI相位图错判单纯出血为钙化者

图2 病灶直径大、CT值高、T2WI信号低SWI相位图错判单纯钙化为出血者(43岁女性)

图3 病灶直径大、CT值高、T2WI信号低、SWI相位图信号混杂错判钙化为出血者(37岁女性)

图4 病灶直径小SWI相位图诊断正确者(40岁女性)
3 讨论
SWI原始相位图信号解读的难点是混淆伪迹,又被称为卷褶伪影、假频伪影,也是临床应用前期一直存在的问题。相位图为-π到+π的矩阵,但当相位超过π时,会被卷褶到对侧,混淆为-2π[4],与FOV过小造成的卷褶伪影原理相似。原始相位图须先进行相位解缠才能进行其他后处理。随着相位解缠算法的进步,相位图才得以应用。但各种方法均无法彻底消除混淆,相位变化剧烈的部位更容易解缠不完全而产生伪迹[5]。长TE和高通滤波也会使伪迹加剧[5]。另外相位图病灶的混杂可能与偶极场有关[6-7]。混淆伪迹最终影响诊断,顺磁性物质会被混淆为反磁性物质(图1);同样钙化病变内磁化率过大(病灶中心钙盐沉积最浓的部位),会被错判为出血(图2),或因多个像素信号反转造成信号混杂、失去诊断价值(图3)。本研究结果显示,SWI相位图病灶本身为混杂信号者错判风险最高,也就是出现混淆伪迹者,是低信号者错判风险的97.263倍。
理论上,SWI相位图病灶周围极晕信号强度(间接征象)通常比病灶本身信号强度(直接征象)小约一半或小一个数量级(主要受系数影响)[2,5,8],混淆伪迹的本质是局部结构的磁场或相位变化剧烈、超出阈值,而极晕理论数值小,本研究中统计数据未体现,但本研究中各病灶周围极晕均无混淆伪迹(图1~图3)。在此需强调的一点是,该晕与GRE T2*WI产生的晕不同,不是部分容积效应(部分学者认为SWI存在晕[9],部分学者认为SWI分辨率高不存在晕[10]),极晕是同时呈现高及低两种截然相反的信号强度[3]。
SWI是以T2*WI为基础的采用三维流动补偿的梯度回波序列,TR短,TE长。短TR决定了其有T1权重,另外受压水、自旋质子密度及磁化率影响[11]。通常亚急性早期血肿(T1WI为高信号、T2WI为低信号)在SWI上为低信号,而亚急性期晚期血肿(T1WI及T2WI均为高信号)呈现SWI高信号,因此SWI序列T2*较T1权重大。SWI相位图主要受磁化率影响,不受T1加权的影响[5]。本研究虽未进行SWI以外其他T2*加权序列数据的分析,但临床上无论是钙化还是出血在其上均为低信号,而SWI相位图出血和钙化病变具有肉眼可辨的差别。也就是说,从定性角度来说,T*2加权低信号对解释相位图信号无价值,与相位图信号混杂与否并无明显关联。因为幅值图主要受T2*及T1加权共同影响[5],而相位图不受T1加权影响,本研究中T1加权多因素分析结果显示其并非独立危险因素,与技术理论相一致。
本研究结果提示,T2WI低信号病变于相位图上大概率具有较大正或较小负磁化率(无相位改变的情况存在,但发生概率极小),更容易产生相位混淆、错判风险更高。笔者分析,由于T2WI相比T2*WI具有相位重聚效果,当重聚都无法挽回失相位、信号丢失时,间接说明具有T2*加权的幅值图上信号丢失更严重、信号更低。有研究提示,强磁敏感源造成MRI信号难以产生时,磁敏感图像更容易不均质[12]。因此,T2加权较T*2加权低信号更能解释SWI相位图混杂的原因。
CT值高者及钙化SWI相位图更容易混杂、造成错判。虽然本研究的单因素分析显示,钙化及出血灶错判风险无差异,但半定量指标CT值为91~300 Hu者错判风险是CT值≤90 Hu者的2.7倍,也就是说大部分钙化错判风险高于出血灶。而>300 Hu者多因素分析结果显示其与低CT值风险相当,结合数据中>300 Hu者大多数为错判且该分类样本量少,考虑为混杂因素所致的偏倚,需要严格分层设计的大样本研究进一步探索。既往研究显示CT值与SWI相位图信号相关性较差[12]。本研究分析其原因为钙化及出血的形成过程可能存在本质上的差别。出血的血红蛋白浓度较固定、改变不显著,其顺磁性主要依靠不同顺磁性物质磁化率的高低演变。一般顺磁性或反磁性物质磁化率在10-6~10-5,顺磁性物质中磁化率最高者为含铁血黄素(是一般顺磁性或反磁性物质的100~1000倍)。而钙化灶形成时间长,磁化率主要由反磁性物质种类决定,其聚集程度无明显上限,可能产生更大的磁场扰动。
钙化的成分是复杂的,钙化病灶不完全由结晶钙组成。病理和生理钙化的化学成分为磷酸钙,以及微量的铜(Cu)、锰(Mn)、锌(Zn)、镁(Mg)和铁(Fe)[13],其中含有顺磁性物质,也有国外学者研究显示病理性脑内钙化和脉络丛钙化的形态及成分不同[14]。钙化合物、不同浓度和钙比例的差异可能是SE序列上MRI信号变化的原因[15]。钙化病灶内可能有少量铁。这些因素都可能造成相位图信号混杂,从而更易发生错判[16]。
虽然CT检查是诊断钙化的“金标准”,但有研究显示,MRI SWI对小病变的显示效果优于CT[16]。本研究显示大病变(病灶直径>4 mm)者,错判风险更高,与既往学者的研究结果相符[16]。其可能原因为大病变中心物质浓聚、相位变化剧烈,从而与相位混淆相关。本研究病灶较大者,中心CT值确实较高(图2、图3)。
本研究的局限性:首先是回顾性研究本身的局限性;其次,单因素分析时高CT值(>300 Hu)更易错判,而多因素分析时结果出现反转,可能是受样本量及混杂因素影响,结果存在偏倚,因此需要扩大样本量进一步探究。
综上所述,SWI相位图病灶本身信号强度(直接征象)错判单纯钙化或出血的独立危险因素为病灶直径>4 mm者、T2WI低或混杂信号者、SWI相位图信号混杂者及CT值91~300 Hu者。CT值>300 Hu可能为重要危险因子,需大样本研究进一步证实。以上因素存在时,直接征象法错判率高,应考虑结合间接征象即极晕征法进行鉴别诊断。
