外源Ca2+对盐胁迫下加工番茄幼苗快速叶绿素荧光和820 nm光反射动力学的影响
2022-11-10陈静怡崔辉梅崔金霞
陈静怡,姜 鑫,吴 佩,崔辉梅,崔金霞
(石河子大学农学院园艺系 / 新疆生产建设兵团特色果蔬栽培生理与种质资源利用重点实验室,新疆石河子 832000)
土壤盐渍化是全球粮食安全所面临的一个重要威胁,世界上大约33%灌溉农业用地受盐渍化影响[1],盐可通过风、雨及岩石风化作用沉积在土壤中,加上气候、地貌特征和人为因素决定其在地表的聚集位置,当土壤层累积盐分对作物生产有不利影响时,提高作物耐盐性与控制土壤盐分成为促进农业可持续发展的重要策略[1-2]。盐害作用于植物生长任何阶段,最终降低经济产量[3],对植物造成离子毒害、渗透胁迫、活性氧(ROS)过量产生、光合过程受阻,导致胞内损伤,引起叶绿素降解、膜透性增加、蛋白质变性、核酸断裂甚至细胞死亡等一系列不良后果[4-8]。光合作用对环境胁迫高度敏感,使得光合作用测量成为植物盐胁迫研究的一个重要部分,盐胁迫降低两个光系统(PSI、PSⅡ)光化学效率,减少同化物和能量供应,限制植物生长发育[7-8]。
近20年来,基于“生物膜能量通量理论”的活体快速叶绿素荧光诱导动力学曲线(OJIP曲线)和JIP-测定(JIP-test),由于其无损、精确、快速等特性,已被广泛用作研究植物生理状态的有力工具[9-12]。利用Strasser等[12]建立的快速叶绿素荧光诱导动力学曲线数据分析和处理方法—JIP-test,提供有关PSⅡ反应中心、捕光天线复合体以及PSⅡ供体侧、受体侧结构和功能的详细信息[13]。由于PSⅠ天线色素发出瞬时荧光信号非常弱,而氧化态PSI反应中心(P700+)特异性反射820 nm光[14-15],因此,通过同步测量820 nm光反射信号来检测PSⅠ反应中心(P700)及原初电子供体质蓝素(PC),从而更深入了解植物光合机构对逆境的响应,目前已用于研究温度[16]、光照[17]、干旱[18]、盐碱[19-20]、重金属[21]和除草剂[22]等非生物胁迫下植物的光合性能。
钙(Ca2+)是植物必需营养元素,且作为第二信使对环境信号和内源激素等许多刺激有灵敏的反应,它稳定膜系统结构并控制酶活性[23-25],当正常条件下植物所需的Ca2+量应用于盐胁迫植物时,盐胁迫植物表现出Ca2+缺乏状况[26],添加适量外源Ca2+可以缓解Ca2+缺乏,维持质膜的基本结构和功能,保证盐胁迫下Ca2+信号系统的正常传递[26-29]。Ca2+也是光合释氧的必要因素[25,27],外源Ca2+可以显著提高盐胁迫下部分物种的叶绿素含量和净光合速率[26,28]。外源钙缓解蔬菜作物逆境胁迫的作用机理已有许多报道,然而关于钙离子诱导盐胁迫下光合作用反应和光合机构变化的信息较少。
本研究针对外源钙对盐胁迫下加工番茄幼苗快速叶绿素荧光和820 nm光反射动力学的影响,探讨外源钙缓解蔬菜作物盐害的光合生理机制,并利用主成分分析综合评价不同钙浓度处理的效果,以期为提高盐环境下蔬菜作物产量提供理论依据。
1 材料与方法
1.1 试验设计
试验于2020年4月在石河子大学农学院试验站进行,供试材料为耐盐性强的加工番茄(Lycopersicon esculentumMill.)自交品系‘KT-7’,由石河子大学农学院提供。选取饱满一致加工番茄种子,经消毒、浸种、催芽后,播于草炭∶蛭石=2∶1 (V/V)基质。幼苗长至2叶1心时,挑选长势整齐、形态良好的幼苗进行水培。将幼苗茎底部用海绵条包好,固定在开好5孔的泡沫板上,定植于装有10 L Hoagland完全营养液(pH = 6.2)的12 L水桶中,每桶5株,为防止光照使桶内营养液温度升高和营养液表面生长绿藻,用黑色喷漆将桶身透光处喷满。每3天更换一次营养液,试验期间营养液全天通气。
幼苗培养至4叶1心时分成6组进行处理(表1),盐胁迫环境:100 mmol/L NaCl于处理时直接加入营养液中,在NaCl胁迫下设外源喷施5个CaCl2浓度处理:0 (蒸馏水)、5、10、15、20 mmol/L,分别记为Ca0、Ca5、Ca10、Ca15、Ca20,以未添加NaCl的营养液为对照(CK),每日上午10:00进行1次叶面喷施CaCl2,以均匀附于叶面且不滴落为准。每个处理共15株,随机排列试验,设3次重复,每个重复5株。在处理第3、6、9天后,选择第4片真叶测定快速叶绿素荧光、820 nm光反射,处理9天后将各处理植株收获进行生长指标测定。
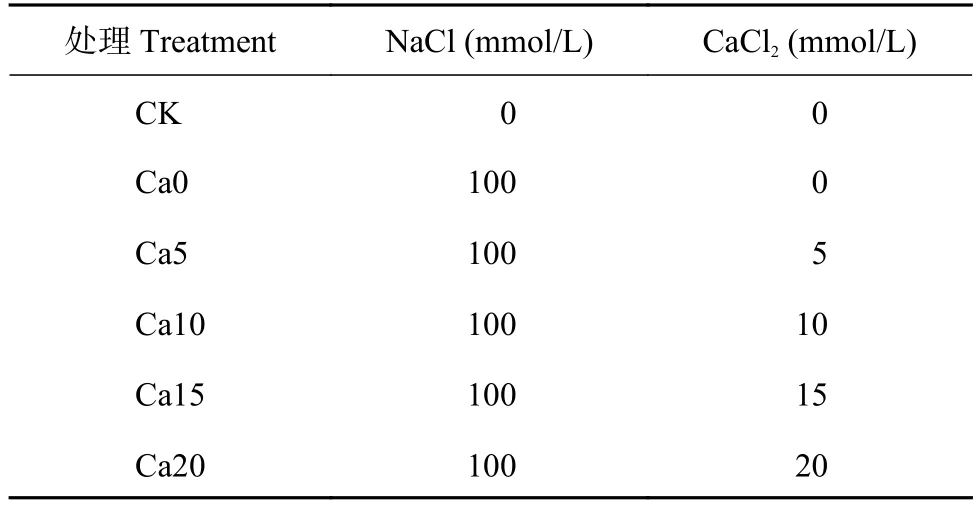
表1 试验处理Table 1 Experimental treatments
1.2 生长指标测定
分别用直尺和游标卡尺测量幼苗株高(子叶节至顶部生长点)、茎粗(子叶节处粗度)。用蒸馏水将根系表面盐分清洗干净,吸水纸吸干根系表面水分后,将地上部和地下部分开测定其鲜重,得到地上部、地下部鲜重,然后将地上部和地下部分别放入信封中进行105℃杀青30 min,80℃烘干到恒重,得到地上部、地下部干重。
1.3 快速叶绿素荧光诱导动力学参数的测定方法
应用连续激发式荧光仪M-PEA (Hansatech,英国),参照Schansker等[14]方法,叶片先暗适应30 min,然后测定叶片OJIP曲线和820 nm光反射曲线。从OJIP曲线直接获得荧光参数:Fo(初始荧光,O相)、FK(0.3 ms时荧光,K相)、FJ(2 ms时荧光,J相)、FI(30 ms时荧光,I相)、Fm(最大荧光,P 相)。根据Strasser等[12]方法对OJIP曲线进行JIP-test分析,得到衍生参数:
1) 按公式Vt= (Ft-Fo)/(Fm-Fo)对OJIP曲线进行标准化得到相对可变荧光Vt曲线,按公式ΔVt=Vt(处理)-Vt(对照)对 Vt曲线中各处理与对照作差后,得到相对可变荧光的差异动力学ΔVt曲线。
2) 性能指数:以吸收光能为基础的PSⅡ性能指数 PIabs= (RC/ABS)[φPo/(1-φPo)][Ψo/(1-Ψo)]。
3) 量子产额或能量分配比率参数:PSⅡ最大光化学效率Fv/Fm= φPo= (Fm-Fo)/Fm;原初光化学反应(电子传递至)效率Fv/Fo= φPo/(1-φPo);捕获的激子将电子传递到电子传递链中超过QA的其它电子受体概率Ψo= ETo/TRo= 1-VJ;用于电子传递的量子产额 φEo= ETo/ABS = φPo×Ψo;用于热耗散的量子比率φDo= 1-φPo= Fo/Fm;用于还原PSⅠ受体侧末端电子受体的量子产额φRo= REo/ABS = TRo/ABS(1-VI)。
4) 达到最大荧光值Fm时,单位叶截面积量子通量:单位叶截面积吸收的光能ABS/CSm≈ Fm;单位叶截面积捕获的光能TRo/CSm= φPo(ABS/CSm);单位叶截面积电子传递的能量ETo/CSm= φEo(ABS/CSm);单位叶截面积的热耗散DIo/CSm= (ABS/CSm)-(TRo/CSm);单位叶截面积反应中心数量RC/CSm=φPo(VJ/Mo)(ABS/CSm)。
5) 能量比通量:单位PSⅡ活性反应中心(PSⅡRCs)吸收的光能ABS/RC = Mo(1/VJ)(1/φPo);单位活性PSⅡ RCs捕获用于还原QA的能量TRo/RC =Mo(1/VJ);单位活性PSⅡ RCs捕获用于电子传递的能量ETo/RC = Mo(1/VJ)Ψo;单位活性PSⅡ RCs热耗散的能量DIo/RC = ABS/RC-TRo/RC。
6) 参照Guo等[22]的方法,排除其他因素对820 nm光反射的干扰,采用MR/MRo表示820 nm光反射动力学曲线,MRo是光化照明开始时(0.7 ms)信号值,定量分析不同处理对820 nm光反射的影响,根据MR/MRo曲线计算以下参数,ΔMRfast/MRo=(MRo-MRmin)/MRo,表示快速下降阶段反映PC和P700的氧化态;ΔMRslow/MRo= (MRmax-MRmin)/MRo,表示缓慢上升阶段反映PC+和P700+的再还原状态;Vox表示PC和P700氧化速率;Vred表示PC+和P700+再还原速率。
1.4 数据分析
文中数据为3次重复的平均值,采用Microsoft Excel 2019进行数据统计与计算,用SPSS 22.0对数据进行单因素方差分析和主成分分析,结合Duncan检验法对显著性差异(P<0.05)进行多重比较,用OriginPro软件进行作图。
2 结果与分析
2.1 外源CaCl2对盐胁迫下加工番茄幼苗生长的影响
表2所示,盐胁迫下加工番茄幼苗生长显著受到抑制,Ca0处理的株高、茎粗、地上部鲜重与干重、地下部鲜重与干重分别比CK显著降低了40.05%、25.94%、63.60%、39.74%、53.83%、47.37%,当Ca2+浓度≤15 mmol/L时,生长指标随Ca2+浓度升高呈增加趋势,Ca15处理对盐胁迫抑制幼苗生长的缓解作用最佳,Ca15处理的株高、茎粗、地上部鲜重、地上部干重、地下部鲜重和地下部干重分别比Ca0处理增加33.19%、21.72%、129.94%、38.13%、149.50%和117.50%。

表2 外源CaCl2对盐胁迫下加工番茄幼苗生长的影响Table 2 Effects of exogenous CaCl2 on the plant growth parameters of processing tomato seedlings under salt stress
2.2 外源CaCl2对盐胁迫下加工番茄幼苗叶片快速叶绿素荧光诱导动力学曲线的影响
图1-a、b、c显示,随盐胁迫时间延长,不同浓度CaCl2处理下叶片OJIP曲线发生不同程度变形,盐胁迫9天时,与CK相比,Ca0处理下OJIP曲线发生变形:K相出现、J相升高、I-P相振幅减小、曲线趋于平缓,与Ca0相比,Ca15处理曲线变形幅度最小。盐胁迫9天,与CK相比,Ca0处理下Vt曲线的 K、J相明显上升 (图1-d、e、f),ΔVt曲线中ΔK>0 (图1-g、h、i),表明PSⅡ供体侧向下游提供电子能力减弱,放氧复合体(OEC)受到伤害,ΔJ>0,说明(初级醌受体QA还原形式)大量积累,PSⅡ受体侧QA至QB电子传递被抑制,综上PSⅡ反应中心供体侧和受体侧均遭到盐胁迫伤害。当CaCl2浓度≤15 mmol/L时,ΔK、ΔJ随Ca2+浓度增加而减小,Ca15处理最小,当Ca2+浓度>15 mmol/L时,Ca20处理的ΔK、ΔJ甚至高于Ca0处理,说明适宜浓度外源Ca2+能减轻盐胁迫对PSⅡ反应中心供体侧和受体侧电子传递的抑制,提高植物耐盐性,其中15 mmol/L Ca2+缓解效果最佳,而20 mmol/L Ca2+则表现出加重盐胁迫伤害。

图1 外源CaCl2对盐胁迫下加工番茄幼苗叶片快速叶绿素荧光诱导OJIP曲线(a、b、c)、相对可变荧光Vt曲线(d、e、f )及相对可变荧光的差异动力学ΔVt曲线(g、h、i)的影响Fig.1 Effects of exogenous CaCl2 on the fast chlorophyll a fluorescence induction curves OJIP (a, b, c), relative variable fluorescence curves Vt (d, e, f ) and differential kinetic curves ΔVt (g, h, i) in leaves of processing tomato seedlings under salt stress
2.3 外源CaCl2对盐胁迫下加工番茄叶片Fv/Fo、VJ的影响
Fv/Fo表示PSⅡ潜在活性,VJ反映2 ms时PSⅡRCs关闭程度[11]。图2显示,随盐胁迫天数增加,Fv/Fo逐渐减小,VJ逐渐增大,即PSⅡ潜在活性与PSⅡ RCs关闭程度呈反比,Fv/Fo随CaCl2浓度增加呈先升高后降低的趋势。盐胁迫3天,Ca0、Ca20处理显著低于其他CaCl2处理;盐胁迫6天,CK处理显著高于Ca0~Ca20处理;盐胁迫9天,Fv/Fo大小表现为:CK>Ca15>Ca10>Ca5>Ca0>Ca20,Ca0处理显著低于CK,Ca15较Ca0处理Fv/Fo显著升高39.67%且与CK无显著差异,Ca20较Ca0处理Fv/Fo显著降低23.92%且为最小值。盐胁迫9天,VJ大小表现为:CK<Ca15<Ca10<Ca0<Ca5<Ca20,Ca0~Ca20处理均显著高于CK,与Ca0处理相比,Ca5、Ca10处理VJ无显著差异,Ca20处理VJ显著升高22.43%,Ca15处理VJ显著降低18.35%。综上,盐胁迫降低PSⅡ活性,抑制QA被还原,Ca15处理能有效缓解上述伤害,但Ca2+浓度过高(如Ca20处理)则加重盐胁迫伤害。
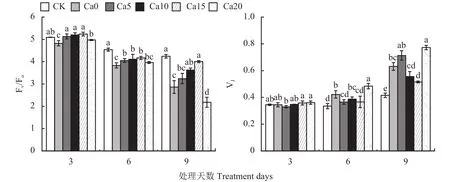
图2 外源CaCl2对盐胁迫下加工番茄幼苗Fv/Fo和VJ的影响Fig.2 Effects of exogenous CaCl2 on the Fv/Fo and VJ in leaves of processing tomato seedlings under salt stress
2.4 外源CaCl2对盐胁迫下加工番茄叶片Fv/Fm、PIabs的影响
Fv/Fm是反映PSⅡ活性中心光能转换效率的重要参数,PIabs是指以吸收光能为基础的性能指数。图3显示,Fv/Fm与PIabs变化趋势相同,随盐胁迫时间增加而逐渐减小,随CaCl2浓度增大呈先升后降,Ca0处理在整个盐胁迫过程中Fv/Fm与PIabs均显著低于CK。盐胁迫3天,Ca5、Ca10、Ca15处理下Fv/Fm以及Ca5处理下PIabs显著高于Ca0处理;盐胁迫6天,Ca5、Ca10、Ca15处理下Fv/Fm与PIabs均显著高于Ca0处理,Ca20处理下Fv/Fm与PIabs与Ca0处理差异不显著;盐胁迫9天,Fv/Fm与PIabs大小依次为:CK>Ca15>Ca10>Ca5>Ca0>Ca20,与Fv/Fm相比盐胁迫对PIabs的影响更明显,反映加工番茄叶片PIabs对盐胁迫的敏感性强于Fv/Fm,Ca0~Ca20处理依次与CK相比PIabs分别降低了77.42%、76.34%、51.04%、29.31%、90.68%,与Ca0处理相比,Ca5、Ca10处理Fv/Fm差异不显著,Ca20处理 Fv/Fm显著降低、PIabs没有显著差异,Ca15与Ca0处理相比Fv/Fm与PIabs均显著升高,说明15 mmol/L CaCl2更好地缓解了盐胁迫诱导的光合性能降低,Ca20处理则未表现出缓解盐胁迫损伤的作用。
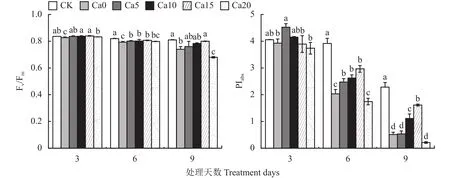
图3 外源CaCl2对盐胁迫下加工番茄幼苗Fv/Fm和PIabs的影响Fig.3 Effects of exogenous CaCl2 on the Fv/Fm and PIabs in leaves of processing tomato seedlings under salt stress
2.5 外源CaCl2对盐胁迫下加工番茄叶片量子产额的影响
Ψo、φEo、φDo用来反映 PSⅡ受体侧变化,φRo是用于还原PSI受体侧末端电子受体的量子产额。图4显示,随盐胁迫天数增加,Ψo、φEo递减,φDo递增。与CK相比,盐胁迫3天Ca0处理Ψo、φEo未观察到明显差异;盐胁迫6天,Ca0处理下Ψo、φEo显著低于CK,与Ca0处理相比,Ca10处理Ψo、φEo无显著差异,Ca5、Ca15处理Ψo、φEo显著增加,Ca20处理Ψo、φEo显著减小;盐胁迫9天,CK处理Ψo、φEo显著高于Ca0~Ca20处理,与Ca0处理相比,Ca5、Ca10处理无显著差异,Ca20处理显著降低,而Ca15处理显著升高。φDo随CaCl2浓度升高呈先降后升的趋势,整个盐胁迫过程Ca0处理下φDo显著高于CK,盐胁迫9天,Ca0~Ca20处理依次较CK上升36.09%、25.48%、13.34%、4.79%、67.92%,与Ca0处理相比,Ca5、Ca10处理φDo无显著差异,Ca20处理φDo显著增大,而Ca15处理φDo显著降低且与CK无显著差异。φRo随处理时间延长变化不大,盐胁迫9天Ca0处理显著低于CK,Ca20与Ca0处理无显著差异,Ca15处理显著高于Ca0处理并与CK差异不显著。综上,说明盐胁迫下施加15 mmol/L CaCl2能够降低热耗散的量子比率,从而提高电子传递的量子产额。
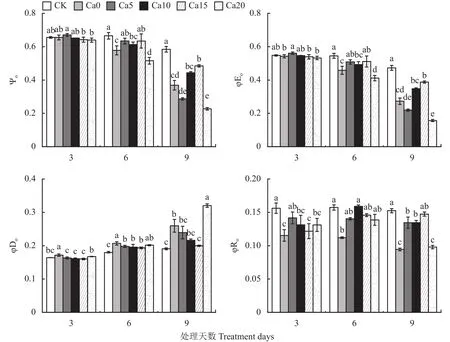
图4 外源CaCl2对盐胁迫下加工番茄幼苗量子产额的影响Fig.4 Effects of exogenous CaCl2 on the yield flux ratios in leaves of processing tomato seedlings under salt stress
2.6 外源CaCl2对盐胁迫下加工番茄叶片能量分配参数的影响
能量分配参数以“雷达图”形式表示(图5),随盐胁迫时间延长,处理间能量分配参数差异逐渐明显。对叶截面积而言,盐胁迫6、9天,与CK相比,Ca0处理下单位叶截面积中活性反应中心数量(RC/CSm)及吸收、捕获和传递的能量(ABS/CSm、TRo/CSm、ETo/CSm)明显降低,而单位叶截面积热耗散(DIo/CSm)大于CK,与Ca0处理相比,Ca15处理下RC/CSm、ABS/CSm、TRo/CSm、ETo/CSm明显增大,DIo/CSm则减小,盐处理下RC/CSm大小依次为:Ca15>Ca10>Ca5>Ca0>Ca20;对反应中心而言,盐胁迫 6、9天,与CK相比,Ca0处理下单位活性反应中心吸收、捕获和热耗散的能量(ABS/RC、TRo/RC、DIo/RC)均高于CK,用于电子传递的能量(ETo/RC)低于CK,与Ca0处理相比,Ca15处理下ABS/RC、TRo/RC、DIo/RC明显降低,而ETo/RC升高,盐处理下 DIo/CSm、DIo/RC 大小均为:Ca20>Ca0>Ca5>Ca10>Ca15,综上Ca15处理逆转了盐胁迫诱导活性反应中心数量减少、热耗能升高,提高了用于电子传递的能量,降低能量的热耗散,优化了反应中心能量分配。
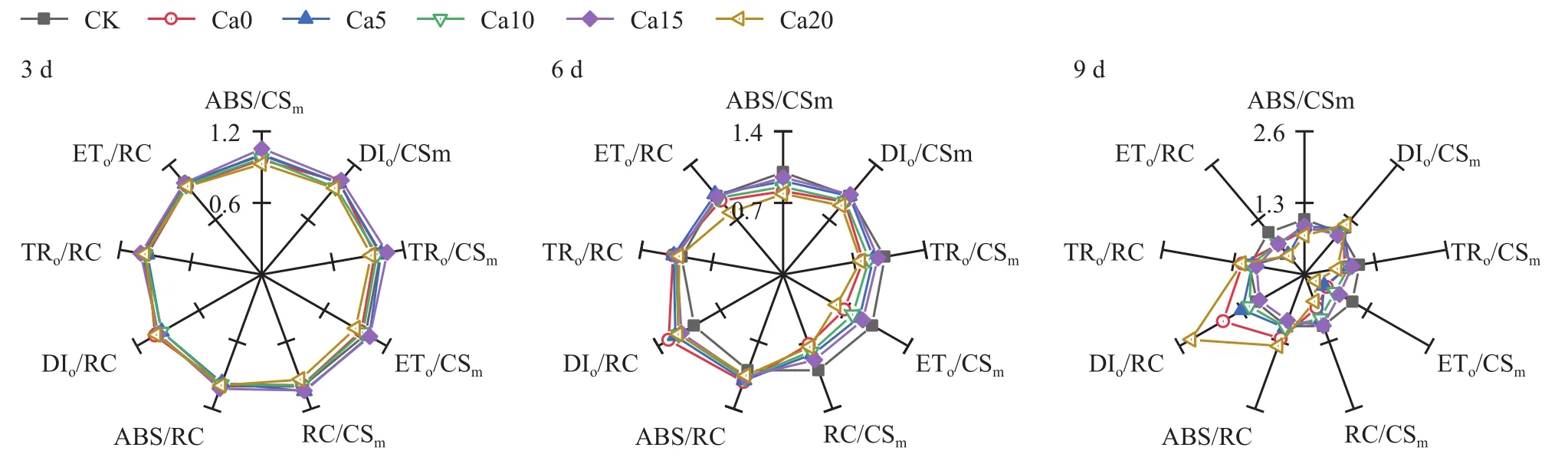
图5 外源CaCl2对盐胁迫下加工番茄幼苗能量分配参数的影响Fig.5 Effects of exogenous CaCl2 on the energy distribution parameters in leaves of processing tomato seedlings under salt stress
2.7 外源CaCl2对盐胁迫下加工番茄叶片调制820 nm反射信号的影响
叶片暗适应后PSⅠ反应中心处于完全还原状态,照光后PSⅠ逐渐氧化,820 nm光反射强度逐渐下降,图6显示,与CK相比,820 nm光反射曲线在盐胁迫下发生变形,表现为下降阶段最低点升高和上升阶段最高点降低,说明PSⅠ氧化还原能力被盐胁迫抑制,盐胁迫3、6天Ca0处理变形幅度最大,盐胁迫9天Ca20处理变形幅度超过Ca0处理,Ca10、Ca15处理变形幅度较小。
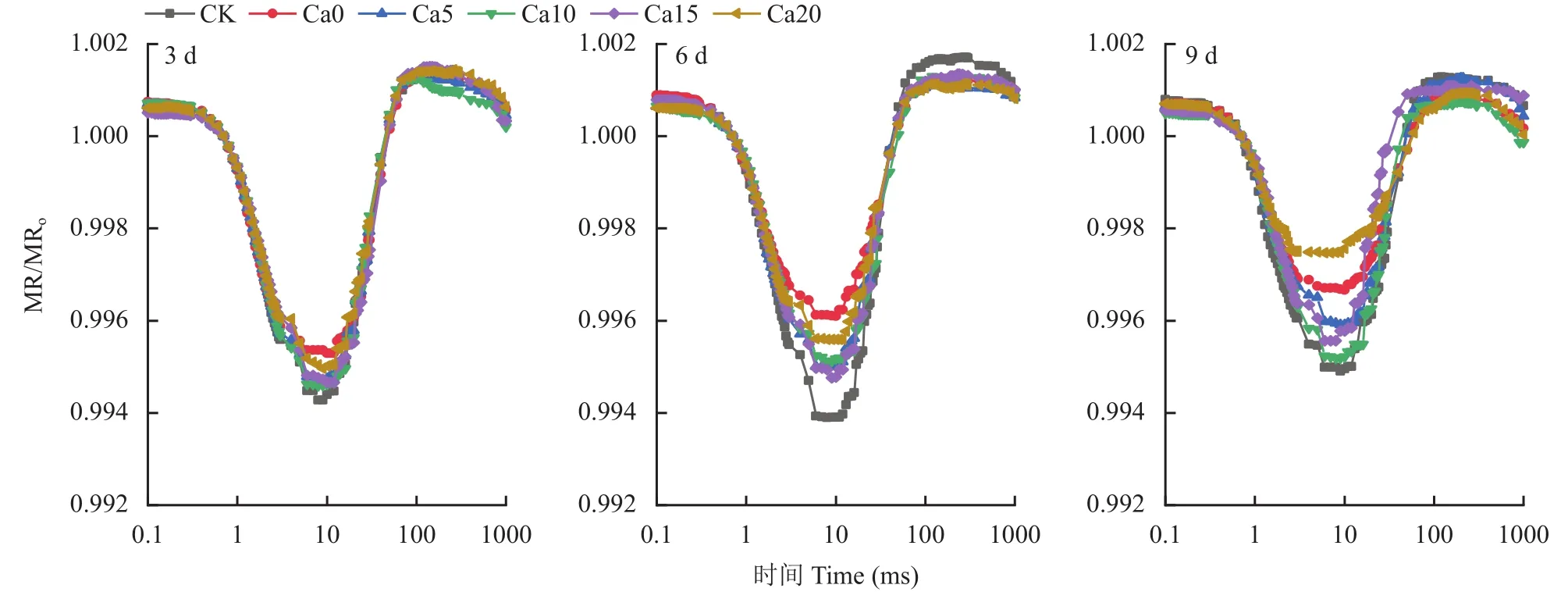
图6 外源CaCl2对盐胁迫下加工番茄幼苗调制820 nm反射动力学曲线的影响Fig.6 Effects of exogenous CaCl2 on the modulated 820 nm reflection kinetics curves in leaves of processing tomato seedlings under salt stress
如图7所示,ΔMRfast/MRo、ΔMRslow/MRo、Vox、Vred随时间持续变化不明显,盐胁迫9天,随Ca2+浓度增加,ΔMRfast/MRo、ΔMRslow/MRo、Vox、Vred呈先增大后减小,在Ca0处理下均显著低于CK,与Ca0处理相比,当Ca2+浓度≤15 mmol/L时显著升高,在Ca20处理显著降低,说明适宜浓度外源Ca2+能有效促进盐胁迫下植物体PSⅠ氧化还原性能,Ca2+浓度过高(Ca20处理)则加重盐胁迫对PSⅠ氧化还原性能的抑制,其中Ca15处理对盐胁迫诱导降低PSⅠ氧化还原性能的缓解作用最佳。
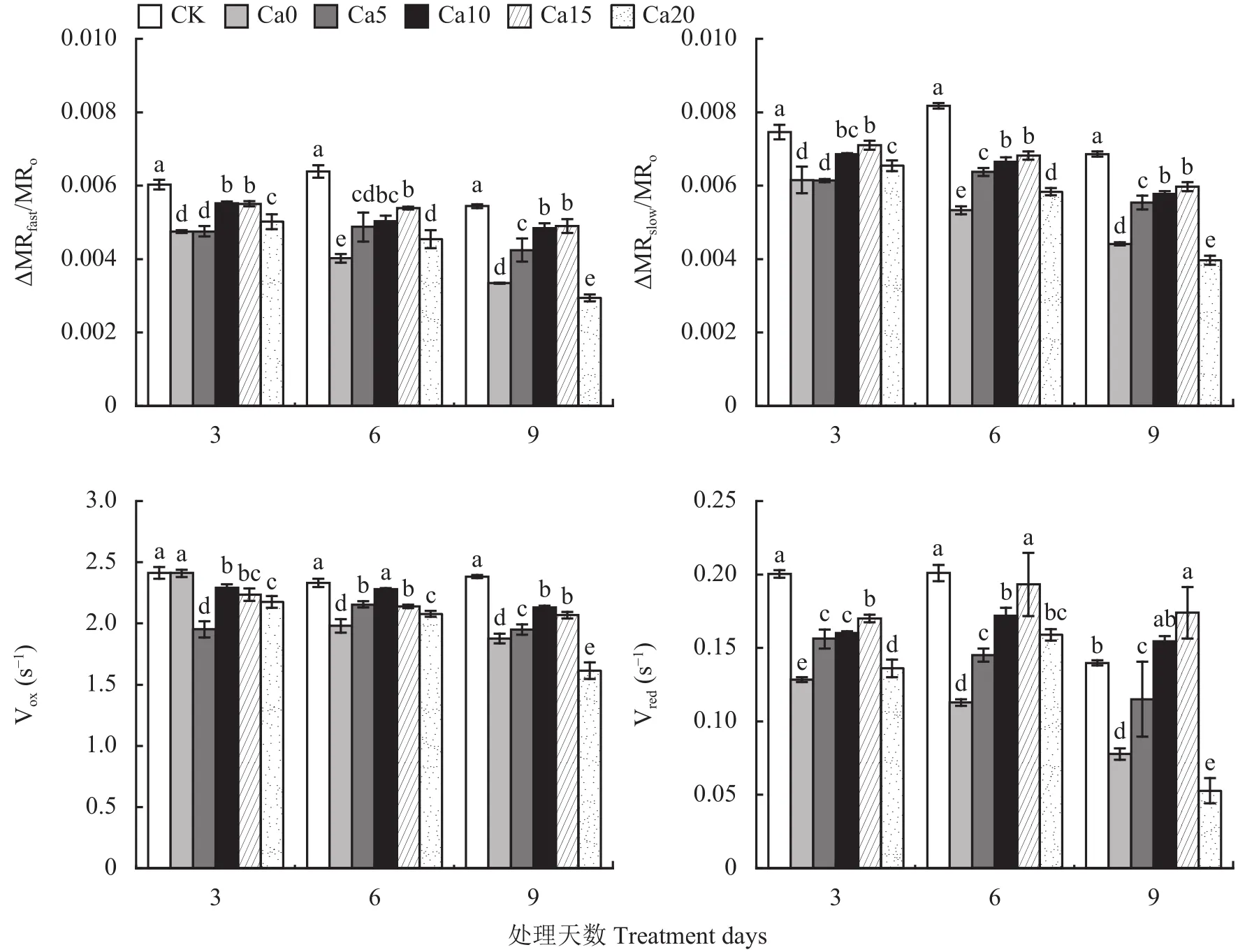
图7 外源CaCl2对盐胁迫下加工番茄幼苗叶片调制 820 nm 动力学参数的影响Fig.7 Effects of exogenous CaCl2 on the parameters of the modulated 820 nm reflection kinetics in leaves of processing tomato seedlings under salt stress
2.8 外源CaCl2对盐胁迫下加工番茄幼苗快速叶绿素荧光和820 nm光反射动力学影响的综合评价
主成分分析(principal components analysis, PCA)也称主分量分析,旨在利用“降维”的思想,把多指标转化为少数几个综合指标。快速叶绿素荧光和820 nm光反射动力学参数具有不同的量纲与数量级,为了避免其对结果的影响,主成分分析前对处理9天后的原始数据进行标准化,标准化数据通过PCA,根据特征值大于1的标准提取到两个主成分,其特征值、贡献率、累计贡献率等如表3所示,特征值分别为15.769、1.632,贡献率分别为82.996%、8.591%,累积贡献率达91.587%,表明这两个相互独立的主成分能够反映19个指标91.587%的信息,符合分析要求。
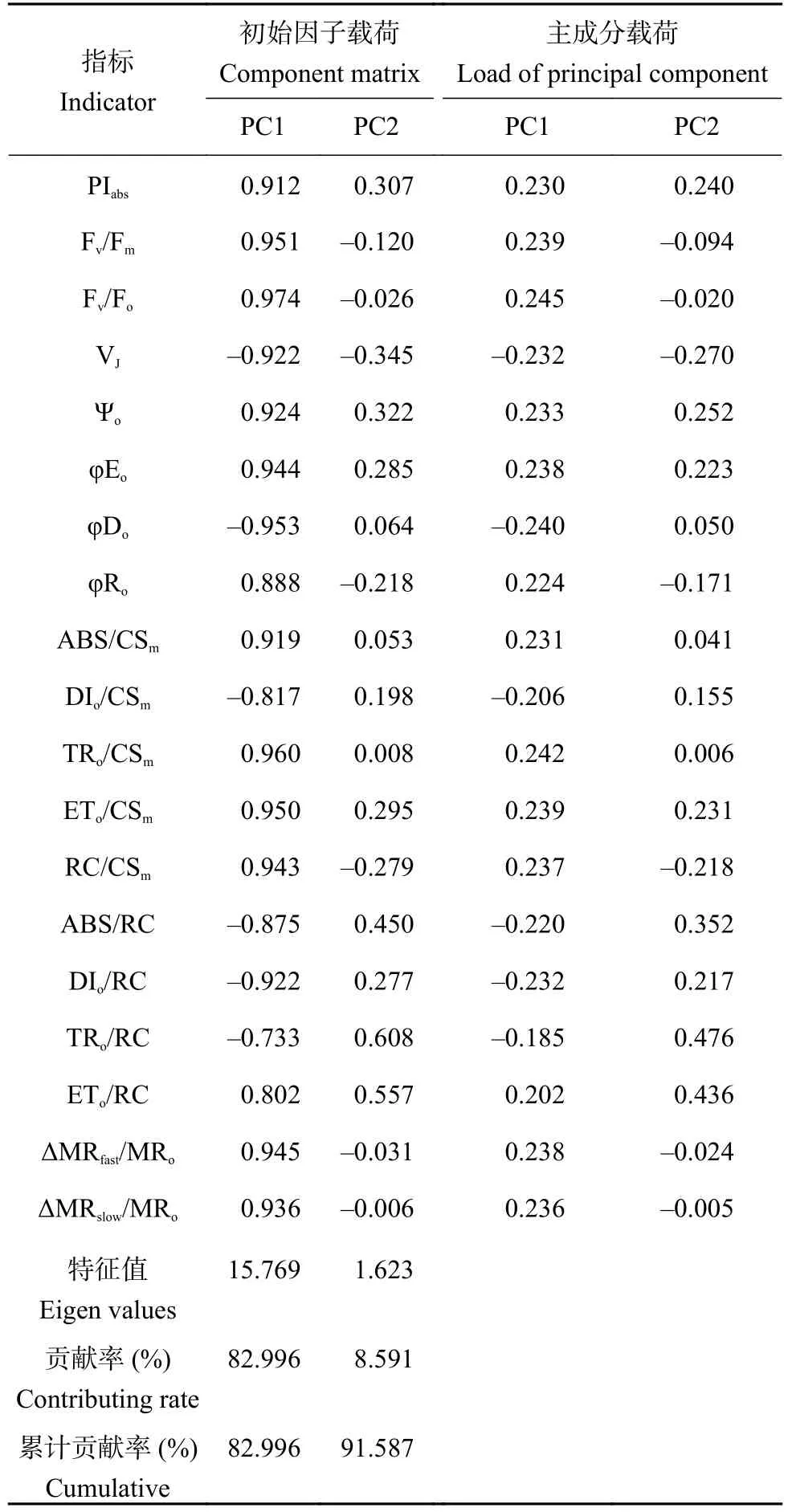
表3 两个主成分的载荷矩阵、特征值及贡献率Table 3 Component matrix, Eigen values, and contributing rate of two principal components
主成分载荷矩阵反映各指标对此主成分负荷相对大小与作用的方向,即该指标对主成分的影响程度。表3中,第一主成分(principal component 1,PC1)绝对值较高的正向特征向量指标有Fv/Fo、Fv/Fm、ETo/CSm、TRo/CSm、ΔMRfast/MRo,PC1 可称为光合反应中心工作效率的量度。第二主成分(principal component 2, PC2)绝对值较高的正向特征向量指标有ETo/RC、TRo/RC,PC2可称为PSⅡ RCs支配光能的量度,由表4可知,不同处理综合排名依次为CK>Ca15>Ca10>Ca5>Ca0>Ca20。
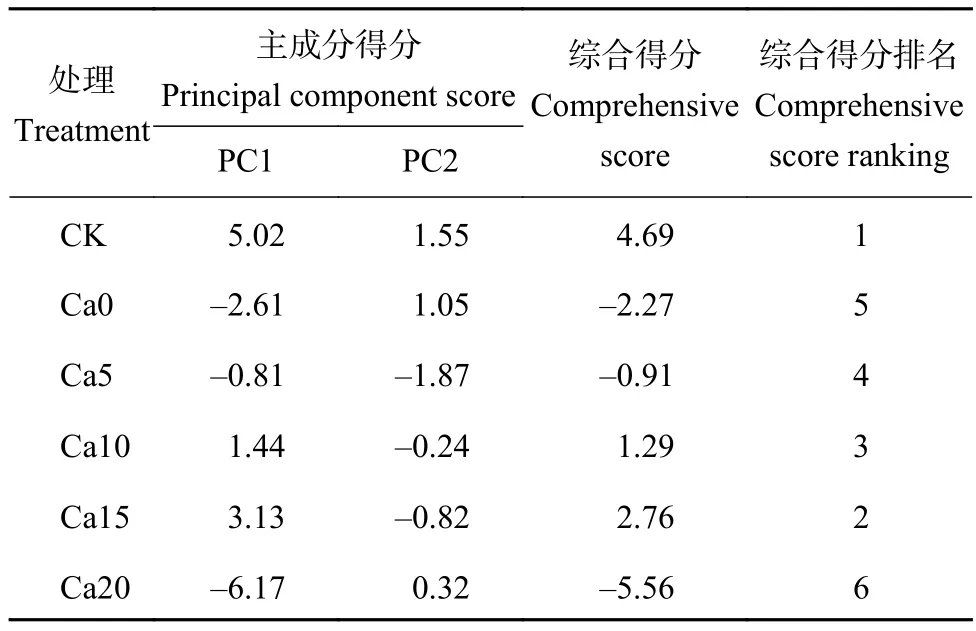
表4 盐胁迫下加工番茄幼苗在不同浓度外源CaCl2处理的综合得分及排名Table 4 The comprehensive score and ranking of processing tomato seedlings treated with different concentrations of exogenous CaCl2 under salt stress
3 讨论
植物响应盐胁迫最直观变化就是植株生长受到明显抑制,土壤盐渍化已成为番茄设施栽培及优质高产的限制因素之一,盐分导致番茄幼苗体内发生离子失衡和质膜过氧化,通过破坏光合作用等一系列生理过程来抑制番茄生长[4,29]。本试验结果表明叶面喷施外源15 mmol/L CaCl2有效缓解盐胁迫对加工番茄幼苗的生长抑制(表2)。
叶绿素荧光在一定程度上反映环境因子对植物的影响,OJIP曲线包含PSⅡ原初光化学反应及光合机构电子传递状态等过程[30],与植物异质性、非生物胁迫程度有关[11,31],光合电子传递链的组成部分位于植物细胞类囊体膜上,盐胁迫损伤植物叶片叶绿体中类囊体结构,降低光合色素含量和光合效率[7,31-33]。OJIP曲线J点、I点、IP相分别与PSⅡ受体侧QA、质体醌(PQ)、PSI受体侧状态有关[9,11,34],如果在极短时间内(即J点之前,0.3 ms处)叶绿素荧光上升出现K点,是因为电子传递中水裂解过程和Pheo (去镁叶绿素)到QA部分被抑制,标志PSⅡ供体侧OEC活性被抑制[19]。本研究发现,随盐胁迫时间延长,加工番茄幼苗叶片OJIP曲线出现K点、J点上升,I点、P点降低、I-P相振幅减小(图1-a、b、c),在Ca0与Ca20处理中更为明显,这与盐胁迫在玉米[31]、葡萄[35]、绿豆[36]中的试验结果相似,I-P阶段降低表明盐胁迫降低PSI氧化还原能力[14],P点下降是由PSI受体侧叶绿素蛋白降解或变性以及闭合PSⅡRCs数量的减少引起[9,34],而15 mmol/L CaCl2处理减轻上述盐胁迫伤害。
Vt曲线 (图1-d、e、f)及 ΔVt曲线 (图1-g、h、i)更直观表现OJIP曲线的不可见特征,明显可见盐胁迫诱导VK增加且ΔK>0反映PSⅡ供体侧OEC受损,而OEC参与光合作用光反应过程中水的光氧化,盐胁迫削弱OEC电子转移能力,因此推测盐胁迫抑制加工番茄叶片中光能氧化水释放电子的过程。同时,VJ增加(图2)是PSⅡ受体侧QA向次级醌受体(QB)电子传递受阻的特异性标志[22],表明盐胁迫限制超出QA的电子运输,即(QA的还原形式)大量积累,浓度增加引发PSⅡ RCs闭合,结合盐胁迫下捕获激子将电子传递到超过QA其它电子受体的概率Ψo和用于电子传递的量子产额φEo显著降低,能量耗散的量子效率φDo升高(图4),表明盐胁迫抑制PSⅡ受体侧QA下游的电子传递,在其他植物研究中也发现了类似的结果[19,31,36],这些结果说明PSⅡ受体侧是盐胁迫的靶点,可能由于盐胁迫导致QB从蛋白复合体脱落,使PSⅡ受体侧PQ结合亲和力降低[11]。据报道盐胁迫对小麦的伤害位点为供体侧[33],而在油菜叶中为受体侧[37],表明盐胁迫对不同物种光合电子传递链的伤害位点不同,本试验则表明加工番茄幼苗叶片PSⅡ供体侧和受体侧均受到盐胁迫伤害,而盐胁迫下施加外源15 mmol/L CaCl2可通过保护OEC结构,使光解水向PSⅡ提供电子,降低能量耗散,维持电子传递链正常运行。
盐胁迫下Fv/Fo、Fv/Fm降低是Fm减小和Fo增大共同作用的结果,说明从PSⅡ反应中心色素分子(P680)向QA电子传递受阻,且PSⅡ天线色素激发态非辐射耗散发生[32],Fv/Fo降低表明盐胁迫损伤类囊体膜结构、有活性的反应中心数量降低[38],Fv/Fm降低表明盐胁迫削弱PSⅡ光化学效率[30],进一步分析发现Ca0处理单位叶截面积中RCs密度(RC/CSm)、吸收的光能(ABS/CSm)减少,表明盐胁迫造成PSⅡRCs失活或天线色素结构改变、降解,使捕获、传递电子的光能(TRo/CSm、ETo/CSm)减少,但热耗散(DIo/CSm)升高,表明加工番茄幼苗叶片受到盐胁迫启动光合机构的保护机制[11],进一步表现为单位反应中心捕获的用于电子传递的能量(ETo/RC)明显降低,而吸收、捕获用于还原QA、热耗散的能量(ABS/RC、TRo/RC、DIo/RC)增加,表明部分PSⅡRCs失活后,单位叶截面积吸收、捕获、传递的光能降低,致使剩余有活性的RCs吸收、转换光能及热耗散的工作效率提高、用于传递电子的能量减少,从而保证在盐胁迫下能量供应。这是在PSⅡ中安全耗散过剩激发能量的机制之一—叶黄素循环,其功能是通过非光化学猝灭的过程,将PSⅡ天线中过剩激发能作为热量耗散,对保护光合电子传递链有积极作用,这个结果与前人[8,31,36,39]得出PSⅡ RCs对逆境响应的结论一致。然而,盐胁迫对加工番茄叶片PSⅡRCs数量与能量支配的负面影响被外源15 mmol/L CaCl2所抵消。
PIabs是以吸收光能为基础、包含多个独立参数(RC/ABS、φPo、Ψo等)的性能指数,许多研究采用最大光化学效率(Fv/Fm)评估植物受胁迫程度,但一些研究认为PIabs比Fv/Fm更敏感,可以准确地反映胁迫对植物光合机构的影响[11-12],在本研究中加工番茄幼苗叶片PIabs对盐胁迫更为敏感(图3),在Fv/Fm尚未发生变化时,PIabs已出现明显变化,Ψo是对PSⅡ反应中心电子传递链性能的综合评价指标之一(图4),PIabs主要反映PSⅡ反应中心效率,试验表明,与Ca0处理相比,Ca15处理使盐胁迫下加工番茄叶片的Ψo和PIabs均显著升高,但PIabs升高程度大于Ψo,由此可见,外源钙对改善PSⅡ反应中心之后的电子传递链性能更为显著,从而提升整体光合性能,这与赵娜等[40]关于钾肥提高抗虫棉叶片PSⅡ性能的研究结果一致。
除植物叶片PSⅡ反应中心容易受到逆境伤害外,PSⅠ反应中心也是逆境胁迫作用位点之一,通常使用820 nm光反射来研究PSⅠ原初光化学反应[10],叶片暗适应后PSⅠ反应中心处于完全还原状态,照光后PSⅠ逐渐氧化,820 nm光反射曲线处于快速下降阶段代表P700和PC的氧化,最低点(MRmin)是PSⅠ氧化还原的转折点,当来自PSⅡ的电子促进PSⅠ还原,820 nm光反射曲线转为慢速上升阶段代表P700和PC再还原,对应OJIP曲线I-P阶段[15,22,30],因此,820 nm光反射曲线同时受PSⅠ和PSⅡ活性的影响,能够反映PSⅠ和PSⅡ协调性,当PSⅠ活性降低会反馈抑制PSⅡ向PSⅠ传递电子,加剧PSⅡ伤害程度[41],PSⅠ稳定性可保证受损PSⅡ快速修复[42]。本试验中随盐胁迫天数增加,MR/MRo曲线(图6)、PSⅠ性能参数(图7)较PSⅡ性能指数PIabs(图3)变化幅度明显减小,这与前人[31,43]研究表明盐胁迫对PSⅡ影响大于PSI的结果一致。本研究结果显示,与CK相比,Ca0处理下MR/MRo曲线MRmin增大,ΔMRfast/MRo、ΔMRslow/MRo以及 Vox、Vred显著降低,表明盐胁迫抑制P700和PC氧化以及再还原过程,与Kan等[31]研究结果不同的是,在玉米对盐胁迫响应中820 nm光反射曲线下降阶段未发现显著变化,但其上升阶段变化与本试验结果一致,此外,结合还原PSⅠ受体侧末端电子受体的量子产额(φRo)减少(图4),可推测PSI活性降低可能是PQ向传递电子的能力或数量下降,PSⅡ与PSI之间连通性变差,PSI受体侧电子传递受阻,这种效应与上文JIP-test分析得出盐胁迫引起PSⅡ反应中心活性降低一致,而15 mmol/L CaCl2处理能够提高盐胁迫下PSⅠ氧化还原能力。
4 结论
施加外源15 mmol/L CaCl2通过耗散PSⅡ天线色素过剩激发能,减轻盐胁迫氧化应激对叶绿体的损伤,稳定光合反应中心结构与功能,提高光化学效率和能量利用率,减轻盐胁迫的光抑制,从而促进加工番茄幼苗生长。
