超声实时引导输尿管软镜钬激光治疗肾盂旁囊肿的疗效观察
2022-11-09李少鹏林智文黄小清许荣耀黄世军陈富源蔡建通
李少鹏,林智文,黄小清,许荣耀,黄世军,陈富源,蔡建通
腹腔镜微创手术是目前治疗肾囊肿的金标准[1],但肾盂旁囊肿紧贴肾集合系统和肾脏血管,腹腔镜治疗存在一定的难点和风险。近年来,包括经皮肾镜及输尿管软镜在内的腔内微创技术被应用于肾盂旁囊肿的治疗中,避免了腹腔镜手术为显露囊肿而操作的分离步骤,降低了肾脏血管及周围脏器损伤的风险[2-4]。输尿管软镜可通过人体尿道进行操作,不仅创伤小,而且可以全面检查上尿路系统,可同期进行肾盂旁囊肿的鉴别诊断和微创治疗[5]。然而,对于部分患者而言,输尿管软镜定位较为困难,以至于治疗失败或者疗效不佳[6]。本研究以福建省石狮市医院泌尿外科2017 年3 月至2020 年8 月行输尿管软镜下钬激光内开窗术治疗肾盂旁囊肿的29 例患者为研究对象,探讨超声引导在输尿管软镜下钬激光内开窗治疗肾盂旁囊肿的价值。现报道如下。
1 资料与方法
1.1 临床资料 收集福建省石狮市医院泌尿外科2017 年3 月至2020 年8 月行输尿管软镜下钬激光内开窗术治疗肾盂旁囊肿的29 例患者的临床资料。21 例通过输尿管软镜探查成功定位囊肿(初始成功组);8 例患者定位失败(初始失败组),对于初始失败病例,通过超声及内镜联合定位后成功寻及囊肿。术前均行CT 尿路成像(CTU)检查明确诊断,CT 检查提示肾门区域边缘清楚,低密度类圆形影,CT 值-10~20 HU;增强扫描未见囊壁强化,未见囊实性改变;排泄期CT 均可见明显的肾盂肾盏受压变形。29 例均为单发肾盂旁囊肿,无发热、尿频、尿痛等症状,无合并高血压、糖尿病,术前血生化检查肌酐、尿素氮均正常。2 组病例性别、年龄、结石大小、囊肿直径等一般情况比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 初始失败组与初始成功组肾盂旁囊肿患者一般情况比较
1.2 方法 29 例病例术前均未预置双J 管。Wolf F8-9.8 输尿管硬镜探查输尿管全程,留置斑马导丝至肾盂内,沿斑马导丝置入F12-14 COOK 输尿管扩张鞘,拔出内芯,直视下置入Wolf 双通道纤维输尿管软镜。输尿管软镜全面检查肾盂及各个肾盏,寻找囊肿,典型病例可以透过黏膜观察到半透明凸起的囊壁,见图1。应用200 μm 钬激光光纤,钬激光能量设置为2.0 J/15 Hz,切开囊壁,使囊腔与集合系统相通。
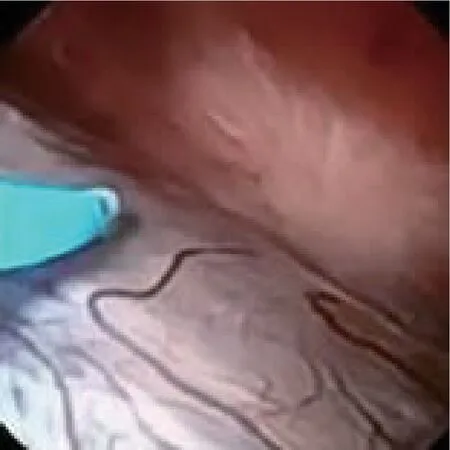
图1 输尿管内镜下肾盂旁囊肿表现为典型半透明球状凸起
对于初始定位失败的病例,联合应用超声及输尿管软镜定位囊肿。在超声引导下,将输尿管软镜头端定位于肾盂旁囊肿最贴近肾集合系统的部位,见图2。最理想的切入点为囊肿与集合系统紧贴面的中央部位,通过超声进一步确认切入点周围无血管后应用钬激光逐层切开组织进入囊肿,见图3~5。囊肿充分切开后,通过超声引导,将双J 管的头端置入囊肿腔内,见图6,以有利于囊肿充分引流。对于囊肿合并肾结石的患者,可以先钬激光碎石并取净,再同期处理肾盂旁囊肿。

图2 超声下观察囊肿的轮廓(黄色箭头标注)及软镜头端(红色箭头标注)
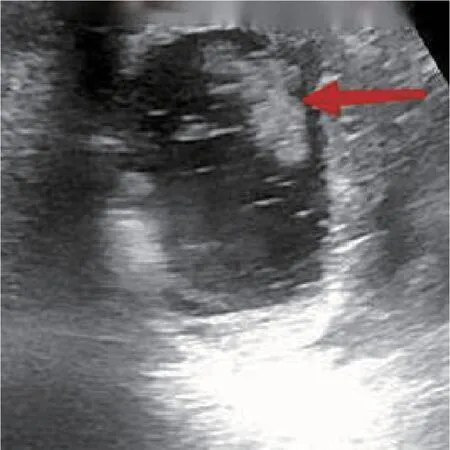
图3 超声下钬激光烧灼囊壁时,可见囊腔内烟雾状表现(红色箭头标注)

图4 内镜下充分开窗
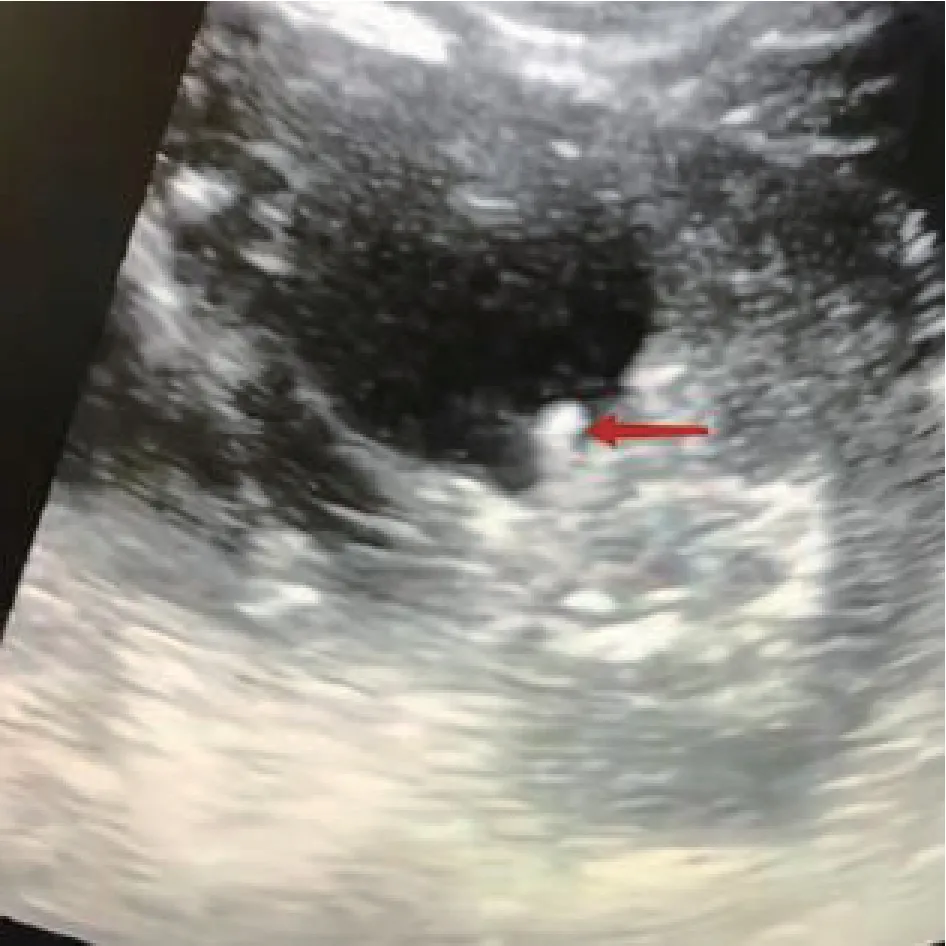
图5 超声下软镜头进入囊肿内观察(红色箭头标注)

图6 超声下双J 管置入囊肿内(黄色箭头标注)
术后2 个月拔除双J 管,术后第6 个月复查腹部CT 平扫,随后每半年定期进行泌尿系统B 超复查。
1.3 观察指标 对比2 组手术相关指标,如手术时间(包括寻找囊壁所需时间及钬激光开窗所需时间)、住院时间、预后情况等。影像学有效定义为:随访半年以上的结果提示肾囊肿的最大直径减少50% 以上[6]。如患者在随访期限中,肾囊肿的最大直径逐渐增大至接近或超过初始状态则定义为囊肿复发[7]。
1.4 统计学处理 数据采用SPSS 20.0 统计软件进行分析。计量资料采用±s表示,组间比较采用t检验;计数资料采用百分比(%)表示,组间比较采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2 组手术所需时间、钬激光开窗时间等指标比较差异无统计学意义(P>0.05)。初始失败组在未应用超声前定位囊壁总耗时为(14.8±2.6)min,但是失败后通过联合超声重新定位时间仅为(3.5 ±1.0)min,明显短于初始成功组的定位时间,差异有统计学意义(P<0.05)。2 组患者均成功完成了囊肿激光内切开手术,术后无严重并发症发生。术后随访期间,初始成功组和初始失败组的影像学有效率为95% 和100%。初始成功组患者有1 例在术后1 年出现囊肿复发,初始失败组无复发,2 组患者复发率比较差异无统计学意义(P>0.05)。见表2。

表2 初始失败组与初始成功组肾盂旁囊肿患者手术相关指标及预后情况比较
3 讨论
临床上将起源于肾窦的肾盂周围囊肿以及起源于肾窦外侵入肾窦的肾盂旁囊肿统称为肾盂旁囊肿。因该囊肿与肾盂关系密切,故临床表现多数与集合系统或肾蒂血管受囊肿压迫有关,主要表现为腰痛、血尿、结石,少部分患者会出现泌尿系统感染、肾血管性高血压、肾衰竭等。临床上对于有典型临床表现及并发症、囊肿>5 cm 或有癌变倾向的肾盂旁囊肿均应积极行手术治疗[4]。目前腹腔镜囊肿去顶减压仍为治疗肾囊肿的最常用手段,但对于某些肾盂旁囊肿,因其位置较深,术中易损伤肾门部集合系统及血管,造成尿瘘及严重出血。而经皮囊肿穿刺减压(伴或不伴硬化剂注射)虽创伤小,但因复发率高,且硬化剂误入集合系统可能引起肾盂、肾盏严重粘连以及纤维化。因此,随着微创手术技术的不断发展,运用人体自然腔道进行手术从而治疗疾病已成为外科医生推荐的方式。近几年,国内外均有报道应用输尿管软镜钬激光切开内开窗引流的方法治疗肾盂旁囊肿的案例,且均获得不错的治疗效果[8-9]。
输尿管软镜通过自然腔道容易进入集合系统,而肾盂旁囊肿与集合系统之间一般只有一层很薄的壁,从囊肿最薄弱处用钬激光切开囊壁,可以达到创伤小、恢复快的效果。目前普遍认为把握手术适应证是运用输尿管软镜治疗肾盂旁囊肿成功的关键之一,结合文献[10-12],该手术的适应证主要为:(1)囊肿为内生型,并存在明显挤压肾盂、肾盏造成积水;(2)影像学提示囊肿靠近集合系统;(3)术前影像学检查排除恶性肿瘤可能;(4)合并有结石或者有腰痛、血尿症状。其中前3 项为必要条件。本研究中29 例患者术前均行CTU 检查,提示囊肿靠近集合系统,并造成肾盂、肾盏积水,其中3 例伴发肾结石,17 例有不同程度患侧腰部酸胀,3 例合并结石者有镜下血尿。
此外,术中如何准确辨别囊壁也是运用输尿管软镜治疗肾盂旁囊肿能否成功的一大要素。虽然一些文献报道输尿管镜下囊壁典型表现,黏膜薄透、血管纹理少、略呈蓝色半透明状等。但笔者发现在实际手术操作中,有许多患者在软镜进入后只看到均匀一致的肾盂黏膜,加上操作空间狭小,软镜指向性差,给术中分辨囊壁带来了困难[13-14]。本研究中,初始失败组8 例患者的囊肿在镜下均为无典型半透明显像,术中单凭肉眼很难分辨出囊壁与肾盂黏膜,在内镜下反复寻找而无法确认囊肿位置后,术中改联合超声实时引导定位,通过观察软镜在肾盂内位置的实时变换,确认与囊肿的相对位置,准确找到囊壁。从应用超声到准确定位囊肿的时间为(3.5±1.0)min,明显提高了囊壁定位效率。实际上,术中超声不仅有助于辨别囊壁,找到囊壁最薄弱点,尽可能在囊肿中央切开,还可以实时监视开窗和置管等过程,确保手术安全和有效性。国内也有一些学者采用术前超声引导局部麻醉下行经皮肾囊肿穿刺术注射亚甲蓝液,方便术中探查定位[15],但局部麻醉下操作可能给患者带来痛苦,也有出血的风险。同时,笔者在查阅相关文献时注意到一些学者建议在术前常规留置双J 管1~2 周,以此扩张输尿管及引流肾盂积液,防止术中因输尿管狭窄或肾盂大量积水而影响手术成功率[14,16-17]。但笔者认为,术前留置双J 管不仅增加患者痛苦及治疗费用,而且延长了整体治疗时间,此外如果双J 管未留置到位,亦很难取得相应的效果。因此,本研究中29 例患者术前均未留置双J 管,通过术前CTU 检查,可以大致判断患者输尿管的手术条件(有无狭窄或扭曲)。如术中探查发现输尿管条件不好,则留置双J 管2 周后再行二期手术治疗。本研究中29 例患者均一期成功手术。其中初始失败组手术时间为(50.0±8.7)min,略高于文献报道的手术时间[12-13,18],这可能与这些病例并非一开始就主动使用超声定位,而是在输尿管软镜下寻找囊壁未果后才联合超声引导有关,但优于李卫平等[19]报道的腹腔镜手术的手术时间。
综上所述,经尿道输尿管软镜钬激光内开窗术治疗肾盂旁囊肿具有微创、疗效好、术后恢复快等优点,在短期内治疗肾盂旁囊肿效果确切,是肾盂旁囊肿的理想治疗方法,值得临床推广应用。对于定位困难的肾盂旁囊肿病例,超声联合内镜定位能明显缩短定位时间,提高囊肿定位成功率,更安全可靠。
