人脐带间充质干细胞来源外泌体增强心脏肌成纤维细胞血管形成作用
2022-11-09赵媛媛李洁洁费苏燕
赵媛媛,李洁洁,费苏燕,陈 忱,徐 鑫,王 韧,朱 伟
(江苏大学 1.医学院、2.附属医院,江苏 镇江 212013)
近年来,外泌体(exosomes)作为一种新型生物材料或药物载体在肿瘤和组织损伤修复等领域应用前景令人期待[1]。心肌缺氧损伤后增强血管形成,恢复血供对于炎症清除及损伤修复至关重要,研究表明,干细胞及其exosomes可通过促进血管形成发挥心肌保护作用[2 -3]。心脏成纤维细胞在非心肌细胞中占比最大,在心肌损伤后各个阶段均发挥重要作用,近年来有研究者关注到心脏成纤维细胞的血管形成作用。心肌梗死后修复阶段,成纤维细胞转分化为高表达α-SMA的肌成纤维细胞,产生抗炎和促血管生成因子,研究者发现,心肌梗死后d3心脏成纤维细胞能够促红细胞生成和促血管生成[4 -5]。此外,还有研究者从小鼠心脏中分离出两种成纤维细胞亚型,并证实FSP1阳性成纤维细胞亚群具有突出的促血管生成作用[6]。成纤维细胞去分化为中间型CD34+祖细胞,可以产生内皮细胞和成红细胞,进而产生功能性血管或红细胞,并挽救缺血组织[7]。
前期研究发现,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hucMSC)来源exosomes利于组织损伤修复,促进炎症条件下成纤维细胞转分化[8-9]。HucMSC-exosomes能否通过增加心脏肌成纤维细胞分泌血管形成相关因子从而促进血管形成还未可知。本研究采用一系列实验检测exosomes作用后心脏肌成纤维细胞对内皮细胞增殖、迁移和小管形成能力的影响及可能机制。这将为探索心肌损伤修复相关机制提供实验依据,为干细胞或生物材料治疗心肌损伤相关研究提供基础。
1 材料与方法
1.1 主要材料脐带组织标本取自江苏大学附属医院妇产科,标本收集及使用遵循知情同意原则,并通过伦理委员会批准。SD大鼠(1~3日龄)取自江苏大学实验动物中心,相关动物实验经江苏大学实验动物中心批准,实验动物使用许可证号:SYXK(苏)2018-0053。人脐静脉内皮细胞HUVEC来源于ATCC细胞库。
1.2 主要仪器流式细胞仪(Beckman Coulter公司,美国);高速冷冻离心机(Thermo Fisher Scientific公司,美国);透射电子显微镜(日本电子);Nanosight纳米颗粒分析仪(Malvern Panalytical公司,英国);紫外/核酸蛋白检测仪(Thermo Fisher Scientific公司,美国);Western blot垂直电泳仪(Bio-Rad公司,美国);ImageQuant LAS 4000 mini 化学发光成像仪(GE公司,美国);实时荧光定量PCR仪(Bio-Rad公司,美国);荧光显微镜(Olympus Corporation公司,日本);光学显微镜(Nikon公司,日本);酶标仪(BioTek 公司,美国)。
1.3 主要试剂L-DMEM (Gibco公司,美国,01-051-1A);H-DMEM(Gibco公司,美国,06-1055-57-1A);α-MEM培养基(Gibco公司,美国,01-042-1);胎牛血清FBS(Biological Industries公司,以色列,04-001-1A);HBSS平衡盐溶液(Gibco公司,美国,14170112);胰酶(Worthington公司,美国,LS003708);胰酶抑制剂(Worthington公司,美国,LS003570);Ⅱ型胶原酶(Worthington公司,美国,LS004174);CCK8试剂(上海碧云天生物技术有限公司,中国,C0039);基质胶(Corning公司,美国,356234);BCA蛋白定量试剂盒(康为世纪生物科技有限公司,中国,CW0014S);RNA提取试剂盒(Invitrogen公司,美国,15596018);逆转录试剂盒(康为世纪生物科技有限公司,中国,CW2569M);Transwell培养板(Corning 公司,美国,3422);α-SMA(Cell Signaling Technology 公司,美国,19245T);CD81(Cell Signaling Technology公司,美国,52892S);calnexin(Cell Signaling Technology公司,美国,2679T);GAPDH(Cell Signaling Technology公司,美国,51332S);VEGF-A(武汉博士德生物工程有限公司,中国,A00045);ICG-001(上海碧云天生物技术有限公司,中国,SF6827);β-actin(Cell Signaling Technology 公司,美国,4970S);荧光二抗(Cell Signaling Technology 公司,美国,4412S)。
1.4 方法
1.4.1HucMSC及其来源exosomes分离及鉴定 依据先前实验方法[8-9],培养hucMSC,采用流式细胞术检测其相关表面标记 CD19、CD34、CD45、CD29、CD105 和CD90。收集hucMSC无exosomes血清培养基,分别经4 ℃,300g离心20 min,800g离心20 min,2 000g离心20 min,1×104g离心30 min以去掉细胞及细胞碎片,使用超速离心法提取exosomes。Exosomes经透射电子显微镜记录其形态,使用Nanosight纳米颗粒分析仪检测exosomes粒径分布情况。
向hucMSC或exosomes中加入蛋白裂解液,低温裂解提取相应蛋白,BCA法检测蛋白浓度后加入5×loading buffer充分混匀,沸水浴10 min备用。制备聚丙烯酰胺凝胶,以每孔150 μg蛋白量上样,60 V恒压进行电泳,当样品到达分离胶时行100 V恒压电泳,电泳结束后,以350 mA恒流冰上转膜120 min,随后将PVDF膜置于脱脂牛奶中封闭1 h,4 ℃过夜孵育相应一抗CD81、calnexin和GAPDH,1× TBST洗涤,37 ℃孵育辣根过氧化物酶标记相应二抗1 h,1× TBST洗涤,最后加入适量显色底物,采用ImageQuant LAS 4000 mini化学发光成像仪成像。
1.4.2心脏肌成纤维细胞分离培养及鉴定
1.4.2.1 分离培养心脏肌成纤维细胞 选取1~3日龄SD大鼠,麻醉后无菌环境下取出心脏,HBSS平衡盐溶液洗涤3遍,将心肌组织剪碎至1 mm3大小,加入胰酶轻柔吹打混匀,4 ℃过夜。次日,加入胰酶抑制剂及II型胶原酶,37 ℃恒温消化,当大部分组织块消失时用H-DMEM培养液(含10% FBS)终止消化,40 μm滤网过滤后将滤过液转移至新离心管中,800g离心5 min,弃上清,H-DMEM培养液(含10% FBS)重悬细胞并接种于细胞培养板或培养皿中,培养90 min后弃掉未贴壁细胞,更换α-MEM培养基(含10% FBS),继续于37 ℃,5 % CO2细胞培养箱中培养备用。
1.4.2.2 免疫荧光细胞化学染色 预先将细胞爬片置于培养皿中,接种生长状态良好原代肌成纤维细胞,37 ℃,5 % CO2细胞培养箱培养。待细胞达到合适密度时,行4%多聚甲醛固定,PBS洗涤,0.1% Triton X-100作用,5% BSA封闭,4 ℃过夜孵育一抗α-SMA,37 ℃孵育相应荧光二抗,Hoechst染色等步骤,最后使用荧光显微镜拍照。
1.4.3收集对照组和exosomes作用组心脏肌成纤维细胞及其培养基 当接种于细胞培养皿中的原代肌成纤维细胞密度达到60%~70%时,对照组加入α-MEM培养基(含10% FBS),exosomes作用组加入α-MEM培养基(含10% FBS)和hucMSC来源exosomes(200 mg·L-1),37 ℃,5% CO2培养24 h,更换新鲜培养基继续培养24 h,收集细胞及细胞培养基。收集细胞用于检测心脏肌成纤维细胞VEGF-A水平,此外β-catenin信号通路与促进血管形成密切相关,然而此实验条件下VEGF-A表达是否与β-catenin信号相关还不清楚,因此,在加入exosomes同时使用β-catenin/TCF 介导的转录抑制剂ICG101(10 μmol·L-1)后,采用Western blot检测VEGF-A表达水平。用对照组和exosomes作用组心脏肌成纤维细胞培养基预处理内皮细胞24 h,检测细胞增殖、迁移及小管形成能力。
1.4.4CCK-8细胞增殖实验 将预处理后的内皮细胞接种于96孔板,到达24、48和72 h时,加入CCK-8试剂,2 h后,用酶标仪测定450 nm波长吸光度值。
1.4.5Transwell细胞迁移实验 当预处理后的血管内皮细胞细胞密度达到约80%时,用无血清 α-MEM培养基重悬细胞,取200 μL细胞悬液加入上室,下室加入α-MEM培养基(含10 % FBS),37 ℃,5 % CO2培养8 h,取出Transwell小室,PBS轻柔清洗两遍,用棉签轻轻擦去未迁移细胞,4%多聚甲醛固定30 min,PBS清洗3次,0.1%结晶紫染色液染色5 min,PBS清洗3次,干燥后于显微镜下拍照。
1.4.6细胞划痕实验 预先在6孔板外底部画3条标记线,接种预处理的血管内皮细胞,37 ℃,5% CO2培养,待细胞几乎铺满板底时,用10 μL无菌吸头在培养板内底部垂直于预画标记线划3条痕迹,PBS清洗2遍,分别加入α-MEM培养基(含10% FBS),使用倒置显微镜拍照起始划痕间隙(记为0 h),随后分别在6 h和12 h再进行拍照记录。
1.4.7小管形成实验 预先加入50 μL基质胶于96孔细胞培养板中(冰上操作),37 ℃静置使基质胶凝固,接种预处理后的血管内皮细胞,分别加入α-MEM培养基(含10% FBS),37 ℃,5% CO2培养12 h,使用倒置显微镜对内皮细胞成管情况拍照记录。
1.4.8细胞总RNA提取、逆转录及实时荧光定量PCR 收集对照组及exosomes作用组心脏肌成纤维细胞,RNA提取试剂盒提取细胞总RNA,紫外分光光度法测定RNA浓度,依据逆转录试剂盒说明书步骤逆转录。以cDNA为模板进行实时荧光定量PCR检测VEGF-A相对表达量,其中β-actin作为内参,引物序列见Tab 1。

Tab 1 Primer sequences
1.4.9细胞总蛋白提取及Western blot 参照上述hucMSC来源exosomes鉴定方法学中细胞总蛋白提取及Western blot方法,加入适量细胞裂解液至对照组及exosomes作用组心脏肌成纤维细胞,经细胞裂解、离心、BCA法检测蛋白浓度以及加入5×loading buffer沸水浴等步骤后,制备聚丙烯酰胺凝胶,按照每孔蛋白量150 μg上样,经电泳、转膜、封闭后,4 ℃过夜孵育相应一抗VEGF-A和β-actin,洗膜后37 ℃孵育辣根过氧化物酶标记相应二抗,加入相应显色液,采用ImageQuant LAS 4000 mini化学发光成像仪成像。

2 结果
2.1 HucMSC形态及exosomes鉴定显微镜下可见hucMSC呈长梭形,漩涡样生长,具有典型的间充质干细胞形态(Fig 1A)。流式细胞术检测hucMSC相关表面标记,结果显示其不表达CD19、CD34和CD45,而高表达CD29、CD105和CD90,与间充质干细胞特性相符(Fig 1B)。经透射电子显微镜和Nanosight纳米颗粒分析仪检测发现,hucMSC来源exosomes粒径约100~200 nm(Fig 1C,D)。Western blot结果显示,相较于hucMSC,其exosomes高表达跨膜蛋白CD81,不表达内质网的特异性分子Calnexin,这些均与exosomes特征相符(Fig 1E)。
2.2 大鼠心脏肌成纤维细胞鉴定分离培养大鼠心脏成纤维细胞,由Fig 2免疫荧光细胞化学染色发现,细胞高表达α-SMA,提示细胞已被激活处于转分化阶段,为心脏肌成纤维细胞。
2.3 Exosomes作用后心脏肌成纤维细胞促进内皮细胞增殖能力与对照组相比,采用hucMSC来源exosomes作用心脏肌成纤维细胞后培养基预先处理内皮细胞,CCK-8细胞增殖实验检测发现,在72 h时间点,exosomes作用组与对照组内皮细胞450 nm吸光度值差异具有统计学意义(Fig 3),表明exosomes作用后心脏肌成纤维细胞可促进内皮细胞增殖。
2.4 Exosomes作用后心脏肌成纤维细胞促进内皮细胞迁移Transwell细胞迁移实验结果发现,exosomes作用组迁移至小室另一侧内皮细胞数量明显多于对照组(Fig 4A)。此外,在12 h记录点,exosomes作用组内皮细胞中间划痕区已被填满,而对照组仍留有一定距离,提示与对照组相比,exosomes 作用组的HUVEC迁移能力明显增加(Fig 4B)。
2.5 Exosomes作用后心脏肌成纤维细胞使内皮细胞成管能力增强如Fig 5所示,exosomes作用组内皮细胞形成小管管腔数量以及节点数量均比对照组明显增加。提示exosomes作用后心脏肌成纤维细胞能够增强内皮细胞成管能力。
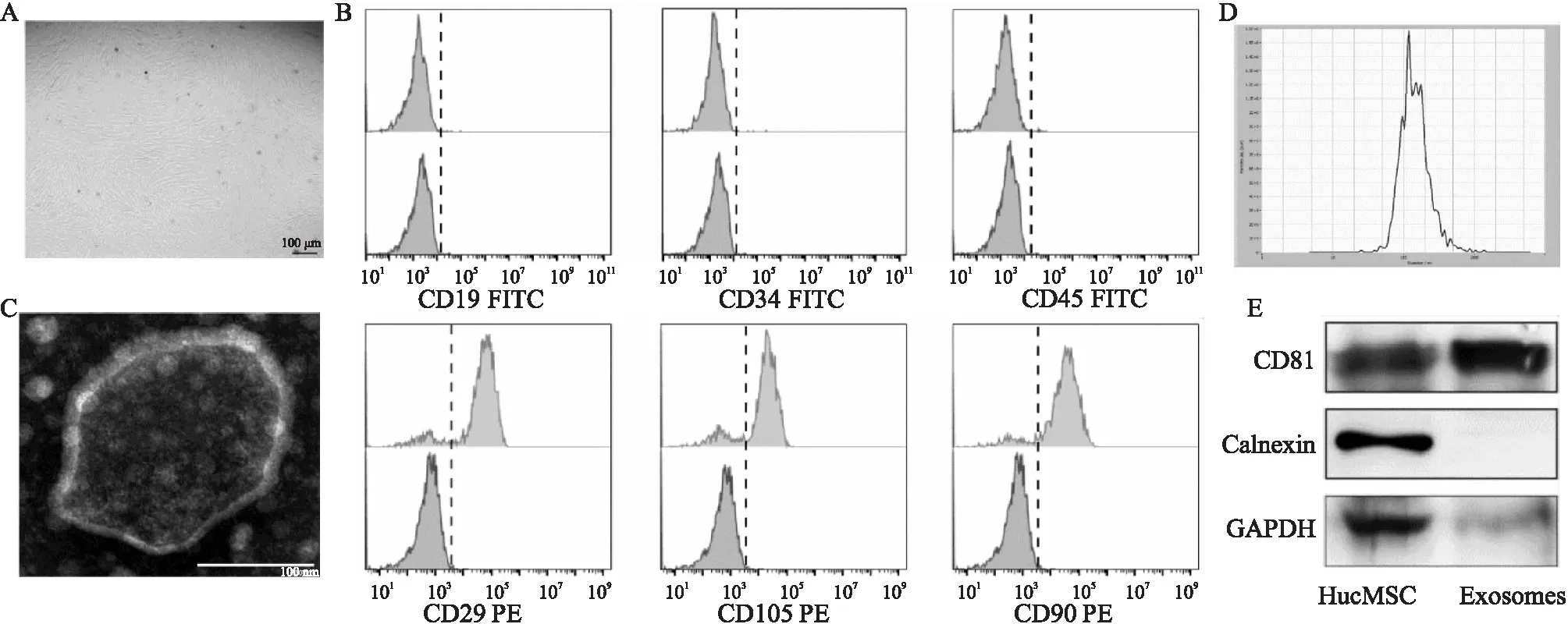
Fig 1 Characterization of hucMSC and hucMSC-exosomes
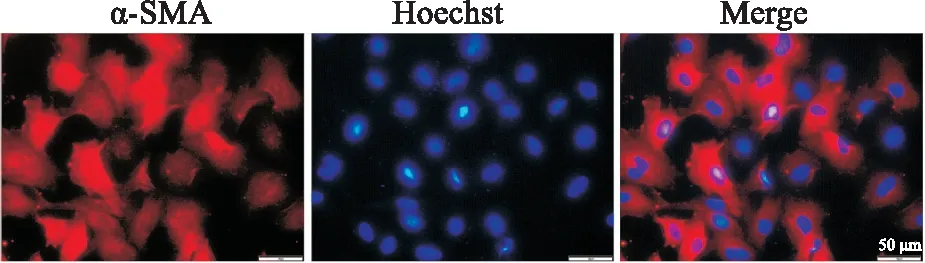
Fig 2 Expression of α-SMA in cardiac myofibroblasts detected
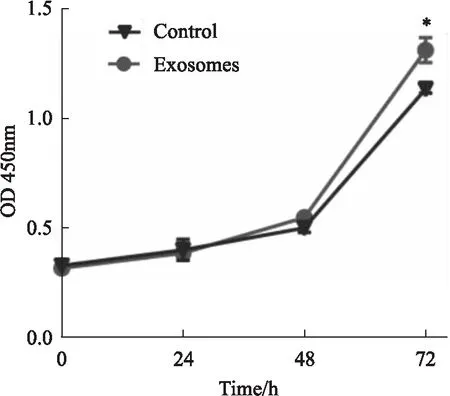
Fig 3 The proliferation ability of HUVECs enhanced by cardiac
The proliferation ability of HUVECs was detected by CCK-8 assay.*P<0.05vscontrol group.
2.6 HucMSC来源exosomes通过β-catenin信号促进心脏肌成纤维细胞表达VEGF-AVEGF-A是血管形成所需重要细胞因子,hucMSC来源exosomes作用心脏肌成纤维细胞后收集细胞,荧光定量PCR实验(Fig 6A)与Western blot检测结果(Fig 6B)发现,与对照组相比,exosomes作用组VEGF-A表达水平升高。加入β-catenin/TCF 介导的转录抑制剂后,VEGF-A表达水平降低(Fig 6C)。
3 讨论
Exosomes是细胞内多囊泡体外膜与细胞膜融合后释放到细胞外,内含蛋白质或RNA等多种生物大分子的一种纳米颗粒,既含有来源细胞的生物分子,还具有来源广泛、安全性高和易于保存运输等优点,在药物递送、组织损伤修复等方面有很好的应用前景。其中在心肌组织损伤修复相关研究中,心脏成纤维细胞作为心脏组织中重要的细胞类型,近年来主要关注点在心肌纤维化及心脏重塑方面[10 -11],间充质干细胞来源exosomes能够抑制心肌纤维化的研究也有报道[12]。然而,有研究表明在心肌损伤后增殖阶段,心脏成纤维细胞可释放促血管形成相关因子[4]。成纤维细胞的促血管形成作用在心肌损伤修复过程中值得关注,本研究通过内皮细胞管形成等一系列实验发现,经hucMSC来源exosomes作用后的心脏肌成纤维细胞,可以促进内皮细胞增殖、迁移和小管形成。VEGF-A是促进血管形成的重要因子,一方面exosomes能够富集VEGF-A进而促进血管形成[13],另一方面主要是exosomes通过作用于血管内皮细胞增加VEGF-A的表达,促进血管形成,进而促进损伤修复[14]。此外β-catenin信号通路与促进血管形成密切相关,进一步检测发现exosomes作用后的心脏肌成纤维细胞VEGF-A表达增加,并与β-catenin信号相关。
据研究报道成纤维细胞促进血管形成相关机制可能涉及成纤维细胞间质内皮细胞转化,成纤维细胞转分化为肌成纤维细胞进而分泌促血管形成因子。Ke等[15]报道人内皮源性exosomes通过促进间质内皮细胞转化和降低高迁移率族蛋白HMGB1表达,增加心脏成纤维细胞的增殖和血管生成。另有研究发现成纤维细胞GATA-4和GATA-6促进了压力超负荷诱导的心肌肥厚的适应性重塑。心源性转录因子GATA-4和GATA-6在心脏成纤维细胞中发挥了新的作用,这两种蛋白质通过细胞间的协同作用,促进心肌血管形成和心脏功能[16]。Li等[17]证明了干细胞来源的细胞外囊泡携带miR-486-5p 通过成纤维细胞 MMP19-VEGF-A信号促进心脏血管新生的关键作用。本研究结果显示,hucMSC来源exosomes增加心脏肌成纤维细胞促血管形成能力,心脏肌成纤维细胞VEGF-A表达增加。然而更深入的细胞分子机制还需进一步探究,例如exosomes内哪种分子起关键作用、下游关键信号轴研究、成纤维细胞是否涉及间质内皮转化机制,这项研究可能为工程化exosomes应用提供有力的实验基础。
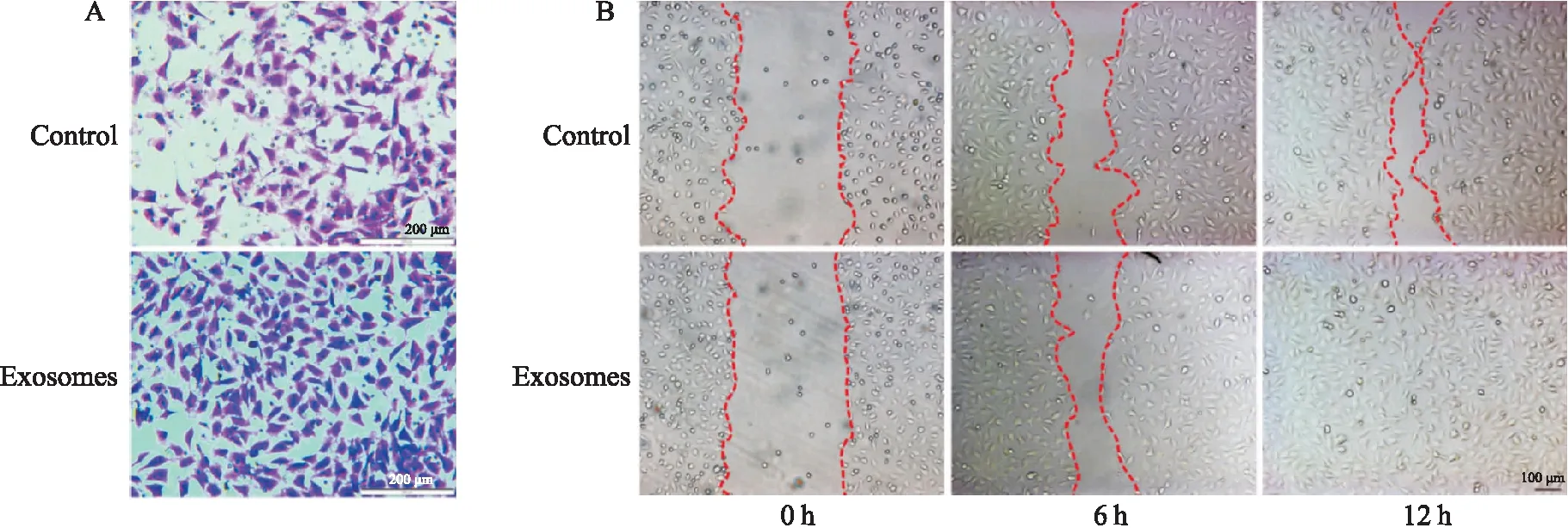
Fig 4 The migration ability of HUVECs enhanced by cardiac myofibroblasts pre-treated by hucMSC-exosomes
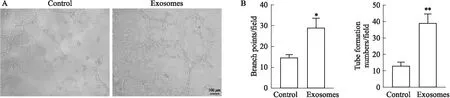
Fig 5 The tube forming ability of HUVECs enhanced by cardiac myofibroblasts pre-treated by n=3 )
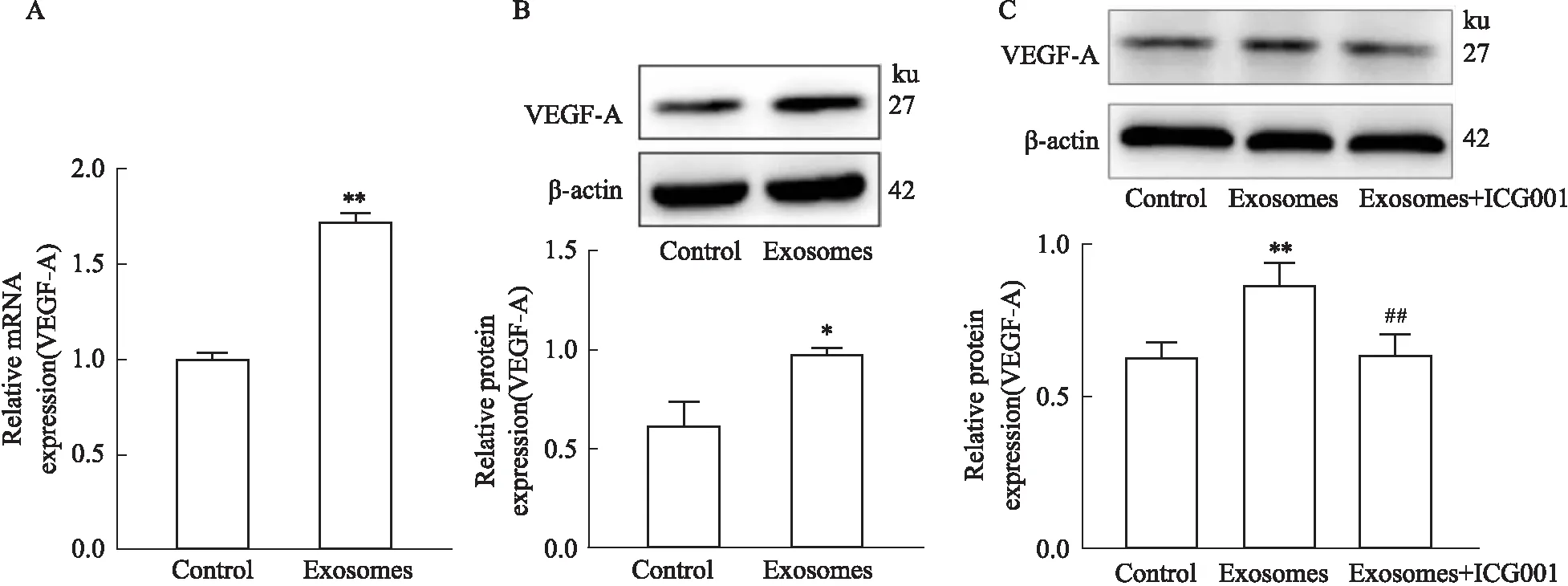
Fig 6 Expression of VEGF-A in cardiac myofibroblasts enhanced by HucMSC-exosomes via β-catenin n=3 )
