白术、莪术药对抗肿瘤作用的网络药理学及临床意义分析*
2022-11-09邱文超秦凯健
汪 猛,邱文超,秦凯健
(1.同济大学附属上海市第四人民医院,上海 200434;2.上海中医药大学附属岳阳中西医结合医院,上海 200437)
肿瘤病因病机复杂,并且存在异常细胞增殖、侵袭、转移、免疫逃逸、血管生成、能量代谢失衡等多种生物学特征[1]。虽然近年来诊断和治疗方面都取得了一定进步,但由于其发病率高、预后差[2],仍然对人类健康造成严重威胁。白术、莪术是临证常用的抗肿瘤中药,在治疗肿瘤的组方配伍中均有较高的使用频率[3]。白术健脾燥湿,莪术化瘀散结,两药配伍,攻补兼施。得益于攻坚而不伤正的特点,该药对广泛应用于多种肿瘤见痰瘀互结证者[4]。
单味中药、药对以及中药复方化学成分复杂,是中医药研究的特色和难点,单一成分、单一靶点的研究有较大局限。近年来,随着计算机、组学、大数据等技术方法的进步,及多学科渗透交叉,网络药理学应运而生。该方法可以从多成分、多靶点、多途径研究中药的作用机制,拓展了中医药研究的思路[5]。本研究拟基于网络药理学相关方法,挖掘白术、莪术药对抗肿瘤的作用机制,为进一步药理研究提供参考。
1 方法
1.1 白术、莪术成分和靶点的收集 基于TCMSP[6]、TCMIP[7]数据库,分别以“白术”“莪术”为关键词进行检索,获得白术和莪术的化学成分。利用PubChem[8]检索药物成分的名称和SMILES编码,基于Seaware(P-Value<0.01)分析平台[9]、STITCH(interaction score>0.40)[10]和Swiss Target Prediction(probability>0.50)[11]数据库,获取白术和莪术的作用靶点。
1.2 肿瘤疾病靶点的收集 基于GeneCards[12]、DisGeNET[13]、NCBI-gene(https://www.ncbi.nlm.nih.gov/)数据库,以“cancer”“tumor”“carcinoma”等为关键词进行检索,汇总、去重后,获得肿瘤疾病的靶点。
1.3 白术、莪术抗肿瘤靶点及相关转录因子的获取 由于白术、莪术成分的靶点信息来源不统一,因此将所获靶点在Uniprot[14]数据库中进行检索,物种设置为“human hsa(人)”,对收集、筛选得到的靶点名称进行统一。采用R(version 3.6.1)软件(https://www.r-project.org/)对药物成分的靶点和疾病的靶点进行映射,获取白术、莪术抗肿瘤作用的潜在靶点。同时,基于Metascape[15]数据库TRRUST模块,分析靶点相关的转录因子,预测白术、莪术对转录因子的调控潜能。
1.4 靶点蛋白互作网络和成分-靶点网络的构建 将白术、莪术药对抗肿瘤靶点导入STRING[16]数据库获取靶点蛋白互作关系。将白术、莪术药对成分和抗肿瘤靶点分别导入Cytoscape 3.6.1[17],构建靶点蛋白互作网络,并通过Cytoscape cytoHubba模块分析靶点蛋白在网络中的度值(Degree Value),度值排名靠前的靶点为网络中的核心靶点;基于Cytoscape构建药物成分-肿瘤靶点网络,并利用已获得的核心靶点以及前述Seaware、STITCH和Swiss Target Prediction平台提供的药物成分-靶点对应关系,进一步获得核心药物成分-肿瘤靶点网络。
1.5 富集分析 将白术、莪术药对抗肿瘤靶点导入Enrichr[18]数据库获得靶点与疾病关系的参数,通过R语言对富集分析结果进行可视化处理,获得白术、莪术药对作用的肿瘤类型。
基于DAVID数据库对白术、莪术药对抗肿瘤靶点进行GO和KEGG富集分析[19-20],其中GO富集分析包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞成分(cellular component,CC)3个模块。通过R语言对富集分析结果P值排名前20的条目进行可视化处理。
1.6 分子对接 通过PubChem[8]获取白术、莪术药物成分的化学结构,通过Protein Data Bank平台[21]获取白术、莪术药对抗肿瘤核心靶点蛋白的晶体结构。运用Molecular Operating Environment(MOE)[22]软件进行分子对接,模拟药物成分及其对应靶点蛋白间的相互作用,并计算结合强度。
1.7 免疫细胞浸润丰度分析 基于TIMER数据库Gene模块[23-24],对白术、莪术药对抗肿瘤核心靶点在肿瘤组织中的表达水平与不同免疫细胞的浸润丰度进行相关性分析,获取偏相关系数(partial correlation coefficients)及统计学P值。
1.8 靶点在肿瘤组织的基因表达情况 基于GEPIA2数据库[25],获取患者肿瘤组织的基因表达情况,分析靶点在各类肿瘤中的基因相对表达水平,绘制基因表达量示意图,颜色越深代表相应的表达水平越高。同时,基于The Cancer Genome Atlas(TCGA,https://www.cancer.gov/tcga)数据库,获取肿瘤组织和癌旁组织Fregments Per Kilobase per Million(FPKM)格式的RNAseq数据,并对数据进行log2转化,用以分析白术、莪术药对抗肿瘤核心靶点在患者肿瘤组织和癌旁组织的差异表达情况。
1.9 核心靶点的临床预后价值 基于TCGA数据库(https://www.cancer.gov/tcga)下载临床患者肿瘤组织和癌旁组织的RNAseq数据(FPKM格式)且进行log2转化,用以分析临床预后。Nomogram分析[26]整合临床病理分期和多个核心靶点作为预测指标,基于多因素COX回归模型,绘制有刻度的线段,用以探讨核心靶点表达情况对肿瘤患者1年、3年及5年生存率的影响程度。受试者工作特性(receiver operating characteristic,ROC)分析用以探讨核心靶点的预后判断效能,ROC曲线下面积(Area Under Curve,AUC)提示预测准确性,AUC越接近1,即曲线下面积越大,说明预测准确率越高[27]。基于GEPIA 2[25]数据库,采用Kaplan-Meier生存曲线分析法,探讨核心靶点表达水平与肿瘤患者总生存期、无病生存期的关系。
2 结果
2.1 白术、莪术药对的潜在抗肿瘤靶点 经筛选整理,共获取240个药物成分,其中白术62个,莪术188个,包含10个共同成分;药物成分作用的潜在靶点379个,其中白术265个,莪术211个,有97个共同靶点;肿瘤疾病相关靶点31 490个。药物成分靶点与肿瘤疾病靶点映射取交集得到192个共同靶点,即白术、莪术药对发挥抗肿瘤作用的潜在靶点。(见图1)
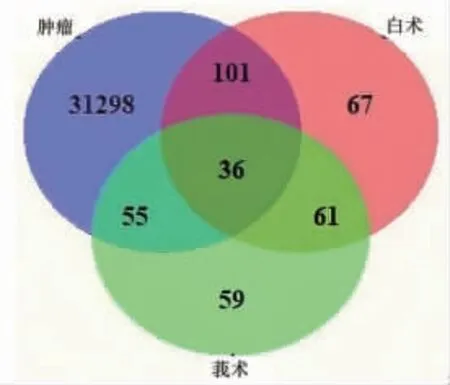
图1 白术、莪术药对与肿瘤疾病靶点的交集
2.2 白术、莪术药对抗肿瘤靶点蛋白互作网络 白术、莪术药对抗肿瘤潜在靶点的蛋白互作网络包含192个节点和1 419条连线。(见图2)进一步获得核心蛋白互作网络,显示白术、莪术抗肿瘤的核心靶点包括AKT1、VEGFA、GRM3、GRM4等,图中节点由黄色渐变为红色,提示度值(Degree Value)结果逐渐增大,靶点的重要性可以参考度值进行判断。(见图3、表1)
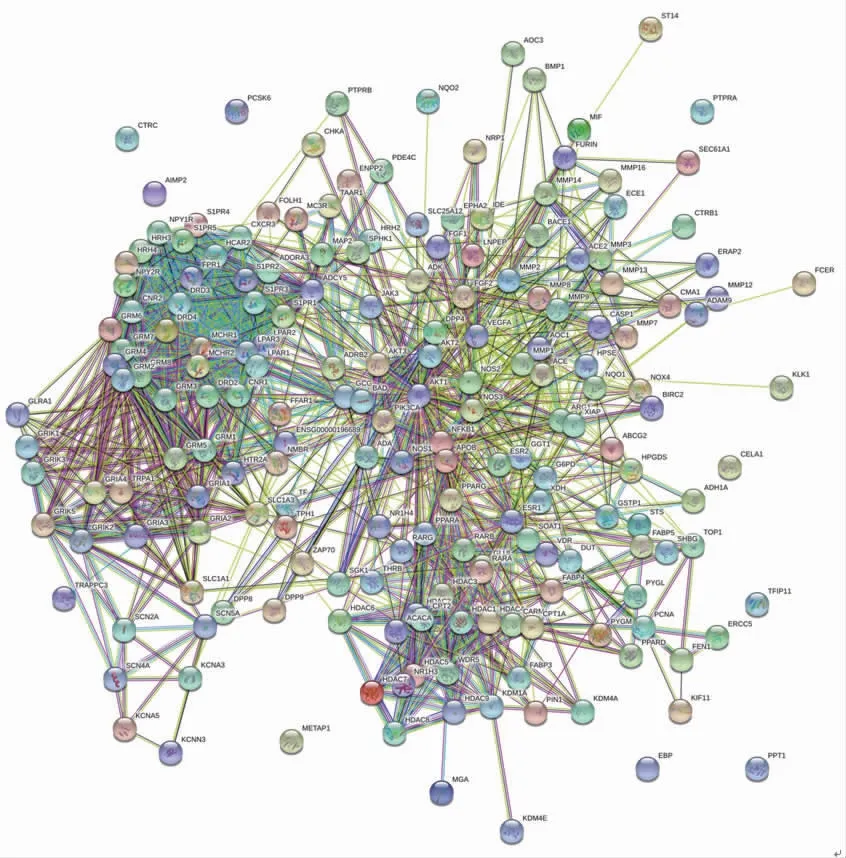
图2 白术、莪术药对抗肿瘤靶点的蛋白互作网络
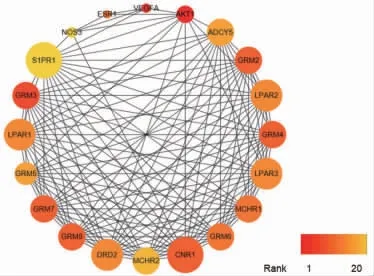
图3 白术、莪术药对抗肿瘤核心靶点的蛋白互作网络
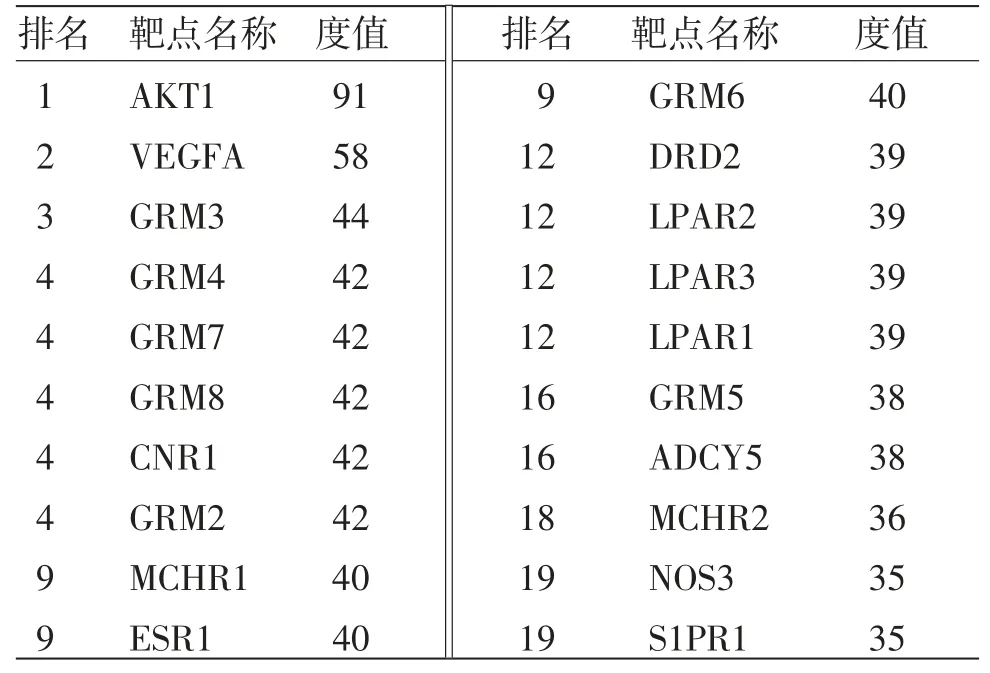
表1 白术、莪术药对抗肿瘤靶点的度值(前20)
2.3 白术、莪术成分-肿瘤靶点网络 白术、莪术成分-肿瘤靶点网络包含247个节点和549条连线。(见图4)药物成分-核心靶点网络中包含41个节点和63条连线,其中节点代表白术、莪术的药物成分或肿瘤疾病靶点,红色代表白术的成分,紫色代表莪术的成分,亮黄色代表白术和莪术的共同成分,土黄色代表白术的靶点,蓝色代表莪术的靶点,绿色代表白术和莪术的共同作用靶点;连线代表该成分可作用于相应的靶点。(见图5、表2)

表2 白术、莪术药对抗肿瘤主要成分
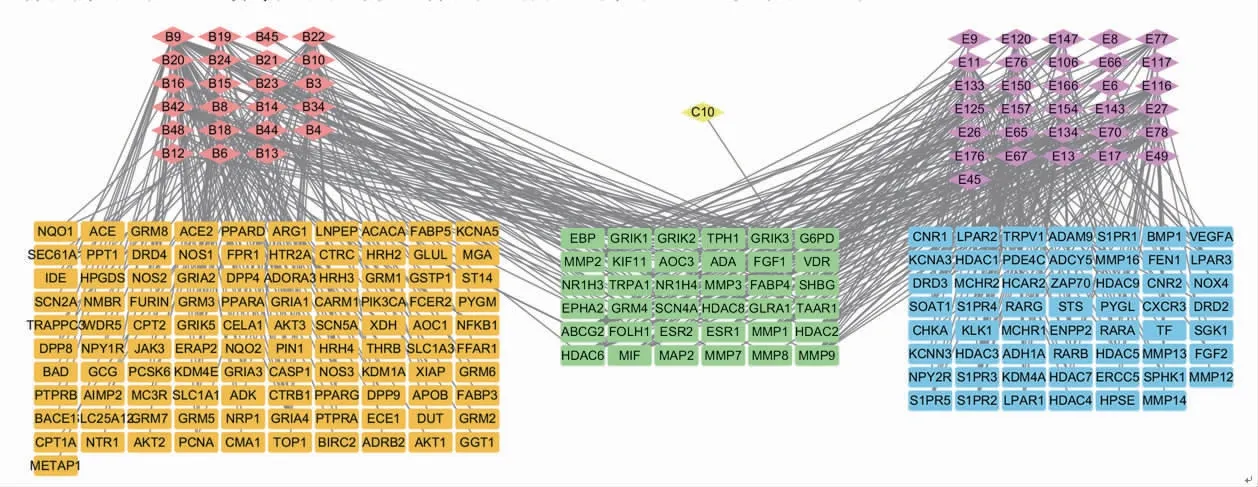
图4 白术、莪术药对抗肿瘤成分-靶点网络图

图5 白术、莪术药对抗肿瘤核心成分-靶点网络图
2.4 白术、莪术药对作用的肿瘤类型 采用富集分析方法,获得P<0.05的疾病种类条目,并分析其中的肿瘤疾病类型,对排名前20的条目作图展示,即白术、莪术药对作用的肿瘤类型,包括乳腺癌、肝癌、前列腺癌、肠癌、肺癌、胃癌、膀胱癌等。图中每条横柱后的数字是白术、莪术药对作用靶点富集在该疾病的数量。(见图6)

图6 白术、莪术药对作用的肿瘤疾病类型
2.5 白术、莪术药对抗肿瘤靶点GO和KEGG富集分析 对相关靶点进行功能注释及通路富集分析,对P<0.05且排名在前20的条目绘图展示,结果表明白术、莪术药对抗肿瘤作用涉及多个生物途径和通路。
GO富集分析结果包括组蛋白H3脱乙酰、调控血压、调控凋亡、离子型谷氨酸受体信号通路、细胞外基质分解、炎症反应、缺氧应答等生物过程,细胞质膜、胞浆、核浆、组蛋白脱乙酰酶复合物、AMPA谷氨酸受体复合物等细胞成分,以及谷氨酸受体活性、离子型谷氨酸受体活性、Ⅲ组代谢型谷氨酸受体活性、AMPA谷氨酸受体活性等分子功能。图中圆点越大,表明富集到的靶点数目越多,圆点的颜色由绿变红,表明P值越小。(见图7~9)
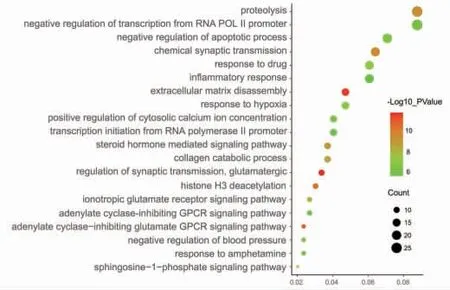
图7 白术、莪术抗肿瘤作用靶点GO 生物过程富集分析
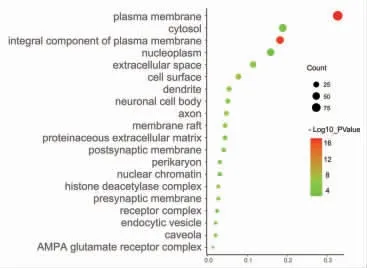
图8 白术、莪术抗肿瘤作用靶点GO 细胞成分富集分析

图9 白术、莪术抗肿瘤作用靶点GO 分子功能富集分析
KEGG富集分析结果表明白术、莪术药对抗肿瘤机制涉及cAMP信号通路、Rap1信号通路、雌激素信号通路、甲状腺激素信号通路、PPAR信号通路、HIF-1信号通路、VEGF信号通路、胰岛素抵抗、细胞凋亡、脂肪细胞脂解的调节、肾素-血管紧张素系统、精氨酸生物合成等。(见图10)
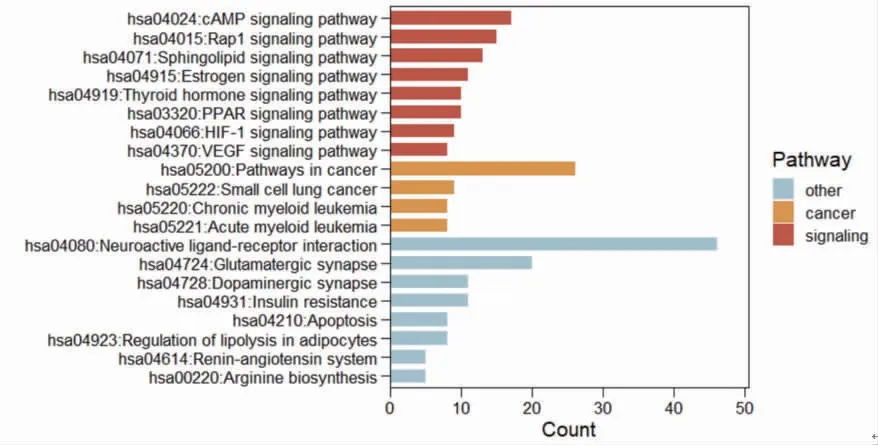
图10 白术、莪术抗肿瘤作用靶点KEGG 富集分析
2.6 白术、莪术成分-靶点蛋白分子对接 基于蛋白互作网络分析和Protein Data Bank数据库,获得度值排名靠前的核心作用靶点及其晶体结构,包括AKT1(PDB-ID 6HHG)、VEGFA(PDB-ID 5T89)、GRM3(PDB-ID 5CNM)等。将蛋白晶体中的原有配体重新与蛋白对接,以RMSD值为参考标准判断对接的方式是否发生改变。若配体的平均RMSD值<2Å,则说明方法具有可行性,对接参数可靠。MOE分子对接结果表明AKT1与L-苯丙氨酸(L-Phenylalanine)具有较强的结合作用,模拟计算其结合自由能为-57.625 kcal/mol。该方法下VEGFA、GRM3的蛋白靶点中,配体平均RMSD值>2Å,因此,运用软件中Flexible Alignment模块,考察靶点蛋白与相应化合物的结合模式,筛查出较优的拟合结果。其中,VEGFA与球松素(Pinostrobin)、VEGFA与西托糖苷(Sitogluside)、GRM3与谷氨酸(Glutamic acid)分别模拟分子对接,结合自由能依次为-13.017、-34.228、-141.838 kcal/mol。通常结合自由能<0提示化合物能够与靶点蛋白结合,结果表明,所分析的化合物及相应靶点蛋白有不同强度的结合潜力。(见图11、表3)
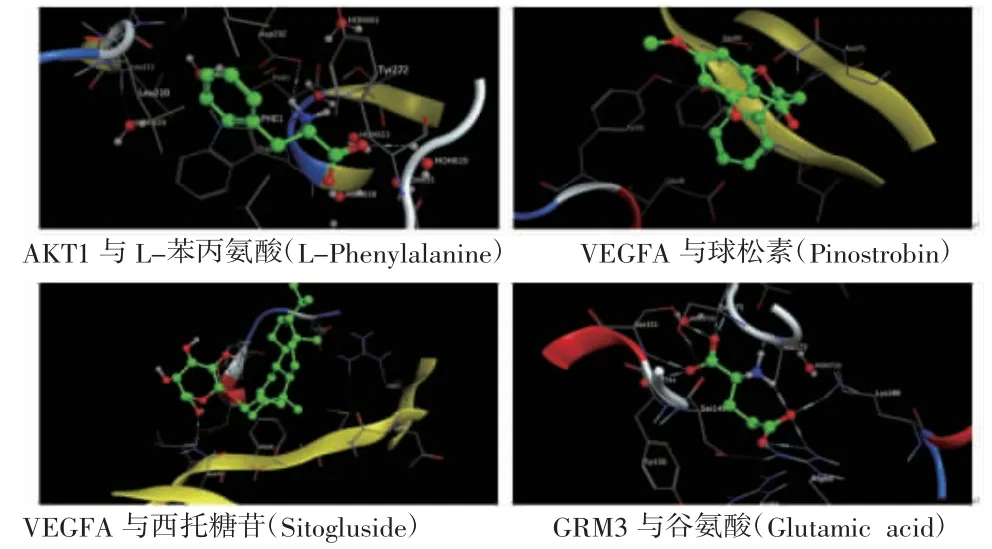
图11 白术、莪术抗肿瘤成分-靶点分子对接模拟图
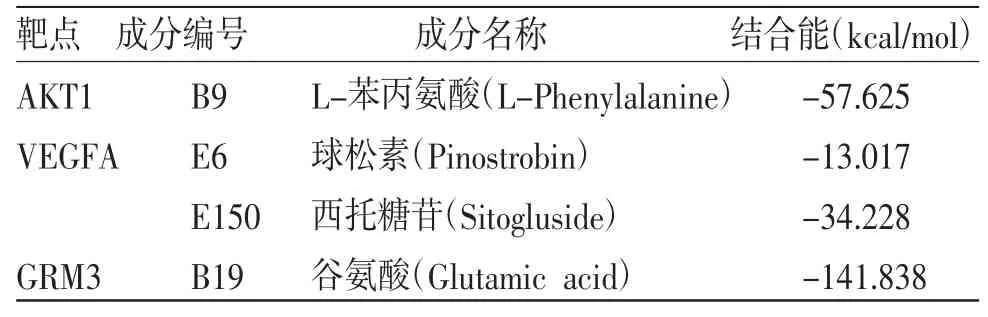
表3 白术、莪术抗肿瘤成分-靶点分子对接的结合能
2.7 白术、莪术抗肿瘤核心靶点相关的转录因子 转录因子是一种对基因的转录有激活或抑制作用的DNA结合蛋白,可以调控下游靶基因和信号通路。基于白术、莪术抗肿瘤核心靶点预测的转录因子包括RELA、NFKB1、STAT3、TP53、SP1等,并依据Metascape TRRUST平台计算结果lgP排序。分析结果提示白术、莪术药对可能通过调控这些转录因子,进而影响核心靶点的表达,发挥抗肿瘤作用。(见图12、表4)
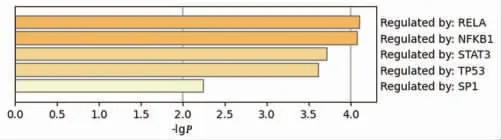
图12 白术、莪术抗肿瘤核心靶点相关的转录因子
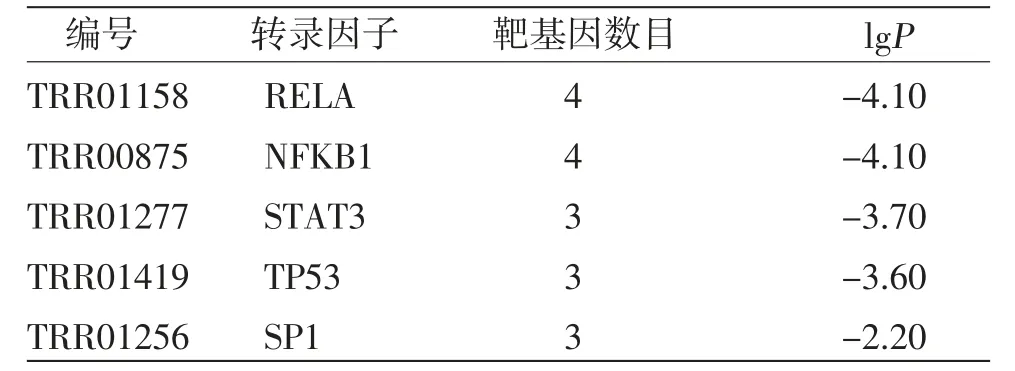
表4 白术、莪术抗肿瘤核心靶点相关的转录因子分析结果
2.8 白术、莪术药对抗肿瘤核心靶点与免疫细胞浸润丰度相关性 基于TIMER平台,对核心靶点AKT1、VEGFA、GRM3的基因表达水平与不同免疫细胞浸润丰度进行相关性分析。结果提示AKT1表达水平与结肠腺癌肿瘤纯度相关,VEGFA表达水平与乳腺浸润癌、肝细胞肝癌肿瘤纯度相关。分析表明,在结肠腺癌、乳腺浸润癌、肝细胞肝癌患者的临床样本中,AKT1、VEGFA、GRM3的表达水平与至少1种免疫细胞的浸润丰度相关(P<0.05),如B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、嗜中性粒细胞或树突状细胞等。其中BRCA、COAD、LIHC分别表示乳腺浸润癌(breast invasive carcinoma)、结肠腺癌(colon adenocarcinoma)、肝细胞肝癌(liver hepatocellular carcinoma)。(见图13~15、表5)

表5 核心靶点与免疫细胞浸润相关性的统计学意义(√表示P<0.05)
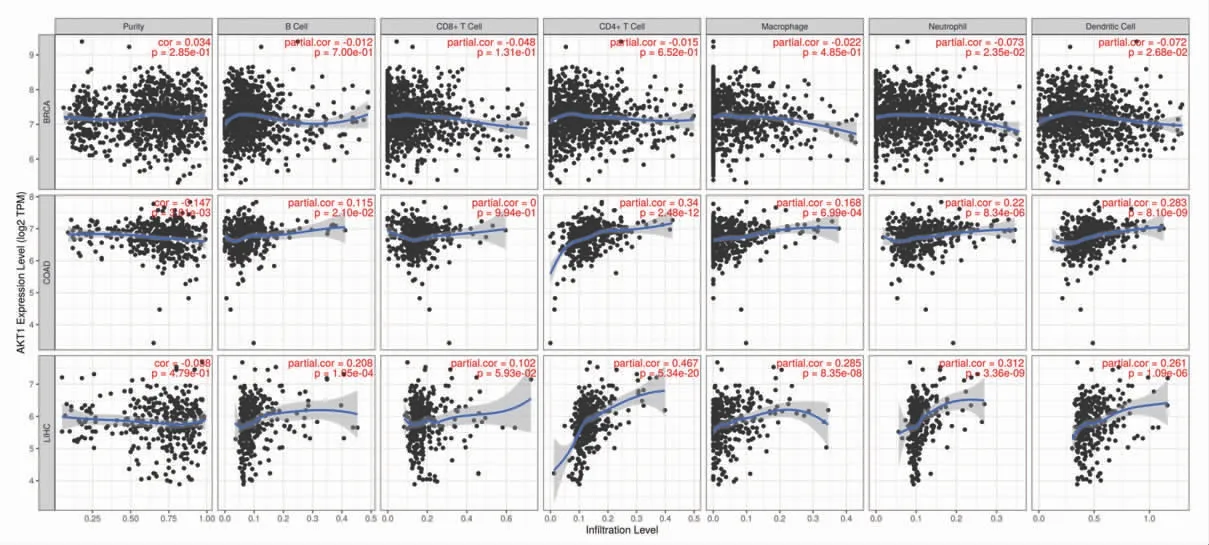
图13 AKT1 表达水平与免疫细胞浸润的相关性

图14 VEGFA 表达水平与免疫细胞浸润的相关性
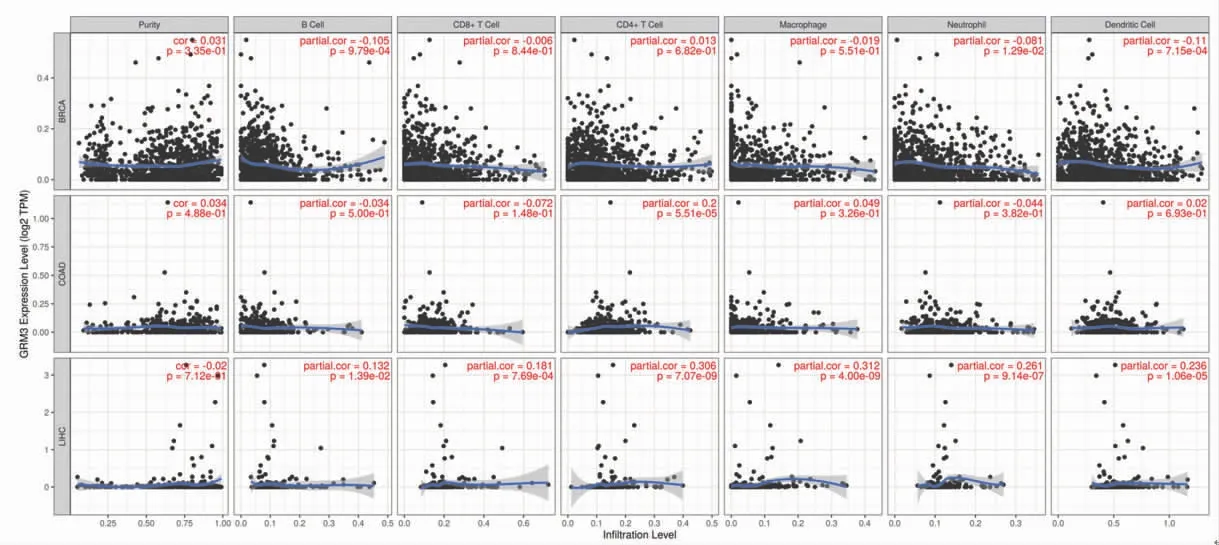
图15 GRM3 表达水平与免疫细胞浸润的相关性
2.9 白术、莪术药对抗肿瘤核心靶点在肿瘤组织中的表达情况 白术、莪术药对抗肿瘤核心靶点(前20)在不同肿瘤组织中的表达量有差异,其中AKT1、VEGFA等基因的表达量相对较高,GRM3、GRM4等基因的表达量相对较低,图中右侧数字代表相对表达水平,即颜色越深,数字越大,表达水平越高。(见图16)

图16 白术、莪术抗肿瘤核心靶点(前20)在不同肿瘤组织中的相对表达水平
对白术、莪术药对抗肿瘤核心靶点AKT1、VEGFA、GRM3在肿瘤组织和癌旁组织的表达差异进行比较分析,图中Tumor组为肿瘤组织,Normal组为癌旁组织。在乳腺浸润癌(BRCA)病例中,AKT1、VEGFA在Tumor组表达高于Norma l组(P<0.001),GRM3在Tumor组表达低于Normal组(P<0.001)。在结肠腺癌(COAD)病例中,VEGFA在Tumor组表达高于Normal组(P<0.001)。在肝细胞肝癌(LIHC)病例中,VEGFA在Tumor组表达高于Normal组(P<0.001),GRM3在Tumor组表达高于Normal组(P=0.006)。(见图17)
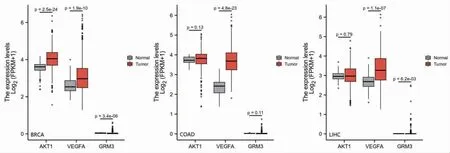
图17 AKT1、VEGFA、GRM3 在肿瘤组织和癌旁组织中的表达差异
2.10 白术、莪术药对抗肿瘤核心靶点的临床预后价值 TCGA患者临床数据的Nomogram分析结果提示,除了肿瘤的病理分期(Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期),白术、莪术药对抗肿瘤核心靶点AKT1、VEGFA、GRM3的表达水平对乳腺浸润癌、结肠腺癌、肝细胞肝癌患者的1年、3年、5年生存率也均有不同程度的影响。在乳腺浸润癌患者中,VEGFA的表达水平对临床结局的贡献较大,其次为GRM3、AKT1;在结肠腺癌患者中,AKT1的表达水平对临床结局的贡献较大,其次为GRM3、VEGFA;在肝细胞肝癌患者中,GRM3的表达水平对临床结局的贡献较大,其次为AKT1、VEGFA。(见图18~20)
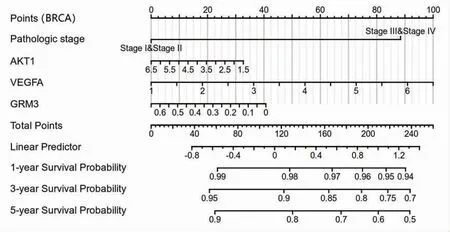
图18 Nomogram 分析AKT1、VEGFA、GRM3 表达水平对乳腺浸润癌患者预后的影响
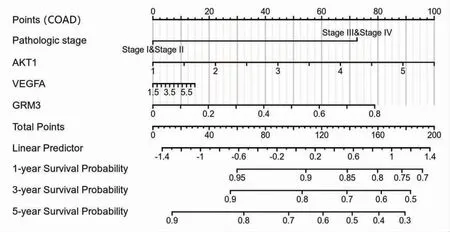
图19 Nomogram 分析AKT1、VEGFA、GRM3 表达水平对结肠腺癌患者预后的影响
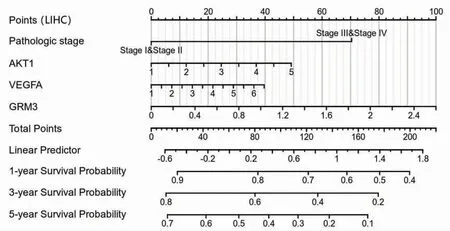
图20 Nomogram 分析AKT1、VEGFA、GRM3 表达水平对肝细胞肝癌患者预后的影响
为进一步了解核心靶点表达水平预测肿瘤患者临床结局的效能,笔者进行了ROC曲线分析。结果提示白术、莪术药对抗肿瘤核心靶点表达水平用于判断肿瘤患者预后的曲线下面积(AUC)均>0.5。在预测乳腺浸润癌患者临床结局时,AKT1表达水平的预测能力有一定准确性(AUC=0.796),其次为VEGFA、GRM3。在预测结肠腺癌患者临床结局时,VEGFA表达水平的预测能力有较高准确性(AUC=0.965),其次为GRM3、AKT1。在预测肝细胞肝癌患者临床结局时,VEGFA表达水平的预测能力有一定准确性(AUC=0.731),其次为GRM3、AKT1。(见图21)
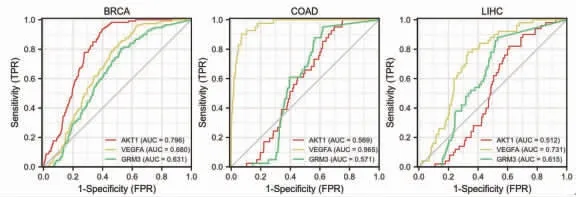
图21 AKT1、VEGFA、GRM3 表达水平预测患者临床结局的ROC 曲线分析
鉴于肿瘤组织VEGFA表达水平在前述预测临床预后结局中的重要性,笔者进一步探讨了TCGA肿瘤患者的临床预后情况。结合生存曲线分析发现,VEGFA的表达与结肠腺癌患者的无病生存期及肝细胞肝癌患者的总生存期、无病生存期有相关性,且VEGFA表达水平高者,预后较差,但VEGFA的表达与乳腺浸润癌患者的总生存期、无病生存期无明显相关性。(见图22)
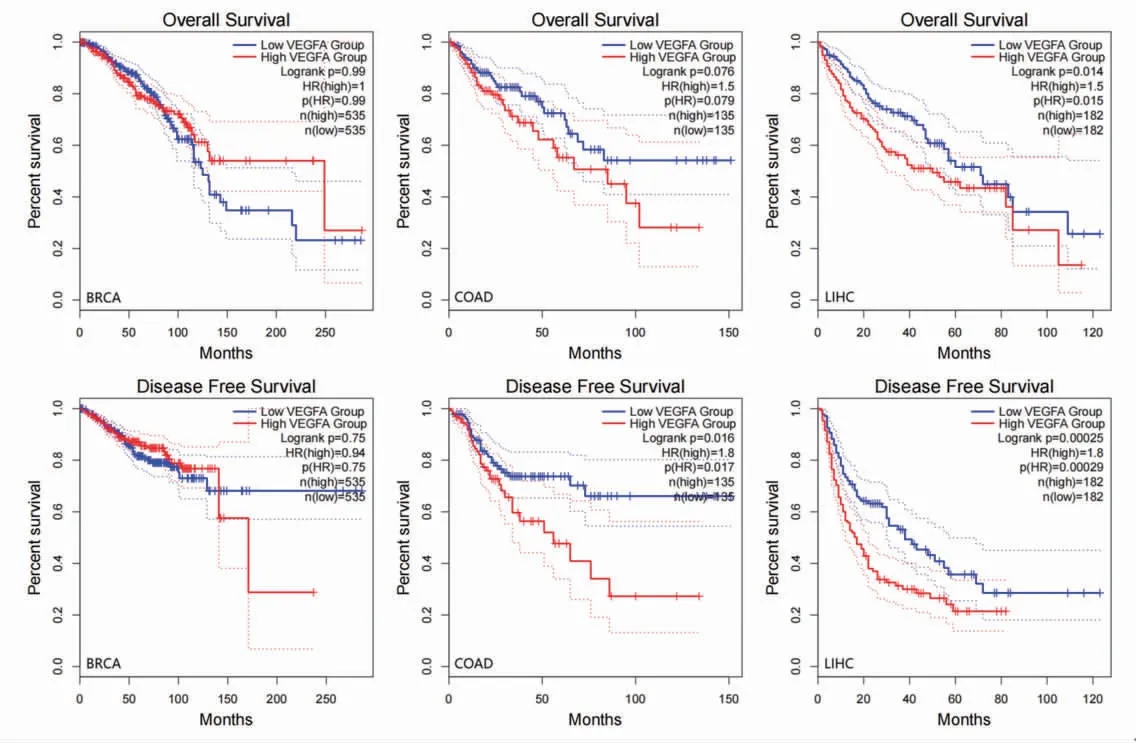
图22 VEGFA 表达水平在肿瘤患者总生存期和无病生存期中的预后价值
3 讨论
缪希雍《本草经疏》[28]言:“若夫妇人、小儿气血两虚,脾胃素弱,而无积滞者,用之(莪术)反能损真气”,还指出“当与健脾开胃、补益元气药同用”。因此,白术配伍莪术的运用也见于诸多临床名家的报道,如陆拯[29]采用白术反佐莪术取其健脾消癥的作用;朱南孙应用该配伍燥湿除痰而通经消积,消补相伍,用于治疗经闭、卵巢囊肿、子宫肌瘤、子宫内膜异位症等疾病[30];李乾构取两药健脾行气活血、消积散结除痞,用于治疗萎缩性胃炎等疾病[31]。肿瘤患者可因情志、饮食、外邪等多种因素导致气滞血瘀痰凝之证[32-33],白术配伍莪术对上述病因病机有较强的针对性。有研究[34]报道,白术可以调节肠胃功能、增强机体免疫力,其活性成分对多种肿瘤有抑制作用。莪术具有行气破血、消积止痛的功效,其中莪术油制剂、莪术醇等均可直接杀伤肿瘤细胞。此外,莪术还有调节免疫、抑制血管生成、逆转肿瘤耐药等作用[35]。
本研究基于网络药理学相关研究方法,通过对白术、莪术药对抗肿瘤靶点的分析,提示该药对可应用于治疗乳腺癌、肝癌、前列腺癌、肠癌、肺癌、胃癌、膀胱癌等多种肿瘤疾病。富集分析结果表明,白术、莪术药对抗肿瘤的潜在作用机制涉及凋亡、炎症反应、缺氧应答以及cAMP、Rap1、雌激素、甲状腺激素、PPAR、HIF-1信号通路等。这些机制与肿瘤的发生发展均有密切联系,且多种机制之间又相互影响。如缺氧是肿瘤微环境的特点之一,缺氧诱导因子(HIFs)及其关联机制协助细胞适应缺氧环境,而HIF-1作为信号枢纽,影响了多种肿瘤转录因子和信号分子的活性[36]。Ras和Rap1协同启动和维持ERK信号,ERK在多种恶性肿瘤中被激活,是重要的治疗靶点[37]。雌激素信号通路及其关键的代谢调节剂之间相互干扰,可以改变乳腺肿瘤细胞的代谢,并促使细胞适应灌注不良、短暂的营养剥夺和酸度的增加等环境,进一步导致细胞侵袭、转移和耐药[38]。
营养支持可以改善肿瘤患者的营养状况,但也会促进肿瘤细胞的生长,调整某些氨基酸的用量或比例,可以调节机体免疫、抑制肿瘤生长[39]。一些补益中药氨基酸含量丰富,有学者通过对四君子汤、四物汤、八珍汤的研究,指出氨基酸是补益或扶正中药治疗虚证的物质基础[40]。白术含有多种氨基酸,如谷氨酸、天冬氨酸、丝氨酸、精氨酸等,也包括多种人体必需氨基酸,如苯丙氨酸、缬氨酸、苏氨酸、异亮氨酸等[41]。分子对接结果提示白术所含苯丙氨酸、谷氨酸可以分别与核心靶点AKT1、GRM3结合,蛋白互作网络结果提示白术、莪术药对抗肿瘤靶点包括多个谷氨酸受体,富集分析也提示作用机制涉及谷氨酸受体信号通路。苯丙氨酸可以显著增加胰腺α-淀粉酶、胰蛋白酶等消化酶的合成和释放[42],且有研究[43]表明,胰腺腺泡细胞中蛋白质的合成主要由PI3K-AKT-mTOR途径介导。此外,苯丙氨酸能够优化肠道菌群[44],白术可调节肠易激综合征小鼠的苯丙氨酸代谢通路等[45]。不同的肿瘤中有不同亚型的谷氨酸受体表达,激活或阻断谷氨酸受体可影响肿瘤细胞的生长或迁移[46]。有研究发现,代谢型谷氨酸受体3(GRM3)可以介导细胞凋亡[47]。白术所含有的其他氨基酸对肿瘤的发生发展也有重要影响,如有研究发现谷氨酸和天冬氨酸可以抑制人肝癌细胞增殖,且联合使用可增强其抗增殖活性,并抑制AKT的磷酸化[48]。还有数据表明,在非超重人群中,基线膳食谷氨酸摄入量与较低的大肠癌发生风险有关[49]。
富集分析结果还提示白术、莪术药对通过VEGF信号通路发挥抗肿瘤作用,分子对接结果提示莪术所含成分球松素、西托糖苷均与相应靶点VEGFA有结合潜能。VEGFA介导血管生成[50],莪术具有调控VEGF的作用[51],球松素、西托糖苷均具有抗肿瘤、抗炎、抗氧化等多种药理活性[52-53],球松素查尔酮能够抑制VEGF诱导的人脐静脉内皮细胞增殖和迁移[54]。西托糖苷亚麻酸酯、西托糖苷亚油酸酯、西托糖苷棕榈酸酯等均可激活异位种植乳腺肿瘤组织中的Caspase-3、Caspase-9,下调VEGF、BCL-2、BCL-XL,抑制PI3K/AKT/NF-κB通路,延缓肿瘤的生长[55]。
基于白术、莪术作用疾病谱的网络药理学分析结果,笔者选取乳腺癌、肝癌、肠癌做进一步临床意义分析。基于TCGA临床病例的分析结果提示,白术、莪术药对抗肿瘤核心靶点AKT1、VEGFA、GRM3的表达水平对乳腺浸润癌、结肠腺癌、肝细胞肝癌这3种肿瘤患者的预后均有不同程度的影响。其中,VEGFA在这3种肿瘤组织中的表达均异常升高,且VEGFA表达水平高者,结肠腺癌、肝细胞肝癌等肿瘤患者的预后也相对较差。研究结果提示白术、莪术药对具有通过调控相关靶点影响肿瘤患者预后的潜在价值。
分析结果还提示,白术、莪术药对可能通过调控NFKB1、STAT3、TP53等转录因子发挥抗肿瘤作用。其中,NF-κB信号通路的异常激活与癌变过程密切相关[56];STAT3的持续激活是多种实体瘤中常见的促炎致癌特征[57];TP53是一种肿瘤抑制因子,激活后可进一步参与凋亡和衰老、细胞周期阻滞、DNA损伤修复等多个生物学过程[58]。
肿瘤细胞通常具有十到数千个突变,且即使在相同组织类型的肿瘤中,大多数突变也是不同的[59]。这种不稳定性也导致免疫治疗成为较热门的研究方向。如近年来PD-1/PD-L1抗体药物的应用即日趋广泛。免疫细胞浸润丰度分析结果提示,白术、莪术药对有干预免疫细胞及炎性反应、改善肿瘤微环境进而发挥抗肿瘤作用的潜能。有研究发现,白术主要成分白术内酯Ⅰ能够显著提升细胞毒性T淋巴细胞对肿瘤细胞的杀伤作用,还能有效促进肿瘤细胞的抗原呈递,与免疫检查点抑制剂PD-1联合应用能够起到协同增效的作用[60]。
以上分析表明,基于网络药理学相关方法,可以挖掘白术、莪术药对抗肿瘤的潜在作用机制。结果也提示,该药对是通过多成分、多靶点协同起效的方式发挥抗肿瘤作用的,且相关靶点有一定的临床预后意义,为进一步实验和临床研究提供了思路。
